团簇Ni4P的热力学稳定性及电子性质
2020-06-11吕孟娜方志刚
吕孟娜,方志刚,廖 薇
(辽宁科技大学 化学工程学院,鞍山114051)
非晶态合金是一种原子呈无规则排列的合金,其结构具有短程有序及长程无序的特点。因此与常规晶体相比,其具有优越的物理[1]、化学[2-3]及力学性能[4],且被广泛运用于工程、精密机械、信息及航空航天等领域,成为提高性能的关键材料[5]。其中非晶态金属Ni因具有较好的延展性、可锻性及抗高温氧化性能而常用于化学镀层[6-7],所形成的保护膜具有较强的耐腐蚀[8]和耐磨损[9]性能。此外,高性能的Ni-P非晶态合金因具有较好的稳定性[10]而成为近年来发展最为快速的一种新型表面保护和表面强化的关键材料,并且已经在机械、冶金、航空、化工及石油等方面得到广泛应用[11]。但是目前常见的均是对于三元体系有关性能的研究。例如,文献[12]通过添加WC纳米粒子可对典型的Ni-P镀层进行改性,发现涂层的显微硬度随纳米颗粒的存在而增加,且化学镀Ni-P-WC镀层由于其特殊的结构,耐蚀性也显著提高;文献[13]通过采用氧化石墨烯(GO)作为钴的水解催化剂,发现在Ni2P中掺入Co可有效地优化Ni2xCoxP催化剂的电子结构,降低了反应势垒,从而大大提高了催化效率;文献[14]发现在泡沫镍上直接生长含碳的三元Ni-Fe-P多孔纳米棒,表现出良好的催化活性,可作为一种双功能催化剂,实现了水的全分解。而对于二元体系Ni-P的研究多从宏观角度出发,而微观角度的理论研究较少。文献[15]发现Ni-P合金的性能易受P含量的影响,随P含量的减少,电子转移方向发生改变;文献[16]发现当Ni和P的比例为4∶1时,Ni-P 合金在共晶点具有最强非晶形成能力。因此,本文以团簇Ni4P为构型,从能量、电荷量及各原子轨道Mulliken布居数变化量角度研究其热力学稳定性及电子性质,以期为获得性能更加优异的Ni-P非晶态合金提供有价值的理论依据。
1 模型建立及计算方法
根据拓扑学原理[17],对团簇Ni4P进行空间设计,得到所有可能存在的10种初始构型。利用密度泛函理论[18]的方法,在B3LYP/Lanl2dz水平下对团簇Ni4P的初始构型分别于二、四重态下进行全参数优化计算,最终得到其稳定构型。其中,对金属Ni采用文献[19]的含相对论校正的有效核电势价电子从头开始计算基组,即18-eECP的双ξ基组,且P加极化函数ξpd=0.55[20]。所有计算均在启天M7150微机上采用Gaussian09程序[21]完成。
2 实验结果与讨论
2.1 团簇Ni4P的优化构型
团簇Ni4P进行优化后,排除相同构型及含虚频的不稳定构型后,共得到6种稳定的优化构型。其中二重态及四重态各为3种,如图1所示。以能量最低的构型1(4)为参考构型,设其能量为0 kJ·mol-1,其余构型按能量由低到高顺序进行排列编号。右上角括号内的数字代表自旋多重度。
由图1可见,团簇Ni4P依据空间结构的差异可将优化构型分为3大类,分别为三角双锥型、四棱锥型和单帽三角双锥型。构型1(4)和1(2)的空间结构相同,均为三角双锥,其中构型1(4)是以平面Ni1-P-Ni4作为基准面,Ni2和Ni3分别作为锥顶和锥底原子;构型1(2)则以平面Ni4-P-Ni3作为基准面,Ni2和Ni1分别作为锥顶和锥底原子;构型2(4)是唯一的四棱锥,其Ni1-Ni2-Ni3-Ni4为基准面,以P为锥顶;构型2(2)是以Ni1-Ni2-Ni3为基准面,P为锥顶原子,Ni4为帽顶原子的单帽三角双锥;而构型3(2)和3(4)的原子空间排位完全相同,均是以Ni3-Ni4-Ni2为基准面,以P和Ni1分别作为构型的锥顶和锥底原子。
2.2 稳定性分析
为了探究团簇Ni4P的稳定性,可采用各构型相比较的方法对其稳定性大小进行比较,假设团簇Ni4P的合成路线为4Ni+P→Ni4P。表1为团簇Ni4P各构型的能量参数,包含校正能(EZPE)、吉布斯自由能(G)、吉布斯自由能变(ΔG)及结合能(EBE)。由表1可知,构型1(4)和1(2)的校正能数值相等(-1 795 161.996 kJ·mol-1)且小于其他构型,说明两者的热力学稳定性较强。又因构型1(4)的吉布斯自由能变比构型1(2)的小,证明在按照给定路线合成团簇Ni4P这种构型时反应自发能力较强,又因其结合能比1(2)大,则其稳定性较强,证明构型1(4)比构型1(2)的稳定性好,即在空间结构相同的条件下,四重态构型比二重态构型稳定性好。构型2(4)和2(2)分别为四棱锥型和单帽三角双锥型,其能量值介于构型1(4)和3(2)之间,并且构型2(4)的校正能小于构型2(2),说明空间结构的不同对构型稳定性有影响。构型3(4)和3(2)虽重态不同,但两者各能量参数数值均相同,且校正能均大于其他构型,因此稳定性较差。综上所述,团簇Ni4P各优化构型稳定性大小关系为:1(4)>1(2)>2(4)>2(2)>3(4)=3(2)。且整体来看,在多数情况下,四重态构型稳定性优于二重态构型。
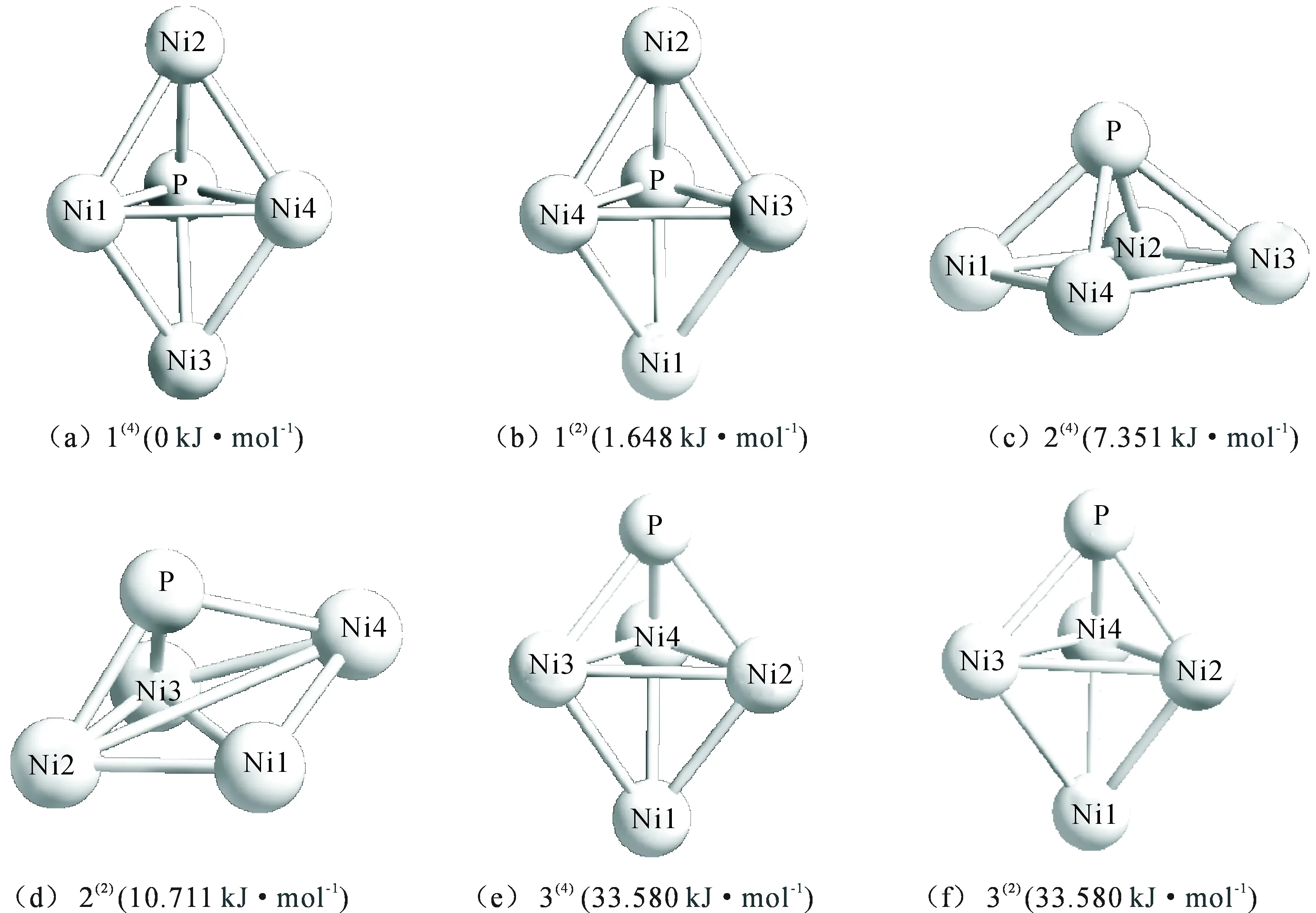
图1团簇Ni4P的优化构型
Fig.1Schematic of the optimized configurations of cluster Ni4P

表1 团簇 Ni4P 的能量参数
为了探究团簇Ni4P构型的能量变化趋势,根据表1中的吉布斯自由能变和结合能数据绘制出折线图如图2所示。由图2(a)可知,随着构型能量的升高,结合能呈递减趋势且均为正值,证明随构型能量的升高,其稳定性逐渐减弱,其中构型1(4)~2(2)下降趋势较为平缓,2(2)~3(4)下降幅度较大。反之,由图2(b)可知,各构型吉布斯自由能变呈递增趋势且均为负值,证明随构型能量的升高,其自发反应程度减弱,其中构型1(4)~2(2)上升趋势较为平缓,2(2)~3(4)上升幅度较大。由图2可见,EBE与ΔG的变化趋势相反且具有对称关系。其中构型3(4)和3(2)的ΔG最大(-701.008 kJ·mol-1)且EBE最小(827.032 kJ·mol-1),则这两种构型的自发反应程度最弱及各原子之间相互吸引的能力最弱,结合程度最弱,因此稳定性最弱;而构型1(4)的ΔG最小(-737.766 kJ·mol-1)且EBE最大(861.164 kJ·mol-1),说明自发反应程度最强及各原子之间相互吸引的能力最强,结合程度最强,因此稳定性最强。综上所述,构型1(4)的稳定性最好,构型3(4)和3(2)的稳定性最弱。

图2 团簇 Ni4P稳定构型的结合能EBE和吉布斯自由能变ΔG变化趋势图
2.3 电子性质分析
2.3.1 各原子所带电荷量
为探究团簇Ni4P各原子内部电子流向,可通过比较各原子所带电荷量大小进行判断,见表2。其中ΣNi代表Ni原子电荷量之和,由表2可知,所有优化构型的ΣNi均为负值,与之相反,P原子所带电荷量均为正值,且各个构型内部ΣNi和P原子所带电荷量的数值分别为相反数,表现出对称性,使构型整体呈电中性。又因电荷量正值代表有电子流出,负值代表有电子流入,说明构型2(4)中的电子流向是从Ni2及P原子流向其他Ni原子,且各构型内部电子流向均为从P原子流向∑Ni原子。此外,Ni和P原子因在不同构型中空间位置的差异,其所带电荷量也随之改变,证明原子之间的电子流动能力受构型空间结构的影响。构型1(4)~2(2)的ΣNi和P所带电荷量的绝对值较大(≥0.134 eV),证明这4种构型的电子流动能力相对较强,而3(4)~3(2)所带电荷量绝对值较小(0.023 eV),证明这2种构型的电子流动能力相对较弱。
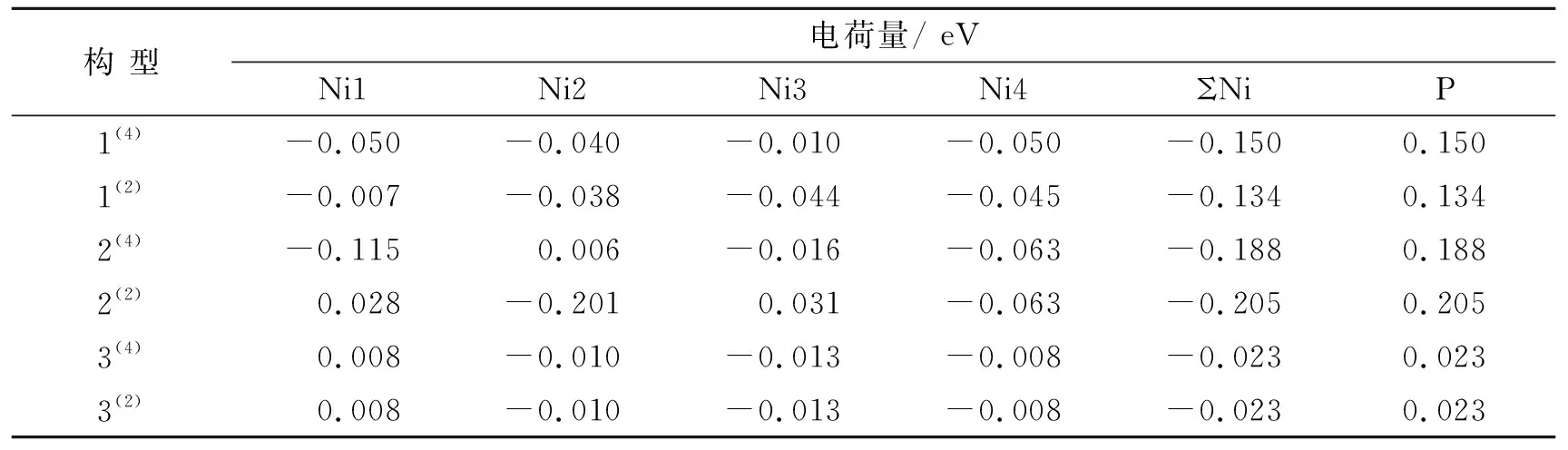
表2 团簇Ni4P中各个原子的电荷量
为更加直观地分析团簇Ni4P的电子性质,将表2中各构型ΣNi和P原子的电荷量数据绘制成折线图如图3所示。由图3可见,构型所带电荷量绝对值在1(4)~1(2)及2(2)~3(4)中呈递减趋势,其中构型1(4)及1(2)为不同重态下的三角双锥构型,证明自旋多重度对电子流动性有影响;而2(2)和3(4)分别为单帽三角双锥和三角双锥型,则空间结构的差异对构型内部原子间电子流动性质也有一定的影响。而构型1(2)~2(2)中ΣNi和P原子所带电荷量的绝对值呈现递增趋势,则电子流动能力逐渐增强。整体来看,构型2(2)的Ni和P原子所带电荷量绝对值最大,可见该构型中Ni原子接受电子能力最强,P原子提供电子能力最强,综合说明单帽三角双锥构型电子流动能力最强。而构型3(4)和3(2)的Ni和P原子所带电荷量绝对值最小,可见该构型中Ni原子接受电子的能力最弱,P原子提供电子的能力最弱,证明三角双锥构型电子流动能力较弱。
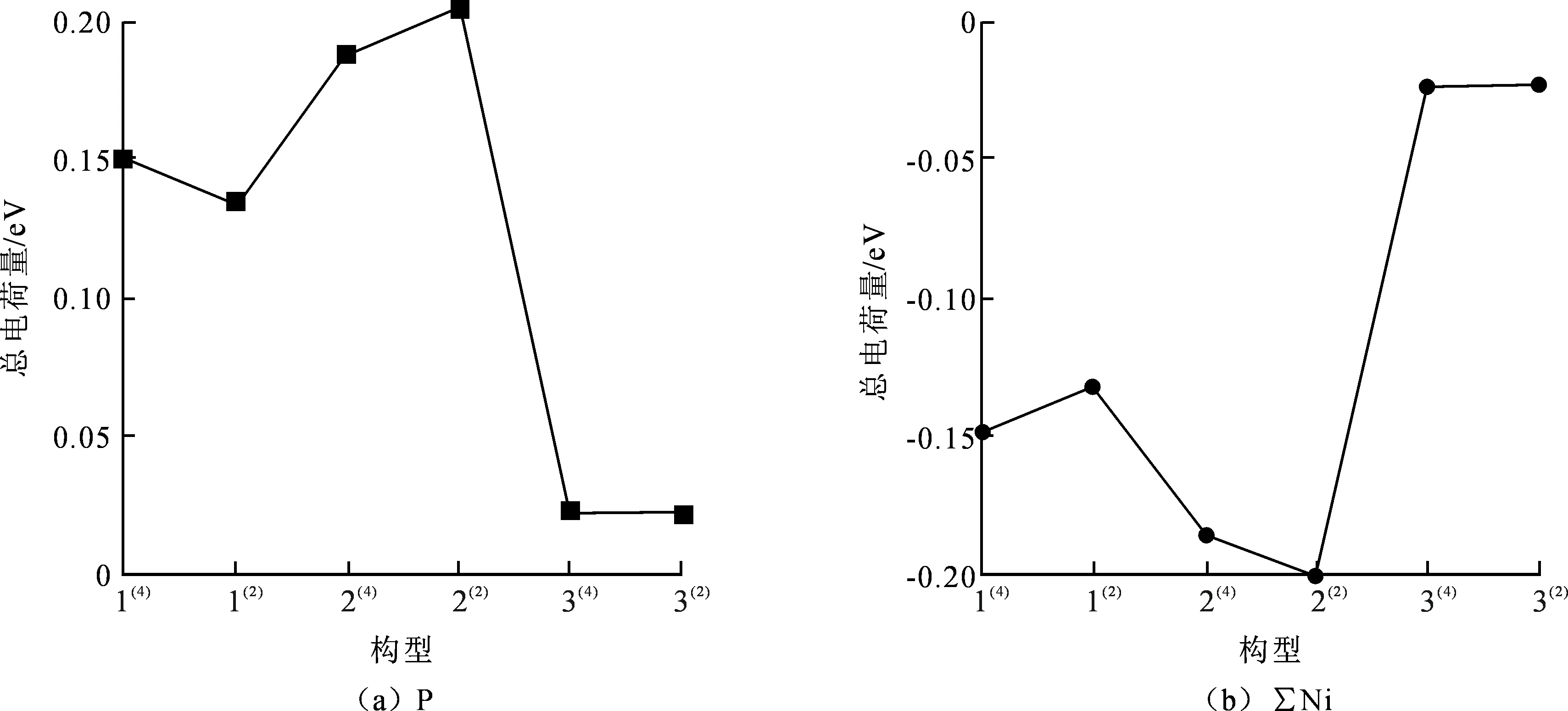
图3 团簇Ni4P的原子所带电荷量
2.3.2 各原子轨道的MulliKen布居数
团簇Ni4P内部不同原子的电子性质还可从各原子轨道的MulliKen布居数进行分析,不同轨道布居数的变化幅度大小即代表该轨道电子流动能力的强弱,团簇Ni4P各原子轨道所带布居数数值见表3。由表3可知,除构型3(4)和3(2)各轨道布居数变化量完全相同外,其余各构型原子轨道布居数变化量的数值均不相同且不为零,则原子中各个轨道均参与电子流动且流动能力大小均不同。与电荷量相反,若轨道布居数的变化量为正值,则代表有电子流入该轨道,若轨道布居数为负值,则代表有电子流出。

表3 团簇Ni4P各原子轨道Mulliken布居数变化量
根据表3中团簇Ni4P的各原子轨道数据,将Ni和P原子不同轨道的布居数平均变化量列于表4,以便更全面地分析Ni和P原子间的电子流动情况。由表4可知,Ni-4s轨道布居数平均变化量均为负值,3p和3d轨道均为正值,表明Ni原子内部的电子流动方向是由4s轨道流向3p和3d轨道,并且Ni原子整体的电子流入量大于流出量,证明Ni原子主要得电子。P-3s轨道布居数平均变化量均为负值,表明在所有优化构型中该轨道均表现为流出电子的性质;而3p轨道数值有正有负,则该轨道既有电子流入又有电子流出;3d轨道则均为正值,说明其所呈现的电子流动情况与3s轨道相反,即表现为流入电子的性质,说明P原子的电子整体流动流出量大于流入量,证明P原子主要失电子。因此,团簇Ni4P内部电子主要从P原子流向Ni原子。但是整体来看,不同构型的Ni和P原子各轨道布居数相差不大,则不同构型之间的电子流动能力相当。
根据表4中Ni和P原子各轨道布居数平均变化量作折线图如图4所示。
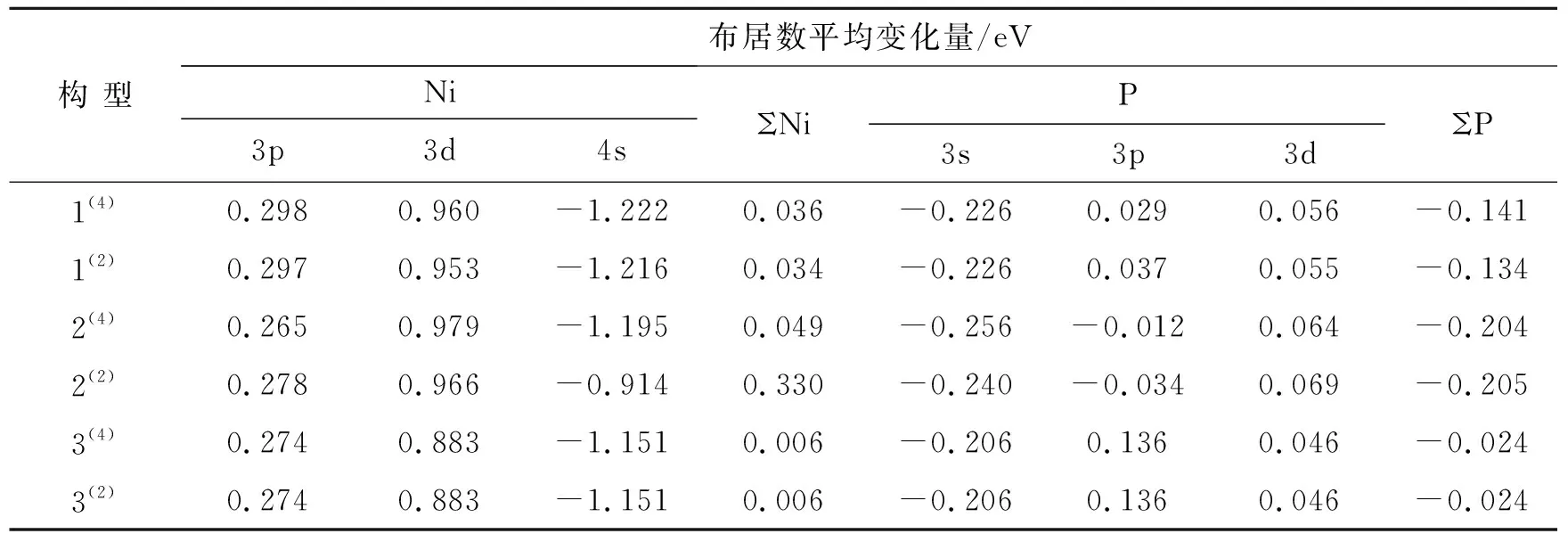
表4 团簇Ni4P中Ni和P原子轨道Mulliken布居数平均变化量

图4 团簇Ni4P各原子轨道Mulliken布居数变化量
由图4可见,Ni原子的3个轨道布居数平均变化量的变化趋势各不相同,则该原子中各轨道之间电子流动的相互作用较弱。随着各轨道的布居数平均变化量变化得平缓,该原子的电子流动能力也呈现相似情况,若各轨道的布居数平均变化量变化得急促,该原子的电子流动能力也呈现相差较大的情况;且P-3p和P-3d轨道之间布居数平均变化量变化趋势相反,证明该原子的3p和3d两轨道之间的电子流动具有相互抑制作用。其中Ni-4s轨道的布居数平均变化量的绝对值大于3p和3d轨道,则4s轨道在该原子中电子流动能力最强。同样地,P-3s轨道的布居数平均变化量的绝对值远大于3p和3d轨道,则3s轨道在该原子中电子流动能力最强。从整体流动来看,Ni原子的电子主要由Ni-4s流向Ni-3p和Ni-3d,而P原子的电子则主要由P-3s流向P-3d。
3 结 论
本文通过对团簇Ni4P的热力学稳定性和电子性质进行探究,从能量、电荷量及各原子轨道Mulliken布居数变化量角度对各构型进行分析,得出结论为
1) 构型1(4)的热力学稳定性最好,构型3(2)和3(4)的热力学稳定性最差;构型所处重态及各原子的空间位置均将对其热力学稳定性产生影响,且四重态构型稳定性优于二重态。
2) 因所有优化构型中Ni和P原子所带电荷量数值互为相反数,则构型整体均呈现电中性,且由于Ni均为负,P均为正,说明电子是由P原子流向Ni原子;构型2(2)的Ni和P原子所带电荷数量值最大,则构型2(2)的电子流动能力最强,反之,构型3(4)和3(2)的电子流动能力最差。
3) 电子流动能力受空间结构与自旋多重度的影响。其中Ni和P原子的s轨道在电子流动中起主要作用,整体来看,Ni原子的电子主要由Ni-4s流向Ni-3p和Ni-3d,而P原子的电子主要由P-3s流向P-3d。
