基于“增效-减毒”的附子盐制辅料的比较研究
2020-06-09张存艳刘红梅魏蔼玲袁明昊郭力陈胡兰叶强
张存艳 刘红梅 魏蔼玲 袁明昊 郭力 陈胡兰 叶强

中圖分类号 R917;R283.2 文献标志码 A 文章编号 1001-0408(2020)10-1223-05
DOI 10.6039/j.issn.1001-0408.2020.10.13
摘 要 目的:比较生附子及其5种盐制炮制品中6种酯型生物碱成分的含量,为优化附子盐制工艺提供参考。方法:分别以胆巴、氯化镁、氯化钠、氯化钙、氯化钾为辅料炮制生附子,并采用高效液相色谱法测定生附子及上述5种盐制炮制品中6种酯型生物碱的含量;采用效/毒比、毒性成分指数评价生附子及其5种盐制炮制品的效果和毒性。结果:苯甲酰新乌头碱、苯甲酰次乌头碱、苯甲酰乌头碱、新乌头碱、乌头碱、次乌头碱检测质量浓度的线性范围分别为2.440~24.40、2.240~22.40、2.020~20.20、2.780~27.80、2.240~22.40、2.240~22.40 μg/mL(r≥0.999 0);精密度、稳定性、重复性试验的RSD均小于2%;加样回收率分别为102.13%~104.87%(RSD=0.98%,n=6)、100.00%~105.00%(RSD=2.02%,n=6)、95.00%~99.29%(RSD=1.77%,n=6)、100.41%~104.58%(RSD=1.78%,n=6)、98.87%~99.90%(RSD=0.41%,n=6)、100.20%~104.00%(RSD=1.55%,n=6)。总生物碱含量由高到低依次为生附子>氯化钠炮制品>胆巴炮制品>氯化钾炮制品>氯化钙炮制品>氯化镁炮制品。效/毒比由大到小依次为氯化钾炮制品>氯化镁炮制品>氯化钠炮制品>氯化钙炮制品>胆巴炮制品>生附子;毒性成分指数由大到小依次为生附子>氯化钠炮制品>胆巴炮制品>氯化钙炮制品>氯化钾炮制品>氯化镁炮制品。结论:以5种盐为辅料的炮制方法均具有不同程度的 “增效-减毒”功效,其中以氯化镁、氯化钾、氯化钙炮制效果为佳,可用于附子的炮制。
关键词 附子;盐制辅料;增效-减毒;高效液相色谱法;酯型生物碱;含量测定
Comparative Study on the Salt-processed Excipients for Aconite Based on “Efficacy Enhancing and Toxicity Reducing”
ZHANG Cunyan,LIU Hongmei,WEI Ailing,YUAN Minghao,GUO Li,CHEN Hulan,YE Qiang(School of Pharmacy, Chengdu University of TCM/State Key Laboratory of TCM Resource System Research and Development Utilization, Southwest Genuine Medicinal Materials Collaborative Innovation Center, Chengdu 611137, China)
ABSTRACT OBJECTIVE: To compare the contents of 6 kinds of ester alkaloids in raw aconite and 5 kinds of salt-processed products, and to provide reference for the optimization of salt-processing technology. METHODS: Processed with bittern, magnesium chloride, sodium chloride, calcium chloride and potassium chloride as excipients,and HPLC method were adopted to determine the contents of 6 kinds of ester alkaloids in raw aconite and 5 kinds of salt-processed products. The effect/toxicity ratio and toxicity component index were used to evaluate the effect and toxicity of raw aconite and 5 kinds of salt-processed products. RESULTS: The linear range of benzoylneoaconitine, benzoylhypoconitine, benzoylaconitine, neoaconitine, aconitine and hypoconitine were 2.440-24.40, 2.240-22.40, 2.020-20.20, 2.780-27.80, 2.240-22.40, 2.240-22.40 μg/mL (r≥0.999 0). RSDs of precision, stability and repeatability tests were all less than 2%. The recovery rates were 102.13%-104.87% (RSD=0.98%, n=6), 100.00%-105.00% (RSD=2.02%, n=6), 95.00%-99.29% (RSD=1.77%, n=6), 100.41%-104.58% (RSD=1.78%, n=6), 98.87%-99.90% (RSD=0.41%, n=6), 100.20%-104.00% (RSD=1.55, n=6), respectively. The contents of total alkaloids in order from the largest to the smallest was as follows: raw aconite>processed products of sodium chloride>processed products of bittern>processed products of potassium chloride>processed products of calcium chloride>processed products of magnesium chloride. The order of effect/toxicity ratio was processed products of potassium chloride>processed products of magnesium chloride>processed products of sodium chloride>processed products of calcium chloride>processed products of bittern>raw aconite. The order of toxicity component index was raw aconite>processed products of sodium chloride>processed products of bittern>processed products of calcium chloride>processed products of potassium chloride>processed products of magnesium chloride. CONCLUSIONS: Using 5 kinds of salt as excipients, the processing technology has different degrees of “efficacy enhancing and toxicity reducing” effect. Among them, magne- sium chloride, potassium chloride and calcium chloride are better for processing and can be used for processing aconite.
KEYWORDS Aconite; Salt-processed excipients; Efficacy enhancing and toxicity reducing; HPLC; Ester alkaloid; Content determination
附子为毛茛科植物乌头(Aconitμm carmichaelii Debx.)子根的加工品,具有回阳救逆、补火助阳、散寒止痛的功效[1]。现代研究表明,酯型生物碱既是附子的有效成分,又是其毒性成分[2],其中双酯型生物碱(如乌头碱、次乌头碱、新乌头碱等)是导致附子中毒的主要成分,同时也是其具有强心、抗炎和镇痛等作用的主要活性物质;但这类物质性质不稳定,在湿热条件下其8位上的乙酰基易发生水解,得到相应的单酯型生物碱,如苯甲酰乌头碱、苯甲酰新乌头碱、苯甲酰次乌头碱等,故炮制能将附子中具有毒性的双酯型生物碱转化为具有临床疗效且毒性较小的单酯型生物碱,因此临床常以炮制品入药[3]。附子炮制首见于《伤寒论》[4],后又衍生出炒、煨、盐制等多种炮制方法[5],但大多已被淘汰,只有盐制法沿用至今,并以胆巴为辅料进行炮制,以达到减毒、增效和防腐的目的[6]。2015年版《中国药典》(一部)中记载的附子炮制品盐附子、黑顺片、白附片均以胆巴浸泡[7]。但在此炮制过程中,胆巴可导致大量生物碱成分流失,使得有效成分的含量降低[8-9];此外,一些生产加工企业用胆巴浸泡后未将药材彻底漂洗干净,由于胆巴对皮肤、黏膜有较强的刺激作用,可抑制中枢神经系统,若服用过量可引起中毒反应[10]。2015年版《中国药典》(一部)并未明确规定胆巴的浸泡时间和用量,故目前市场上用胆巴炮制的附子质量参差不齐,临床应用时有中毒事件发生,严重影响了附子临床疗效[11]。
本课题组前期研究发现,炮制辅料胆巴中含有大量的氯化镁、氯化钠、氯化钙等无机盐[10]。基于此,本研究按2015年版《中国药典》(一部)“附子”项下“白附片”的炮制方法[1],在前期优化胆巴炮制工艺[10]的基础上,分别采用氯化镁、氯化钙、氯化钾、氯化钠炮制附子,同时通过测定其中苯甲酰新乌头碱、苯甲酰次乌头碱、苯甲酰乌头碱、新乌头碱、乌头碱、次乌头碱的含量变化来评价4种盐制附子炮制品与胆巴炮制品、生附子的区别;采用效/毒比、毒性成分指数(TCI)评价生附子及其不同盐制炮制品的效果和毒性,旨在为附子盐制规范的建立及炮制工艺的完善提供参考,亦为中药附子无胆炮制新工艺的确定提供依据。
1 材料
1.1 仪器
1260型高效液相色谱仪,包括四元泵、柱温箱、紫外检测器、LC1260色谱工作站(美国Agilent公司);SHB-Ⅲ型循环水式多用真空泵(郑州杜甫仪器厂);KQ5200型超声波清洗器(昆山市超声仪器有限公司);Rotavapor R-210型旋转蒸发仪(瑞士Buchi公司);ΜPT-Ⅱ-107型优普系列超纯水器(成都超纯科技有限公司);BP221S型十万分之一电子分析天平(德国Satorious公司);101-2AB型电热鼓风干燥箱(北京中兴伟业仪器公司)。
1.2 药品与试剂
新鲜附子由四川江油中壩附子加工厂提供,经成都中医药大学药学院龙飞教授鉴定为毛莨科乌头属植物乌头(A. carmichaelii Debx.)的子根。
乌头碱对照品(批号:MΜST-18110905,纯度:98.01%)、新乌头碱对照品(批号:MΜST-18111308,纯度:99.04%)、次乌头碱对照品(批号:MΜST-19080210,纯度:99.09%)、苯甲酰乌头碱对照品(批号:MΜST-19032406,纯度:98.99%)、苯甲酰新乌头碱对照品(批号:MΜST-19032807,纯度:99.73%)、苯甲酰次乌头碱对照品(批号:MΜST-18110710,纯度:99.66%)均购自成都曼斯特生物科技有限公司;胆巴(食品级,江油恒源药业集团有限公司,批号:20190217);氯化镁(批号:2019051801)、氯化钙(批号:2019050201)、氯化钾(批号:2019112301)、氯化钠(批号:2019022101)均购自成都市科隆化学品有限公司;乙腈、四氢呋喃均为色谱纯,异丙醇、二氯甲烷均为分析纯,水为超纯水。
2 方法与结果
2.1 附子炮制品的制备
2.1.1 生附子 将新鲜附子表面泥土洗净,去须根,纵切成约0.3 cm的薄片,于37 ℃烘干,即得。
2.1.2 附子盐制炮制品 将新鲜附子表面泥土洗净,去掉须根后,放入含40%胆巴的水溶液(“花水”)中,以胆巴水溶液淹没附子为宜,每日上下翻动1次,7 d后捞出,此时附子外皮色黄亮,质松软,为“胆附子”。将泡过附子的胆水(“老水”)煮沸,将胆附子倒入,以“老水”淹没胆附子为宜,煮15~20 min,中途上下翻动1次,煮至透心,捞起,放入缸内,以“老水”+清水(1 ∶ 1,V/V)浸泡1 d,得“冰附子”。取“冰附子”剥去表皮,以“老水”+清水(1 ∶ 1,V/V)浸泡过夜,中途搅动1~2次,将浸泡后的附子捞出,纵切成约0.3 cm的薄片,放入清水中浸泡48 h后换超纯水再浸泡12 h,取出浸泡好的附子,放入蒸笼,蒸至蒸气上顶后计时,以60 min为宜,将蒸好的附子于日光下曝晒(不可重叠),晒至近干,即成色泽白亮的白附片(即胆巴炮制品)。按上述工艺分别以氯化钙、氯化镁、氯化钠、氯化钾(浓度均为40%)代替胆巴,制得氯化钠炮制品、氯化钙炮制品、氯化钾炮制品、氯化镁炮制品[12]。
2.2 含量测定
2.2.1 色谱条件 色谱柱:Dikma Dianonsil C18(250 mm×4.6 mm,5 μm);流动相(A):乙腈-四氢呋喃(25 ∶ 15,V/V),流动相(B):0.1 mol/L醋酸铵水溶液(每1 000 mL含冰醋酸0.5 mL),梯度洗脱(0~14 min,15%A→16%A;14~65 min,16%A→18%A;65~90 min,18%A→20%A;90~95 min,20%A);检测波长:235 nm;柱温:30 ℃;流速:1.0 mL/min;进样量:20 μL。
2.2.2 混合对照品溶液的制备 分别精密称取苯甲酰新乌头碱、苯甲酰次乌头碱、苯甲酰乌头碱、新乌头碱、乌头碱、次乌头碱对照品适量,置于同一10 mL量瓶中,加异丙醇-二氯甲烷(1 ∶ 1,V/V)混合溶液至刻度,混匀,即得上述6种成分质量浓度分别为122、112、101、139、112、112 μg/mL的混合对照品溶液。
2.2.3 供试品溶液的制备 取“2.1”项下生附子及不同盐制炮制品各适量,粉碎,过三号筛;取粉末各2.0 g,精密称定,均按2015年版《中国药典》(一部)“附子”项下方法[1]制备供试品溶液。
2.2.4 阴性对照溶液的制备 以异丙醇-二氯甲烷(1 ∶ 1,V/V)混合溶液为阴性对照溶液。
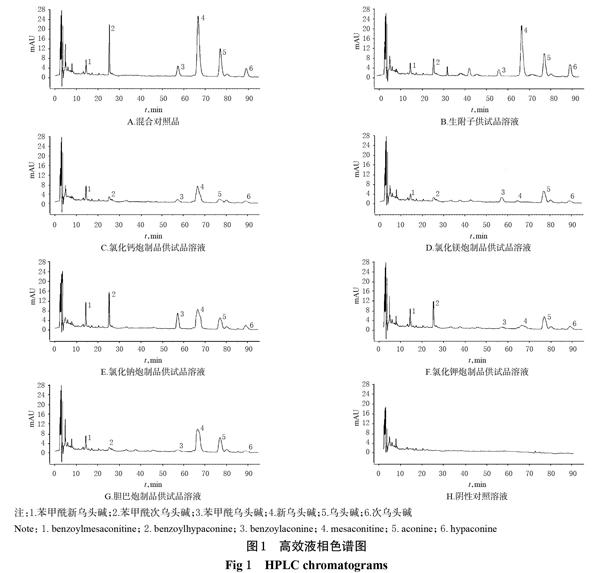
2.2.5 系统适用性试验 取上述混合对照品溶液、供试品溶液、阴性对照溶液各适量,按“2.2.1”項下色谱条件进样测定,记录色谱图。结果,各待测成分的理论板数均大于5 000,分离度均大于1.5,阴性对照对测定无干扰,详见图1。
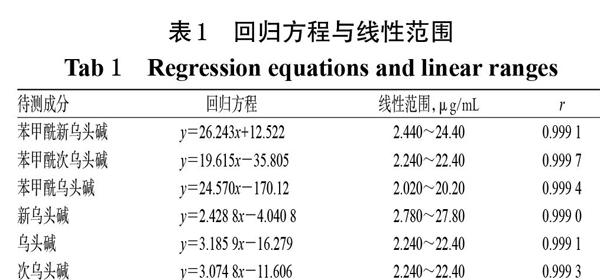
2.2.6 线性关系考察 精密吸取“2.2.2”项下混合对照品溶液适量,以异丙醇-二氯甲烷(1 ∶ 1,V/V)混合溶液稀释,制得不同质量浓度的系列线性工作溶液,按“2.2.1”项下色谱条件进样测定,记录峰面积。以待测成分的质量浓度(x,μg/mL)为横坐标、峰面积(y)为纵坐标进行线性回归,结果见表1。
2.2.7 精密度试验 取“2.2.2”项下混合对照品溶液适量,以异丙醇-二氯甲烷(1 ∶ 1,V/V)混合溶液稀释,制得苯甲酰新乌头碱、苯甲酰次乌头碱、苯甲酰乌头碱、新乌头碱、乌头碱、次乌头碱质量浓度分别为12.20、11.20、10.10、13.90、11.20、11.20 μg/mL的溶液,按“2.2.1”项下色谱条件连续进样测定6次,记录峰面积。结果,苯甲酰新乌头碱、苯甲酰次乌头碱、苯甲酰乌头碱、新乌头碱、乌头碱、次乌头碱峰面积的RSD分别为0.86%、1.64%、1.86%、1.17%、1.66%、1.98%(n=6),表明仪器精密度良好。
2.2.8 重复性试验 精密称取生附子粉末,每份2.0 g,共6份,按“2.2.3”项下方法制备供试品溶液,再按“2.2.1”项下色谱条件进样测定,记录峰面积并按外标法计算样品中6种成分的含量。结果,苯甲酰新乌头碱、苯甲酰次乌头碱、苯甲酰乌头碱、新乌头碱、乌头碱、次乌头碱含量的RSD分别为1.90%、0.60%、1.40%、1.00%、0.50%、0.68%(n=6),表明本方法重复性良好。
2.2.9 稳定性试验 取“2.2.3”项下供试品溶液(生附子)适量,分别于室温下放置0、4、8、12、16、20 h时,按“2.2.1”项下色谱条件进样测定,记录峰面积。结果,苯甲酰新乌头碱、苯甲酰次乌头碱、苯甲酰乌头碱、新乌头碱、乌头碱、次乌头碱峰面积的RSD分别为0.23%、0.46%、0.52%、0.32%、0.63%、0.26%(n=6),表明供试品溶液在室温下放置20 h内稳定性良好。
2.2.10 加样回收率试验 精密称取已知含量的生附子粉末,每份1.0 g,共6份,加入一定量的混合对照品,按“2.2.3”项下方法制备供试品溶液,再按“2.2.1”项下色谱条件进样测定,记录峰面积并计算加样回收率,结果见表2。
2.2.11 样品含量测定 精密称取生附子及不同盐制炮制品粉末各2.0 g,分别按“2.2.3”项下方法制备供试品溶液,再按“2.2.1”项下色谱条件进样测定,平行测定3次,记录峰面积并按外标法计算样品含量,结果见表3[表中,“-”表示未检出;总生物碱含量(mg/g)=(单酯型生物碱质量+双酯型生物碱质量)/炮制品质量×100%,单酯型生物碱百分含量(%)=单酯型生物碱含量×10-3×100%;双酯型生物碱百分含量(%)=双酯型生物碱含量×10-3×100%;单酯型生物碱成分包括苯甲酰乌头碱、苯甲酰次乌头碱、苯甲酰新乌头碱,双酯型生物碱成分包括次乌头碱、新乌头碱、乌头碱]。
由表3可知,经炮制后,不同盐制炮制品中双酯型生物碱成分含量均明显低于生附子,表明盐类辅料会促进双酯型生物碱成分水解转化。总生物碱含量由高到低依次为生附片>氯化钠炮制品>胆巴炮制品>氯化钾炮制品>氯化钙炮制品>氯化镁炮制品,表明以盐类辅料炮制附子可使总生物碱含量降低。
2.3 效/毒比分析
有研究显示,双酯型生物碱成分是附子主要的毒性成分,而单酯型生物碱成分则具有较强的药效活性,尤以苯甲酰乌头碱较为显著[3,13-14]。由于这些生物碱的毒效差异较大,故本研究采用效/毒比(效/毒比=单酯型生物碱含量/双酯型生物碱含量,该值越大表示药效越强、毒性越弱、品质较优[15])比较生附片及其不同盐制炮制品中各成分含量的差异,结果见表4。由表4可知,效/毒比由大到小依次为氯化钾炮制品>氯化镁炮制品>氯化钠炮制品>氯化钙炮制品>胆巴炮制品>生附子,表明以氯化钾、氯化镁、氯化钠、氯化钙为辅料炮制所得炮制品中活性成分含量较高、毒性成分含量较低。
2.4 TCI分析
TCI是一种采用面积归一化法得到的毒性校正系数。本研究通过整合附子毒性成分的含量来计算TCI,以达到评价附子药材及炮制品以量评毒效的目的[16-17]。TCI=0.338 7×新乌头碱含量+0.183 5×次乌头碱含量+0.477 8×乌头碱含量,TCI越小表示样品质量越优、毒性越小[15]。生附子及其不同盐制炮制品TCI见表4。由表4可知,生附子及其不同盐制炮制品的TCI为0.005 1~0.702 6,由大到小依次为生附子>氯化钠炮制品>胆巴炮制品>氯化钙炮制品>氯化钾炮制品>氯化镁炮制品,表明附子未炮制前毒性最大,经不同盐类辅料炮制后其毒性均有不同程度的降低,其中以氯化镁为辅料炮制后的附子毒性最小。
3 讨论
2015年版《中国药典》(一部)规定,附子炮制品含双酯型生物碱以次乌头碱(C33H45NO11)、新乌头碱(C33H45NO10)和乌头碱(C34H47NO11)的总量计,不得超过0.010%。本研究结果显示,氯化钙、氯化镁、氯化钾炮制品中双酯型生物碱含量占比分别为0.009 9%、0.002 8%、0.008 7%,均小于0.010%,符合药典规定,表明以氯化钙、氯化镁、氯化钾为炮制辅料炮制附子均能达到减毒的目的;而氯化钠、胆巴炮制品中双酯型生物碱含量占比分别为0.017 4%、0.013 1%,高于药典标准,表明以氯化钠、胆巴为辅料炮制附子虽然也有减毒的效果,但不能使其毒性成分含量降低至药典规定范围内,还需联合其他炮制方法以进一步达到去毒的目的。
《本草图经》[18]中记载附子“善腐”,明代以前采用醋浸防腐,明代以后则采用盐腌法,而现代已逐渐演变为胆巴炮制法[19]。附子用胆巴浸泡可达到防腐的目的[6],但由于后续炮制过程复杂且需用清水多次漂洗,这种操作不适用于附子的大批量产地加工。本研究结果发现,不同盐溶液均可不同程度地降低附子中总生物碱及双酯型生物碱成分的含量,验证了《药笼小品》“土人以盐腌之,其性愈减”[20]及《本草从新》“土人以盐腌之,欲减其力”[21]的科学性。本研究结果还显示,不同盐制附子炮制品的效/毒比均高于胆巴炮制品及生附子,TCI除氯化钠炮制品(亦低于生附子)外,均低于胆巴炮制品,表明附子经盐炮制后可实现减毒增效的目的。
综上所述,以5种盐为辅料的炮制方法均具有不同程度的“增效-减毒”功效,其中以氯化镁、氯化钾、氯化钙炮制效果为佳,可用于附子的炮制。
参考文献
[ 1 ] 国家药典委员会.中华人民共和国药典:一部[S].2015年版.北京:中国医药科技出版社,2015:177-178.
[ 2 ] 杨洋,杨光义,冯光军,等.附子炮制前后化学成分及药效毒理学研究[J].时珍国医国药,2019,30(11):2724-2727.
[ 3 ] YANG X,DAI J,GUO D,et al. Changes in the properties of Radix Aconiti Lateralis Preparata(Fuzi,processed aconite roots)starch during processing[J]. J Food Sci Technol,2019,5(1):24-29.
[ 4 ] 魏旭雅,邱子栋,陈金龙,等.有毒乌头类中药炮制与配伍减毒机制的研究进展[J].中国中药杂志,2019,44(17):3695-3704.
[ 5 ] 凡若楠,张依欣,于武华,等.附子炮制的研究进展[J].江西中医药,2019,50(10):66-70.
[ 6 ] 杨千千,郝学贤,张辰露,等.不同浓度胆巴液浸泡下附子中生物碱含量变化研究[J].中国现代中药,2018,20(9):1137-1141、1145.
[ 7 ] 石万银.无胆附片加工工艺及其质量控制研究[D].成都:成都中医药大学,2012.
[ 8 ] 陈雪,王冬阁,冯正平,等.胆巴浸泡在附子加工中固形作用的探究[J].时珍国医国药,2019,30(10):2384-2388.
[ 9 ] 刘雨诗,刘红梅,叶强,等.胆巴炮制对附子生物碱类成分的影响研究[J].中药新药与临床药理,2019,30(4):472-477.
[10] 刘红梅.胆巴炮制对附子化学成分及神经毒性影响[D].成都:成都中医药大学,2018.
[11] 唐雪春,宋苹,欧爱华.附子临床应用安全性文献系统评价[J].新中医,2008,40(4):95-97.
[12] 彭成.中华道地药材:上[M].北京:中国中医药出版社,2011:1293-1319.
[13] MIAO LL,ZHOU QM,PENG C,et al. Discrimination of the geographical origin of the lateral roots of aconitum carmichaelii using the fingerprint,multicomponent quantification,and chemometric methods[J]. Molecules,2019.DOI:10.3390/molecules24224124.
[14] 斯琴巴特尔,席琳图雅,青格勒,等.附子生物碱类化学成分的研究进展[J].世界最新医学信息文摘,2019,19(98):50-51、55.
[15] 楊正明,威则日沙,李学学,等.基于多元统计分析的川产道地药材江油附子和川乌中6种生物碱含量比较研究[J].中草药,2019,50(6):1461-1471.
[16] 张定堃,王伽伯,杨明,等.中药品质整合评控实践:附子品质综合指数[J].中国中药杂志,2015,40(13):2582-2588.
[17] 张定堃.中药质量整合评控模式和方法研究[D].成都:成都中医药大学,2016.
[18] 苏颂.本草图经:附子[M].尚志钧,辑校.合肥:安徽科技出版社,1994:256.
[19] 强小娟,朱智慧,姜黎,等.附子减毒方式与药效浅析[J].中医药导报,2018,24(1):34-36.
[20] 彭静山.药笼小品[M].沈阳:辽宁科学技术出版社,1983:71.
[21] 吴仪洛.本草从新[M].上海:上海科学技术出版社,1958:94.
(收稿日期:2020-02-19 修回日期:2020-04-09)
(编辑:陈 宏)
