不同植被根际土壤中可培养与未培养黏细菌的多样性研究
2020-06-09原红娟朱红惠
原红娟 朱红惠


摘要:为探索不同植被根际可培养黏细菌与未培养黏细菌的多样性,采用传统的辅助菌诱导方法,对样品的黏细菌进行分离纯化,通过形态特征结合16S rDNA基因的序列分析,确定黏细菌菌株的系统分类地位;利用基于黏细菌特异性引物的变性梯度凝胶电泳(denaturing gradient gel electrophoresis,DGGE)分析黏细菌的多样性。结果显示,从不同植被根际土壤中共分离得到19株,初步鉴定为黏球菌属(Myxococcus)11株,珊瑚球菌属(Corallococcus)13株,孢囊杆菌属(Cystobacter) 2株,多囊菌属(Polyangium)1株,其中,红树林分离得到的黏细菌种类最多,共7株;樟木最少,为2株。PCR-DGGE分子指纹图谱技术对其黏细菌多样性结果显示,花梨木、铁木、亚热带常绿阔叶林、针叶林、红树林、樟木根际土壤中黏细菌的物种丰度分别为16、24、34、26、30、24,多样性指数分别为2.10、2.53、3.49、2.62、2.77、2.73。DGGE指纹图谱显示,越南不同植被根际土壤存在大量的未培养黏细菌,其技术研究黏细菌多样性比传统分离纯化的方法方便、快速。本研究为黏细菌开发利用和多样性研究提供理论与技术参考依据。
关键词:PCR-DGGE(聚合酶链式反应-变性梯度凝胶电泳);根际土壤;黏细菌;多样性
中图分类号: S182文献标志码: A
文章编号:1002-1302(2020)07-0264-05
黏细菌是一类革兰氏阴性细菌,具有复杂的形态发生行为[1],可形成多细胞的子实体结构和抗逆的黏孢子。在系统进化上,黏细菌位于变形菌门(Proteobacteria)的δ变形菌亚纲(Deltaproteobacteria)[2],共分属3个亚目、8个科、23个属、50多个种[3-7]。黏细菌产生的次级代谢产物具有结构新颖、种类多、作用机制多样的特性,目前被公认为是仅次于放线菌之后的第二类药源微生物的新类群[8-9]。
目前,对黏细菌的多样性研究一直以来都是采用平板培养分离方法[10-15],这种传统分离方法不仅耗时耗力,而且不能很好地反映土壤黏细菌多样性的初始状态,因为土壤中许多存活但不可培养的黏细菌不能被分离与鉴定。利用分子生物学方法可以克服传统分离方法的缺陷[16]。目前尚未有不同植被根际土壤可培养与未培养黏细菌多样性研究的相关报道。本研究采用传统的辅助菌诱导方法,对样品的黏细菌进行分离纯化,通过形态结合16S rDNA基因的序列分析,确定黏细菌的系统分类地位;利用基于黏细菌特异性引物的变性梯度凝胶电泳(DGGE)[17]分析黏细菌的多样性。
1 材料与方法
1.1 试验材料
1.1.1 样品采集 采集越南菊芳国家公园花梨木、铁木、亚热带常绿阔叶林、针叶林、红树林和樟木的根际土壤,为防止霉菌的污染,立即自然室温风干,放入4 ℃冷库保存备用。
1.1.2 主要培养基[7] 水琼脂培养基 (WCX) 、VY/2 培养基、LB培养基。
1.2 试验方法
1.2.1 样品处理 取风干的土样2.5~3.0 g,用含100 μg/mL放线菌酮的无菌水浸泡过夜,6 000 r/min 离心5 min收集样品。
1.2.2 黏细菌子实体的诱导 用E.coil、Achromobacter sp.2种被捕食菌菌浆在WCX培养基上划十字交叉线,30 min后在十字线交叉点处接种大豆大小的经放线菌酮处理的土样,30 ℃恒温培养,4 d后观察子实体的形成。
1.2.3 纯化与保藏 挑取可疑菌株接种于LB 液体培养基进行验纯,纯化的菌株分别用VY/2斜面培养基、15%甘油及冻干管保藏。
1.2.4 土壤DNA的提取及扩增 土壤DNA的提取使用Magen公司的土壤DNA提取试剂盒,按照说明书进行。PCR扩增:mglA基因的半巢式PCR扩增[18],使用引物分别为mglA1F(5′-[JP9]CGCGAAATCAACTGCAAGAT-3′)与mglA5R(5′-[JP9]GGCAGGTCGCGCTTGTTGTACTG-3′);及引物mglA4F(5′-[JP9]CAGGTGTTCTACGACGCCA-3′)与 mglA5R(5′-[JP9]GGCAGGTCGCGCTTGTTGTACTG-3′)[19]。PCR扩增体系均为25 μL:10×PCR 缓冲液5.0 μL,10 μmol/L dNTPs 1.0 μL,10 μmol/L mglA1F(或mglA4F)1 μL,10 μmol/L mglA5R 1 μL,Taq DNA聚合酶(5 U/μL)0.5 μL,ddH2O 20 μL。第1轮PCR反应条件为:95 ℃预变性5 min;95 ℃变性45 s,56 ℃退火45 s,72 ℃延伸30 s,共进行35 个循环;最后72 ℃ 延伸10 min。第2轮PCR采用touch-down PCR,反应条件为:95 ℃预变性5 min;95 ℃变性45 s,65 ℃退火45 s,72 ℃延伸30 s,10个循环;95 ℃ 变性45 s,55 ℃退火45 s,72 ℃延伸30 s,25個循环;最后72 ℃延伸10 min。反应完成后,PCR产物用1.0%琼脂糖凝胶电泳检测,4 ℃保存待用。
1.2.5 DGGE分析
DGGE参考Muyzer等的方法[17],所用的仪器为美国Bio-rad公司的DCodeTM Universal Mutation Detection System电泳系统。DGGE电泳所用的胶浓度为8% (丙烯酰胺/甲叉双丙烯酰胺37.5 ∶1),变性剂为尿素和甲酰胺,其浓度梯度为40%~75%,电泳缓冲液为1×TAE,上样缓冲液为溴酚蓝,电泳电压70 V,电流100 mA,电泳时间720 min。将第2次PCR产物浓缩至20 μL用于DGGE分析。电泳完成后,将DGGE产物于Goldview核酸染色剂染色0.5 h,凝胶成像仪中观察结果并照相。利用Quantity One软件分析结果。
2 结果与分析
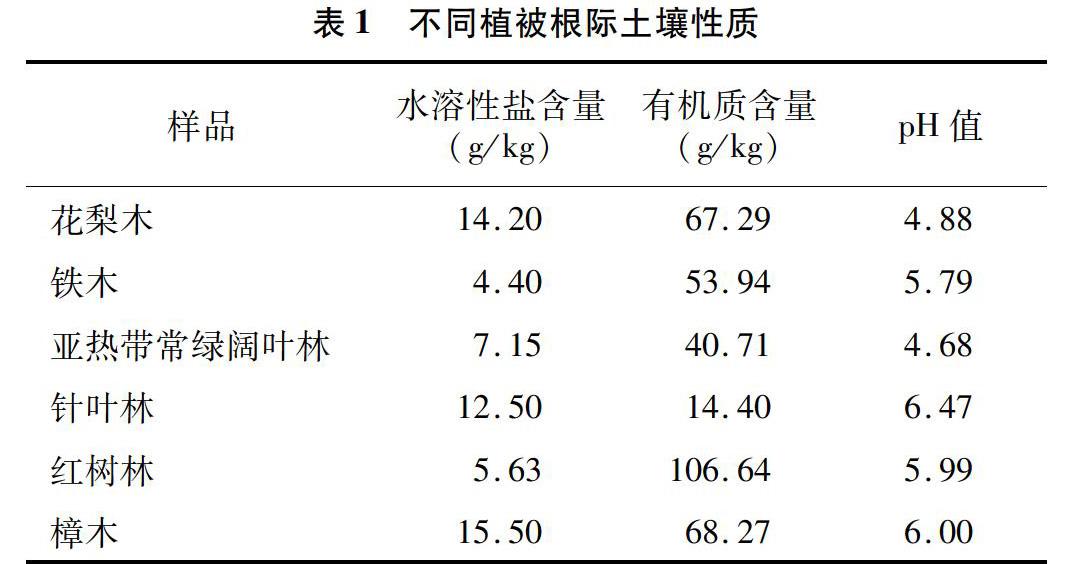
2.1 不同植被根际土壤性质
土壤微生物的量受植被类型的影响,不同的植被类型由于其地上部分生物量的差异,使得土壤中的有机碳量明显不同,不同种类的植被,其枯落物的质量也不尽相同,这2个因素均会影响土壤微生物的活动[20]。由表1可见,土壤平均水溶性盐含量为9.90 g/kg,其中铁木的最低,为4.40 g/kg,樟木的最高,为15.50 g/kg。土壤平均有机质含量较高,为58.54 g/kg,红树林最高,为106.64 g/kg,针叶林最低,为14.40 g/kg。pH 值为4.68~6.47,偏酸。
2.2 不同植被根际土壤可培养黏细菌的分类鉴定
黏细菌的形态特征主要包括营养细胞形态、子实体形态、黏孢子形态以及它们特征性的菌落结构。黏细菌的分类主要保持在形态上,且由于其形态的复杂性决定着形态分类比其他细菌更为可靠[1]。Sprer等曾证实了形态分类是与黏细菌在种水平上的分类相吻合的试验,并认为形态分类对黏细菌新种鉴定仍是一种可靠的手段[21]。根据《Bergeys Manual of Determinative Bacteriology》 (第九版)[22]和《Prokayotes》(第二版)[23]的黏细菌分类标准,分离得到黏球菌属(Myxococcus)11株、珊瑚球菌属(Corallococcus)13株、孢囊杆菌属(Cystobacter)2株(未纯化)、多囊菌属(Polyangium)1株,其中,红树林分离得到的黏细菌种类最多,共7株,其次是铁木和亚热带常绿阔叶林,均为6株,花梨木和针叶林均为3株,樟木最少,为2株(表2)。
橙色黏球菌(Myxococcus fulvus)的子实体橘黄色、球形且比较黏滑;黄色黏球菌(Myxococcus xanthus)的子实体黄色、球状、表面光滑,黏液较多;弱小珊瑚球菌(Corallococcus exiguous)为白色,球形,在自然条件下的子实体较小;珊瑚状珊瑚球菌(Corallococcus coralloides)的子实体形态多样,波浪状或珊瑚状,黄色,较黏滑;孢囊杆菌属(Cystobacter)的孢子囊无柄、单个或成群,圆形或盘卷, 褐色; 叶柄黏球菌(Myxococcus stipitatus)是带柄的黏球菌,子实体黄色或粉色,表面光滑;多囊菌属(Polyangium)子实体白色或粉色,圆形、刻蚀培养基(图1)。
2.3 不同植被根际土壤可培养黏细菌的分子鉴定
黏细菌菌株结合16S rDNA 进行序列分析,将其鉴定到属。6种不同植被根际土壤可培养的黏细菌共分离得到19株,依据黏细菌的形态结构以及16S rDNA 序列分析(图2),利用5个不同种属的黏细菌建立的系统发育树,初步鉴定黏细菌分属于3个属,Ⅰ类为黏球菌属(Myxococcus),Ⅱ类为珊瑚球菌属(Corallococcus),Ⅲ类为多囊杆菌属(Polyangium)。
2.4 DGGE分析不同植被根際土壤黏细菌的多样性
不同植被根际土壤黏细菌DGGE图谱见图3。由表3可知,花梨木、铁木、亚热带常绿阔叶林、针叶林、红树林、樟木根际土壤中黏细菌的物种丰度(S)分别为16、24、34、26、30、24,多样性指数(H )分别为 2.10、2.53、3.49、2.62、2.77、2.73,与可培养黏细菌(表2)相比,土壤中存在大量的未培养黏细菌。而样本间的相似性系数(表4)表明,花梨木与针叶林土壤样品黏细菌相似性系数最低,为2.4%,铁木与红树林土壤样品黏细菌相似性系数最高,为47.4%,说明不同植被下黏细菌群落结构存在差异。
3 讨论与结论
本试验中6种植被根际土壤性质为含盐量较低,有机质含量较高,土质偏酸性。黏细菌通常出现在中性至微碱性的土壤中,在pH值较低的环境中,可能因其营养缺乏,一般仅有黄色黏球菌(Myxococcus xanthus)、 橙色黏球菌(Myxococcus fulvus)、变绿黏球菌(Myxococcus virescens)和珊瑚状珊瑚球菌(Corallococcuscoralloides),偶尔出现多囊菌(Polyangiun) 和蝶形囊球菌(Angiococcus disciformis)。真正的嗜酸性黏细菌还有待继续发现[24-25]。本研究的土壤pH值为 4.68~6.47,除了通常可以分离得到的黏球菌属和珊瑚球菌属,还分离得到在酸性环境中少见的多囊菌属与在酸性环境中未曾报道的孢囊杆菌属,这与黏细菌子实体和黏孢子具有很强的抗逆性,以及越南特殊的土壤微环境有关,使较多种类的黏细菌更适合生存;同时也进一步说明,在酸性环境条件下,不同植被的根际土壤,能为黏细菌提供不同的食物基础和生存生境,黏细菌的多样性也存在差异,6个样品中,樟木根际土壤只分离到2株珊瑚状珊瑚球菌,得到的可培养黏细菌最少;其次是花梨木,分离得到2株橙色黏球菌和1株珊瑚状珊瑚球菌,针叶林分离到2株橙色黏球菌和1株弱小珊瑚球菌;铁木和亚热带常绿阔叶林较多,均为6株,铁木分别为黄色黏球菌、珊瑚状珊瑚球菌、弱小珊瑚球菌和孢囊杆菌,亚热带常绿阔叶林为黄色黏球菌、珊瑚状珊瑚球菌、弱小珊瑚球菌和多囊菌;红树林分离得到的最多,包括橙色黏球菌、黄色黏球菌、叶柄黏球菌、珊瑚状珊瑚球菌、弱小珊瑚球菌和孢囊杆菌,共7株。
为了有效避免在传统分离纯化过程中造成的黏细菌遗传多样性信息的丢失,使得分析结果更真实、全面地反映黏细菌群落结构,利用DGGE图谱进一步分析6种不同植被根际土壤的黏细菌多样性,结果发现土壤中可能存在大量的难培养黏细菌或未培养黏细菌的资源,在分离纯化过程中,黏细菌纯化过程相对较长且不易纯化,可能与土壤中黏细菌的伴生菌难以分离有关,其原因须进一步研究。另一原因,可能由于越南地处北回归线以南,雨量充沛,年平均降水量1 500~2 000 mm,是典型的热带地区,霉菌污染相对较多。由于其特殊的地理环境,需对越南黏细菌挖掘筛选方法进一步改善,以期获得更多的黏细菌类群,丰富黏细菌资源。不同植被覆盖的根际土壤黏细菌资源不同,且有明显差异,说明不同植被覆盖的根际土壤微生境不同,从而决定其群落结构的差异,不同的群落结构可能存在不同的黏细菌类群。
到目前为止,热带亚热带根际土壤黏细菌分离纯化这一特殊生境中黏细菌资源的研究尚处于启蒙阶段,特别是在酸性环境条件下的黏细菌研究,还须继续探索分离纯化方法。黏细菌是一类天然药物筛选资源,在其活性筛选、代谢产物等方面,有待进一步研究。
参考文献:
[1]Reichenbach H. The order Cytophagales[M]//Balous A,Trüper H G,Dworkin M,et al . The prokaryotes. 2nd ed . New York:Spriger-Verlag,1992:3631-3675.
[2]Kaiser D,Losick R. How and why bacteria talk to each other[J]. Cell,1993,73(5):873-885.
[3]Mohr K I,Garcia R O,Gerth K,et al. Sandaracinus amylolyticus gen.nov.,sp.nov.,a starch-degrading soil myxobacterium,and description of Sandaracinaceae fam.nov[J]. International Journal of Systematic and Evolutionary Microbiology,2012,62(5):1191-1198.
[4]Iizuka T,Jojima Y,Hayakawa A,et al. Pseudenhygromyxa salsuginis gen.nov.,sp.nov.,a myxobacterium isolated from an estuarine marsh[J]. International Journal of Systematic and Evolutionary Microbiology,2013,63(4):1360-1369.
[5]Garcia R O,Reichenbach H,Ring M W,et al. Phaselicystis flava gen.nov.,sp.nov.,an arachidonic acid-containing soil myxobacterium,and the description of Phaselicystidaceae fam.nov[J]. International Journal of Systematic and Evolutionary Microbiology,2009,59(6):1524-1550.
[6]Kathrin I M,Ronald O G,Klaus G,et al. Sandaracinus amylolyticus gen.nov.,sp.nov.,astarch-degrading soil myxobacterium,and description of Sandaracinaceae fam.nov[J]. International Journal of Systematic and Evolutionary Microbiology,2012,62(5):1191-1198.
[7]Shimkets L J,Dworkin M,Reichenbach H. The myxobacteria[M]// Dworkin M. The prokaryotes. 3rd ed. Berlin:Springer,2006:31-115.
[8]Reichenbach H. Myxobacteria,producers of novel bioactive substances[J]. Journal of Industrial Microbiology and Biotechnology,2001,27(3):149-156.
[9]Wenzel S C,Müller R. Myxobacteria-‘microbial factories for the production of bioactive secondary metabolites[J]. Molecular Biosystems,2009,5(6):567-574.
[10]李越中,陳 琦. 海洋微生物资源多样性[J]. 生物工程进展,1998. 18(4):34-40.
[11]李越中,李 健,周 璐,等. 我国黏细菌(Myxobacteria)资源的分离与鉴定[J]. 微生物学报,2000,40(6):652-656.
[12]方晓梅,张利平. 黏细菌生态多样性的初步研究[J]. 生物多样性,2001,9(3):207-213.
[13]李艳青,张利平,杨润蕾. 河北省黏细菌物种资源多样性的研究——承德市区及其五县生态样品的研究[J]. 河北科技大学学报,2005,26(3):215-218,224.
[14]张鲜姣,黎志坤,谭志远,等. 新疆阿克苏地区盐碱地黏细菌分离鉴定[J]. 微生物学报,2012,52(2):160-168.
[15]赵智颖,张鲜姣,谭志远,等. 药用植物根系土壤可培养黏细菌的分离鉴定[J]. 微生物学报,2013,53(7):657-668.
[16]李友发,宋 兵,宋亚娜,等. 福建省稻田土壤细菌群落的16S rDNA-PCR-DGGE分析[J]. 微生物学通报,2008,35(11):1715-1720.
[17]Muyzer G,de Waal E C,Uitterlinden A G. Profiling of complex microbial populations by denaturing gradient gel electrophoresis analysis of polymerase chain reaction-amplified genes coding for 16S rRNA[J]. Applied and Environmental Microbiology,1993,59(3):695-700.
[18]Oros-Sichler M,Gomes N C M,Neuber G,et al. A new semi-nested PCR protocol to amplify large 18S rRNA gene fragments for PCR-DGGE analysis of soil fungal communities[J]. Journal of Microbiological Methods,2006,65(1):63-75.
[19]李百元.新疆鹽碱地黏细菌的分离及多样性的研究[D]. 北京:中国科学院大学,2013.
[20]徐秋芳.森林土壤活性有机碳库的研究[D]. 杭州:浙江大学,2004.
[21]Sprer C,Reichenbach H,Stackebrandt E. The correlation between morphological and phylogenetic classification of myxobacteria[J]. International Journal of Systematic Bacteriology,1999,49(3):1255-1262.
[22]Reichenbach H. The Myxococcales[M]//Garrity G M.Bergeys manual of systematic bacteriology:Part 3:The alpha-,beta-,delta-,and epsilon-proteobacteria. 2nd ed. New York:Springer-Verlag,2005:1059-1143.
[23]Reichenbach H,Dworkin M.The Myxobacteria[M]// Balous A,Trüper H G,Dworkin M,et al . The prokaryotes. 2nd ed . New York:Spriger-Verlag,1992:3416-3487.
[24]Dawid W. Biology and global distribution of myxobacteria in soils[J]. FEMS Microbiology Reviews,2000,24(4):403-427.
[25]Li B Y,Yao Q,Zhu H H. Approach to analyze the diversity of myxobacteria in soil by semi-nested PCR-denaturing gradient gel electrophoresis(DGGE)based on taxon-specific gene[J]. PLoS One,2014,9(10):e108877.
