KIF26B在非小细胞肺癌发生发展过程中的表达与功能研究
2020-06-09李芳芳穆登彩杨春艳王磊沈昊郑尚永
李芳芳, 穆登彩, 杨春艳, 王磊, 沈昊, 郑尚永
云南大学医学院, 昆明 650091
肺癌是最常见的恶性肿瘤之一,每年新增病例超过1 400万,死亡人数超过800万[1]。肺癌的发病率正在逐年增加[2]。在中国,肺癌仍然是最常见的癌症,且居癌症死亡率之首[3],其中空气污染是状况恶化的首要原因[4]。通过科研及医务人员在癌症治疗方面的努力,如开发新的治疗方法、发现新的生物治疗靶点,使得在过去的几十年中早期肺癌患者生存率大幅提高,且各个治疗阶段瓶颈都有所突破[5-6]。然而,如后期肺癌细胞发生转移,治疗效果就会十分不佳[6]。因此,早期诊断和新的治疗靶点的发现仍然至关重要。
人类驱动蛋白家族成员26B(KIF26B)是一个由2 108个氨基酸组成[7],编码驱动蛋白家族的成员。在胚胎发生的小鼠模型中KIF26B基因特别参与肢体、面部和体节的发育[8]。在胚胎肾脏发育中,KIF26B在调节与输尿管芽接触的间充质细胞的粘附中起关键作用[8]。KIF26B的过表达已经被证明能够促进N-钙黏蛋白和MHCⅡ类分子之间的相互作用,从而增加细胞黏附力[9-10]。最近研究还发现KIF26B基因有助于肿瘤发生,并赋予某些癌症恶性行为。在胃癌[11]和结直肠癌[12]中过表达KIF26B与肿瘤大小、肿瘤转移和预后不良相关[11]。同时过表达KIF26B基因也能增加骨肉瘤的化疗耐药性[13]。与此同时,驱动蛋白超家族蛋白(KIFs)是与微管结合且与ATP酶活性相关的分子运动蛋白[14],它与癌症发展的机制相关。先前的报道表明,KIF家族中的KIF1B与肺癌的发生发展及其预后有关,与中枢神经系统肿瘤和肝细胞癌症转移有关[15-16]。KIF11在前列腺细胞核中的表达状况作为治疗前列腺癌的生物标记分子[17]。 KIF2A和KIF14的表达水平与乳腺癌患者的淋巴转移相关,在乳腺癌细胞系中敲低KIF3C能够抑制上皮-间质转化(EMT)和转移[18-20]。此外,KIF3C通过敲低诱导G2/M期阻滞降低了乳腺癌细胞的增殖[21-22]。KIF18A通过修复Akt分子的磷酸化参与结直肠癌的发展[23]。最近的研究表明,KIF26B与癌细胞的增殖、迁移、侵袭和耐药性有关[13],KIF26B的高表达与肿瘤大小、肿瘤生长、淋巴结转移、雌激素受体抑制和预后不良呈正相关[10]。在喉腺癌中,KIF26B基因的拷贝数与结直肠腺瘤的易感性明显相关[24]。Wang等[25]发现KIF26B在结直肠癌组织中高表达,其下调可降低结直肠癌细胞的增殖。Zhang等[26]研究表明KIF26B可作为癌基因发挥作用,激活VEGF途径可促进胃癌的增殖和转移。而KIF26B的下调抑制了乳腺癌细胞的增殖、迁移和侵袭[27]。基于此,推测KIF26B与NSCLC的发生发展有密切联系,并且通过EMT影响相关通路蛋白的表达。
本研究旨在确定KIF26B在NSCLC中的生物学功能和分子机制,我们首先检测KIF26B在NSCLC组织中的表达,然后研究KIF26B在细胞增殖、迁移、侵袭、周期和凋亡中的作用和机制,以及EMT通路蛋白的表达变化,以期探究KIF26B在肺小细胞癌发生发展过程中的功能,为临床应用奠定基础。
1 材料与方法
1.1 材料
选用正常对照组细胞BEAS-2B与NSCLC细胞株A549、NCI-H292,均购自昆明动物所细胞中心;Matrigel 基质胶、Transwell 小室购于 BD 公司;转染试剂siRNA和siNC购于GenePharma 公司;Lipofectamine RNAiMAX 购于Invitrogen 公司;Opti-MEM购于Gibco 公司;Primer,1640培养基购于上海 Sangon Biotech 公司;细胞周期检测试剂盒 NO:KGA512购于江苏凯基生物公司;细胞凋亡试剂Annexin V-FITC Apoptosis Detection Kit购于南京诺维赞生物公司。
1.2 细胞培养
培养细胞株 BEAS-2B、A549、NCI-H292细胞用含10%胎牛血清的1640培养基在 5%CO2、37 ℃培养箱内培养。
1.3 TCGA 数据库信息分析
用TCGA数据库分析KIF26B在NSCLC与正常组织的表达差异,进行正常与癌症成对的KIF26B mRNA表达量的差异分析,用Prism绘制表达量差异图谱。
1.4 观察指标
1.4.1 敲低内源性KIF26B基因及siRNA转染NCI-H292和A549细胞实验 选用肺癌细胞株 A549和 H292 (购于昆明动物所),置于含10%胎牛血清 (美国Gibico公司)1640培养液(美国Hyclone公司),37 ℃、5% CO2的孵育箱中培养。实验分为 2 组:敲减对照组(Si-NC)和KIF26B敲减组(Si-KIF26B)。转染 KIF26B SiRNA将肺癌细胞消化、计数,接种于6 cm培养皿,待细胞生长至70%~80% 融合后,按照转染试剂盒说明书进行,用 Lipofectamine RNAiMAX试剂(Invitrogen 公司)、Opti-MEN试剂(Gibco 公司)按照比例配置。分别转染 SiRNA至 NCI-H292细胞和 A549细胞,并设置对照组,培养48 h后弃上清,收集细胞,qPCR法检测敲低效率。
利用Trizol试剂盒(美国Invitrogen公司)提取转染前后肺癌细胞总 RNA,反转录试剂盒(日本 TaKaRa公司)将 RNA反转录成cDNA,采用 SYBRGREEN PCR试剂盒(日本TaKaRa公司)对 KIF26B和内参基因进行PCR,引物序列如表1所示。
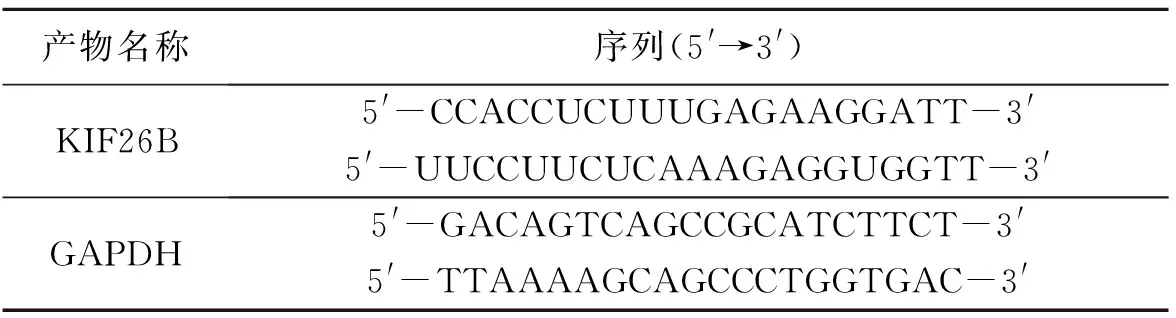
表1 本研究所涉及的引物序列Table 1 All primer sequences used in this research
注:PCR 反应条件:95 ℃ 2 min;95 ℃ 30 s,60 ℃ 40 s,40个循环。
计算细胞的2-ΔΔCt值和RQ值,根据后者计算KIF26B的表达量。实验重复3次,计算时取其平均值。
1.4.2 细胞增殖试验 ①CCK8检测。根据说明书检测细胞增殖情况。具体如下:检测前每孔加入100 mL CCK8试剂,孵育4 h,震荡混匀, 酶标仪检测450 nm波长处的光密度(OD)值。实验时间梯度分别为0、24、48、72 h,实验重复3次,取平均值。
②实时细胞分析仪(RTCA)检测。选取对数生长期的NCI-H292和A549细胞,用胰酶消化计数后加入到E-Plate 16-well板,每孔3 000个·90 μL-1,每种处理均重复2个,每块板接种两个细胞系,加好细胞悬液后将 E-Plate 16-well 板放回RTCA 仪器,检测24 h后将E-Plate 16-well板拿出,每孔加转染混合体系10 μL,最后放回仪器检测72 h。
1.4.3 迁移、侵袭实验 转染KIF26B SiRNA和肺癌细胞胰酶消化、无血清培养基重悬、计数,调整细胞浓度为每毫升5×105个细胞。
①实时细胞分析仪(RTCA)检测。在CIM-Plate 16-wel板的下室加入 165 μL 20% FBS培养基,上室侵袭一侧加入10 μL的基质胶放置2 h待其固定,之后吸出基质胶加入90 μL的无血清培养基于上室后测基线,然后吸尽培养基继续在上室中每90 μL细胞悬液加入1×104个细胞,最后再放入机器检测48 h。
②Transwel检测。取Transwell小室,分别在24孔板上室中加入100 μL无血清培养基和含基质胶的无血清培养基,目的在于先润湿滤膜,润湿后吸尽培养基加细胞悬液,每孔加入3×104个细胞和200 μL细胞悬液,下室加入 800 mL 20% FBS 1640培养基,接着放入培养箱培养48 h。2 d后取出小室固定(1 mL 4%多聚甲醛常温固定 60 min)、染色(1 mL 0.25%结晶紫染液染色 60 min)、观察。
1.4.4 细胞周期、凋亡实验 使用BD FACS Jazz flow cytometer 流式细胞分选仪检测细胞周期倍体的分布、检测细胞凋亡的进程。NCI-H292和A549细胞转染siKIF26B培养48 h。①对于检测细胞的周期:首先,用胰酶消化细胞,离心弃上清,PBS清洗计数5×105个细胞用于实验;其次,固定细胞:加1 mL -20 ℃预冷的70%乙醇(PBS 稀释配制)轻吹重悬细胞,后放于4 ℃冰箱静置,固定过夜,第二天离心,PBS清洗后加500 μL 染色液(PI∶RNase=9∶1),室温避光染色 60 min即可上机器检测。②细胞凋亡实验:依旧用胰酶消化细胞,离心,PBS清洗后计数5×105个细胞,用于实验。特别注意:此处用的胰酶不含 EDTA,因为Annexin V-FITC是依赖钙离子的,而EDTA是钙离子螯合剂,所以采用不含EDTA的胰酶用于凋亡实验。清洗离心后,每管分别加入 5 μL PI、5 μL Annexin V-FITC、100 μL Binding Buffer轻吹混匀,然后室温避光染色10 min,最后再加400 μL Binding Buffer轻吹混匀后上机器检测(细胞周期和凋亡的实验结果均用Flowjo 软件进行分析)。
1.4.5 蛋白印迹 将转染了72 h的NCI-H292和A549细胞用胰酶消化后加入现配制的蛋白裂解液(100 μL lysis+4 μL PI+10 μL PPI),反复吹打混匀后置于冰上裂解 30 min;4 ℃,14 000 r·min-1离心10 min,吸取上层液转移至冰上预冷1.5 mL离心管内,做好标记,-80 ℃保存备用。BCA法测定蛋白浓度,体系如表2所示。加入2 μL待测样本,18 μL ddH2O,200 μL BCA 工作液,置入 37 ℃恒温培养箱中显色反应30 min,取出反应板,5 min 之内使用酶标仪测定波长为 562 nm 处的光密度值。然后进行电泳,封闭,一抗孵育至过夜,曝光。
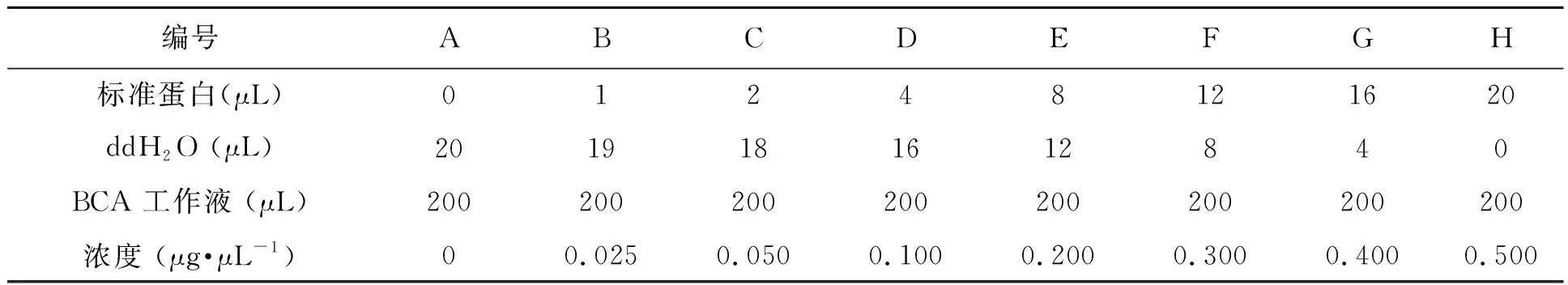
表2 BCA法测定蛋白浓度的体系Table 2 System of protein concentration determination by BCA
1.5 统计学处理
统计分析采用 SPSS 16.0和GraphPad Prism 5.0软件,实验组和对照组之间的差异采用t检验验证。P<0.05 表示差异有统计学意义。
2 结果与分析
2.1 根据TCGA数据库分析KIF26B在NSCLC的mRNA表达水平
从 TCGA(the Cancer Genome Atlas)数据库下载的关于KIF26B的NSCLC患者的mRNA 表达数据,经分析选取了两组信息,第一组样本是:226 例NSCLC 样本和20例正常对照样本(图1A),第二组样本是:58例正常样本与癌症成对样本(图1B),GraphPad Prism 5.0软件经统计分析显示,KIF26B基因的 mRNA 表达水平在 NSCLC 癌组织中是显著上调的。
2.2 敲低内源性KIF26B对KIF26B的mRNA表达水平的影响
选取NCI-H292和A549两个细胞系,验证KIF26B的siRNA的转染效率,由 RT-PCR 结果(图2)显示,siKIF26B能显著敲低 NCI-H292和A549细胞中mRNA 的表达,敲低KIF26B后抑制NSCLC的KIF26B mRNA表达。
2.3 敲低内源性KIF26B对NSCLC增殖能力的影响
肿瘤细胞的恶性增殖是其治愈率低的重要原因之一。为了进一步研究KIF26B的功能,我们探究敲低内源性KIF26B后是否能抑制NSCLC的恶性增殖。通过CCK8实验以及实时细胞分析仪(RTCA)检测细胞增殖能力。CCK8结果显示(图3),转染siRNA敲低了KIF26B 基因后,转染的siKIF26B A549细胞株在24 h后与siNC相比增殖有显著的下降趋势。而转染的siKIF26B NCI-H292细胞株则在48 h后增殖明显下降。RTCA结果表明(图3),敲低KIF26B基因表达能显著抑制 NSCLC 细胞系(NCI-H292和A549细胞)的增殖。RTCA结果显示,转染的siKIF26B A549及NCI-H292细胞株在35 h与siNC相比增殖有显著地下降趋势。结果说明敲低内源性KIF26B后能够抑制NSCLC的恶性增殖。
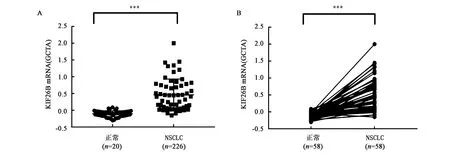
A: 20例正常和226例NSCLC中KIF26B mRNA的表达水平;B: 58例正常和58例NSCLC成对样本KIF26B mRNA的表达水平。***表示数据在P<0.001水平上差异具有统计学意义。图1 TCGA数据库分析KIF26B mRNA在NSCLC中的表达水平Fig.1 The expression levels of KIF26B mRNA in NSCLC tissues from TCGA database

注:Si-NC—对照siRNA转染的细胞;Si-KIF26B—NSCLC中KIF26B的siRNA转染的细胞。*** 表示数据与对照相比在P<0.001水平上差异具有统计学意义。图2 敲低KIF26B后KIF26B mRNA的表达变化Fig.2 The expression of KIF26B mRNA after knockdown of KIF26B
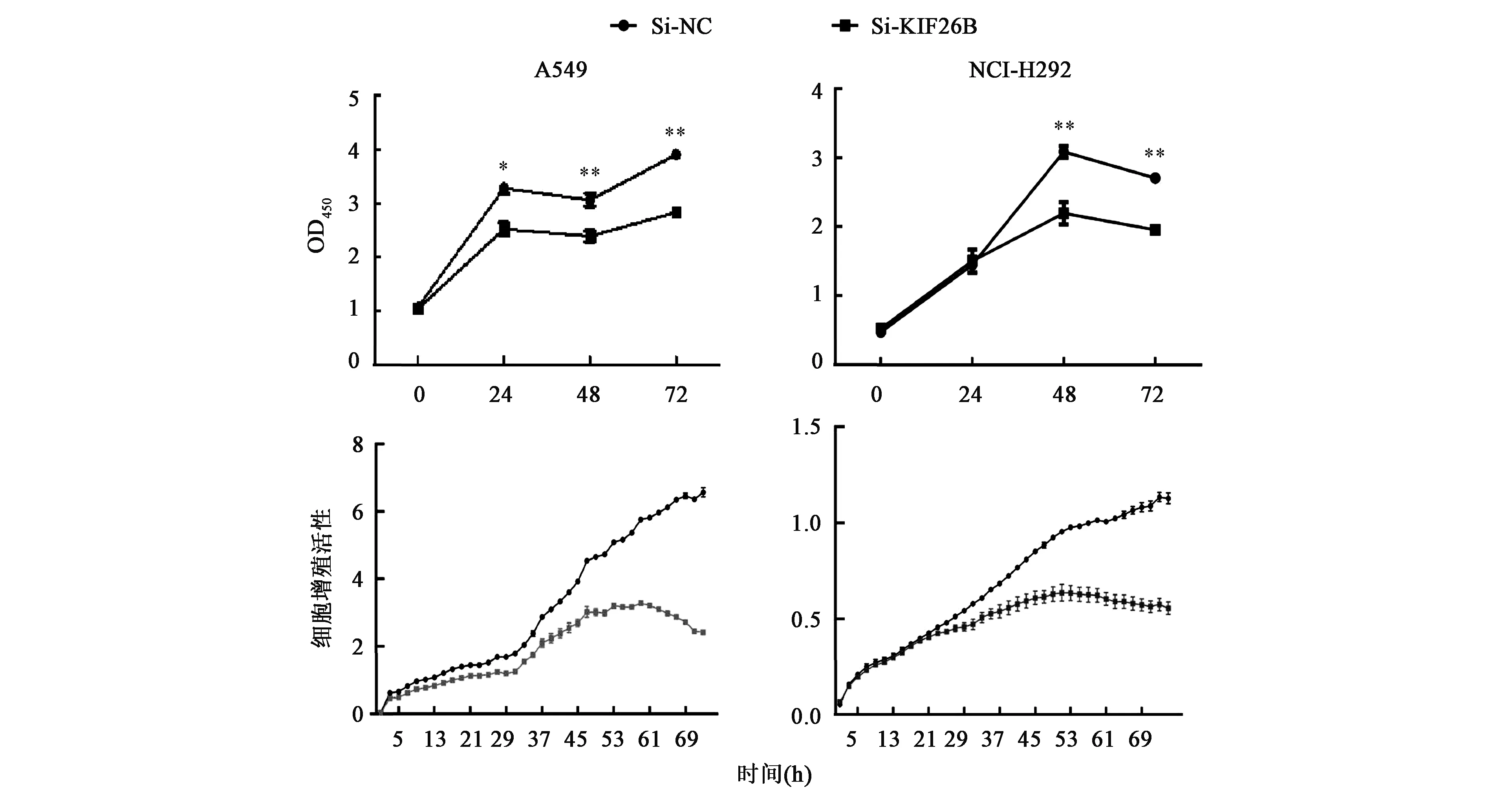
注:**表示数据在P<0.001水平上差异具有统计学意义。图3 敲低KIF26B对非小细胞肺癌细胞增殖的影响Fig.3 Effect of KIF26B knockdown on the proliferation of non-small cell lung cancer cells
2.4 敲低内源性KIF26B对NSCLC的迁移、侵袭能力的影响
检测siRNA 敲低KIF26B的表达后非小细胞肺癌的迁移、侵袭能力是否有变化。Transwell小室检测细胞迁移、侵袭能力,与对照组相比NCI-H292与A549的迁移、侵袭能力明显受到抑制(图4、5),差异具有统计学意义(P<0.001 )。随后又采用RTCA 实时细胞分析法,从实时细胞分析仪监测的曲线图显示(图4),在NCI-H292和A549细胞中,实验组对应的曲线相比于转染了 siNC 的对照组迁移、侵袭能力有明显的下降趋势。
2.5 敲低内源性KIF26B对NSCLC的细胞周期进程的影响
实验中用流式细胞仪对细胞的周期进行分析,检测敲低KIF26B基因表达后,在NCI-H292和A549细胞中,各细胞周期DNA 倍体含量的变化。由于细胞中,DNA合成前期(G1 期)与DNA合成后期(G2期)中,DNA的含量具有两倍关系,因此流式细胞仪检测的结果用 Flowjo 软件圈门时,着重显示二倍关系(如图6所示,图中两个峰的横坐标近似为二倍关系),从实验的结果可以看出,在NCI-H292、A549细胞系中,G0/G1 期向 S 期的转化受到抑制,细胞周期分布图的第一个峰显著上升(图6A),柱状图表现为G0/G1期阻滞,即G0/G1期细胞数显著多于其他时期(图5B)。结果说明,若要抑制细胞的恶性增殖,调节细胞周期也是一个重要途径。
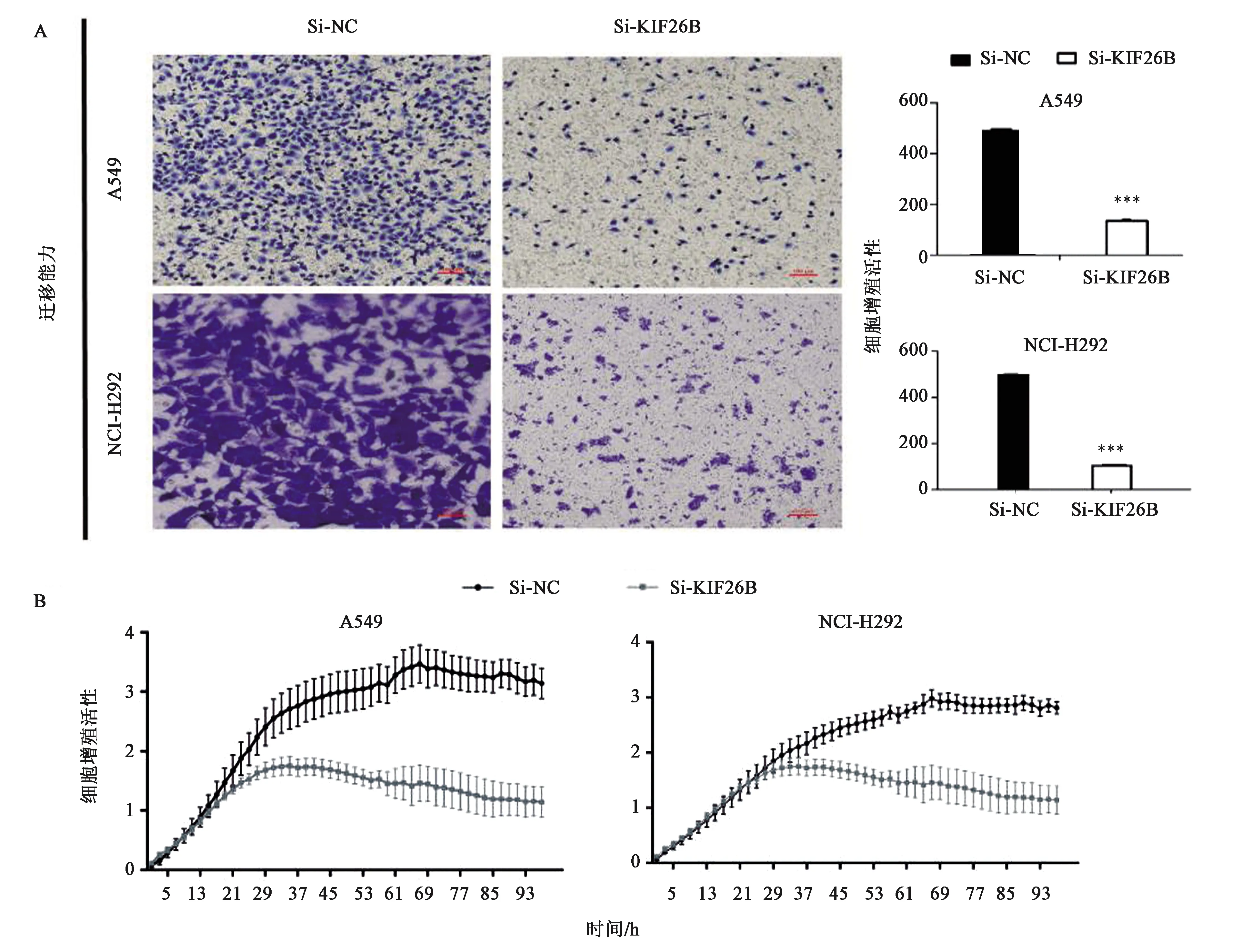
注:在对照siRNA(NC)转染的细胞和siKIF26B转染的细胞上进行迁移能力分析,将细胞处理72 h。 A:Transwell 小室迁移实验; B: RTCA 实时细胞分析迁移实验。*** 表示与Si-NC相比差异在P<0.001水平上具有统计学意义。图4 敲低KIF26B对非小细胞肺癌细胞的迁移能力的影响Fig.4 Effect of KIF26B knockdown on the migration of non-small cell lung cancer cells
2.6 敲低内源性KIF26B对NSCLC凋亡的影响
由于KIF26B是肌动蛋白家族成员,其在肿瘤的发生发展过程中均起重要作用。前面的实验表明,KIF26B对NSCLC具有促进恶性增殖以及促进其迁移和侵袭的能力,因此推测敲低KIF26B对癌细胞的凋亡可能有促进作用。为了验证这一推测,通过流式细胞仪对细胞进行检查,流式细胞仪检测的结果用 Flowjo 软件制图。如图7所示,敲低内源性KIF26B的A549细胞系凋亡占比为15%,而对照组仅为8.5%,敲低内源性KIF26B的NCI-H292细胞系凋亡占比为10.8%,而对照组为7%。由此可知,敲低内源性KIF26B能显著促进NSCLC凋亡。
2.7 敲低 KIF26B 基因表达对通路蛋白分子水平变化的影响
上述实验结果表明,敲低 KIF26B 基因表达 A549 和 NCI-H292 细胞增殖明显受阻、细胞 G0/G1 期阻滞、促进细胞凋亡、抑制细胞迁移和细胞侵袭能力。为进一步验证实验结果,采用免疫印迹法检测相关通路蛋白分子表达水平(图8)。主要检测了细胞周期蛋白 Cyclin-D1、细胞凋亡通路蛋白 Caspase 3、PARP1、Bcl-2,与细胞转移密切相关的N-cadherin 和Vimentin 的蛋白分子表达水平。免疫印迹法检测结果显示,当敲低KIF26B 基因表达后,细胞周期蛋白 Cyclin D1 显著下调,终末剪切酶Caspase 3激活,其剪切底物 PARP1 被剪切,Cleaved PARP1 显著上调,抑凋亡蛋白 Bcl-2 显著下调,上皮-间充质转化标志物 N-cadherin 和 Vimentin 表达下调。蛋白分子表达水平与相关细胞功能实验结果相吻合,由结果可知,敲低 KIF26B 基因表达通过调控 Caspase-3/PARP1 信号通路促进非小细胞肺癌细胞凋亡、通过调控 EMT 通路蛋白 N-cadherin 和 Vimentin 表达水平抑制细胞转移。
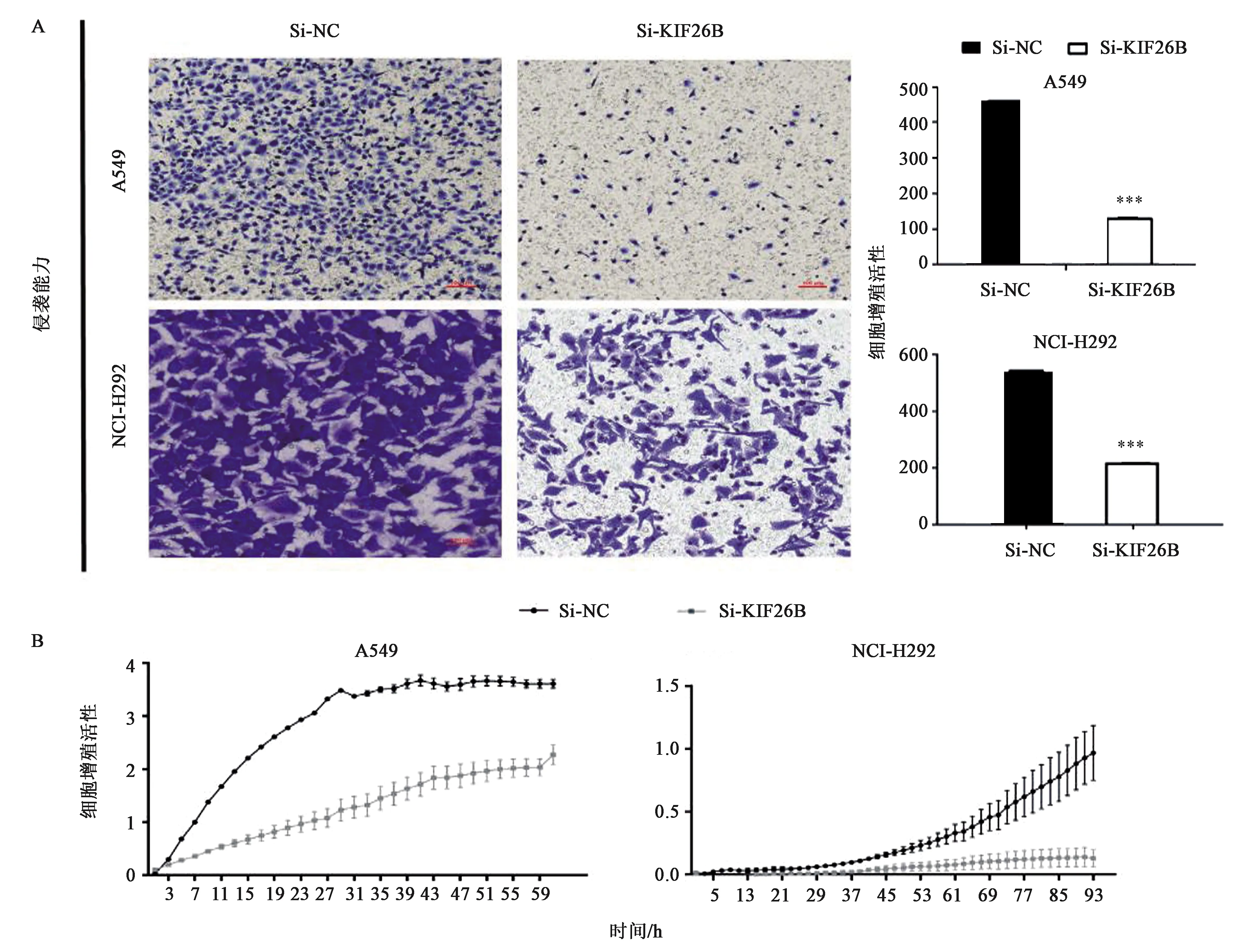
注:在对照siRNA(NC)转染的细胞和siKIF26B转染的细胞上进行侵袭能力分析,将细胞处理72 h。A:Transwell小室侵袭实验;B:RTCA实时细胞分析侵袭实验。*** 表示与Si-NC相比差异在P<0.001水平上具有统计学意义。图5 敲低KIF26B对非小细胞肺癌细胞的侵袭能力的影响Fig.5 Effect of KIF26B knockdown on the invasiveness of non-small cell lung cancer cells
3 讨论
NSCLC的发生和发展是一个复杂的过程,涉及基因表达、信号通路和表观遗传学的变化。核心基因的异常表达常常导致细胞生长、分化、凋亡和迁移失调[28-29]。因此,研究异常表达的核心基因对开发NSCLC治疗新靶点具有重要意义。NSCLC早期诊断率低和术后复发是影响NSCLC患者预后的两大因素[30]。因此,寻找新的治疗靶点对肝癌的早期诊断和预后具有重要意义。
然而,KIF26B在NSCLC发生发展过程中的作用尚不清楚。我们进行了一项深入的研究,以阐明KIF26B在NSCLC进展中的功能意义。首先,我们检测了NSCLC组织和癌旁正常组织中KIF26B的mRNA水平,并观察到KIF26B在癌组织中高表达且与TCGA数据库一致。提示KIF26B在NSCLC的发生发展中起着重要的生物学作用。为了更好地了解KIF26B诱导的细胞生长抑制的潜在机制,我们在KIF26B敲除后进行细胞周期分布实验,发现KIF26B的敲除阻滞了G1-S期转变,而调控 G0/G1 期向 S 期转化的细胞周期蛋白 D1(Cyclin D1)显著下调,实验结果表明,下调 KIF26B 调控 Cyclin D1 阻碍了细胞周期进程,从而抑制了 NSCLC 细胞的增殖。Cyclin D1 的表达在包括 NSCLC 的多种人类癌症中经常被促进[31],且Cyclin D1 蛋白的过度表达在 NSCLC 的发生和细胞增殖中起着重要作用[32]。这为本文的研究结果提供了有利证据,提示 KIF26B 高表达可能与 NSCLC 细胞增殖呈正相关。
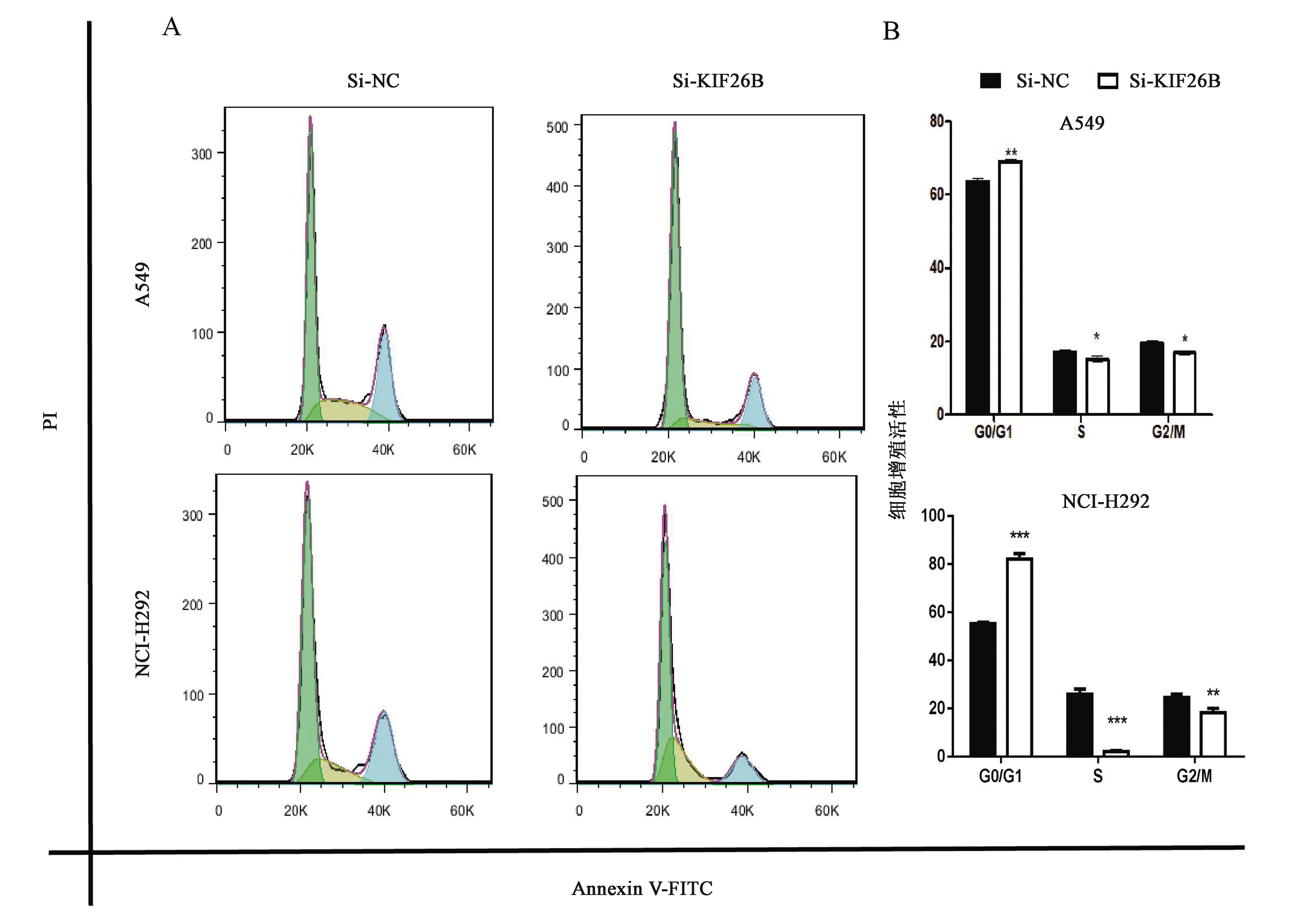
注:转染48 h后,通过An-nexin V/PI染色和流式细胞仪评估细胞周期的细胞数量。 敲低KIF26B基因可以显著阻断NCI-H292和A549细胞在不同阶段的转化。A:细胞周期分布;B:细胞周期分布直方图。“*, **, ***”分别表示同组数据的差异在P<0.05, P<0.01, P<0.001水平上有统计学意义。图6 敲低KIF26B对细胞周期的影响Fig.6 The effect of knocking down KIF26B on cell cycle
KIF26B的表达水平与NSCLC的生长有关,提示了KIF26B可能在NSCLC的发生发展中发挥重要作用。本研究所得结果和结直肠癌、胃癌以及乳腺癌所得结论一样,即敲低KIF26B会降低NSCLC细胞的迁移、侵袭能力[8,26,33]。结果显示,敲低KIF26B会降低癌细胞的迁移、侵袭能力,且参与调控上皮-间充质转化(EMT) 的 N-cadherin 和 Vimentin 蛋白表达水平显著下调。有研究表明N-cadherin的高表达与肿瘤生长、迁移、侵袭、淋巴转移和EMT呈正相关[34]。Vimentin是维持细胞骨架结构的重要蛋白,主要表达在间充质细胞和一些外胚层细胞,与细胞的运动密切相关。有研究证实,上皮来源肿瘤中出现Vimentin的高表达与肿瘤迁移、侵袭和转移呈正相关[35]。因此,N-cadherin和Vimentin的高表达均可提示肿瘤发生EMT,而发生肿瘤转移。在对KIF26B 基因功能研究中发现,该基因与肿瘤转移密切相关。那么,KIF26B也可能通过调控 N-cadherin 和 Vimentin 参与 NSCLC 细胞 EMT 过程。
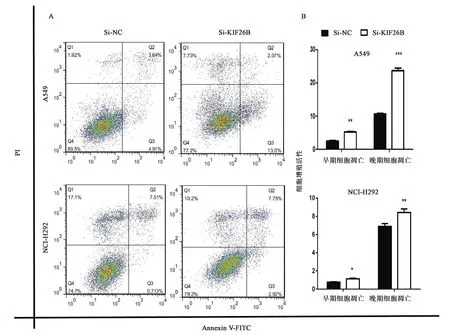
注:将细胞分为四组:对照,单PI染色,单AN染色,PI、AN双染色,细胞处理72 h。A: 凋亡分布; B: 凋亡直方图,“*, **, ***”分别表示同组数据的差异在P<0.05, P<0.01, P<0.001水平上有统计学意义。图7 敲低KIF26B对细胞凋亡的影响Fig.7 The effect of knocking down KIF26B on apoptosis
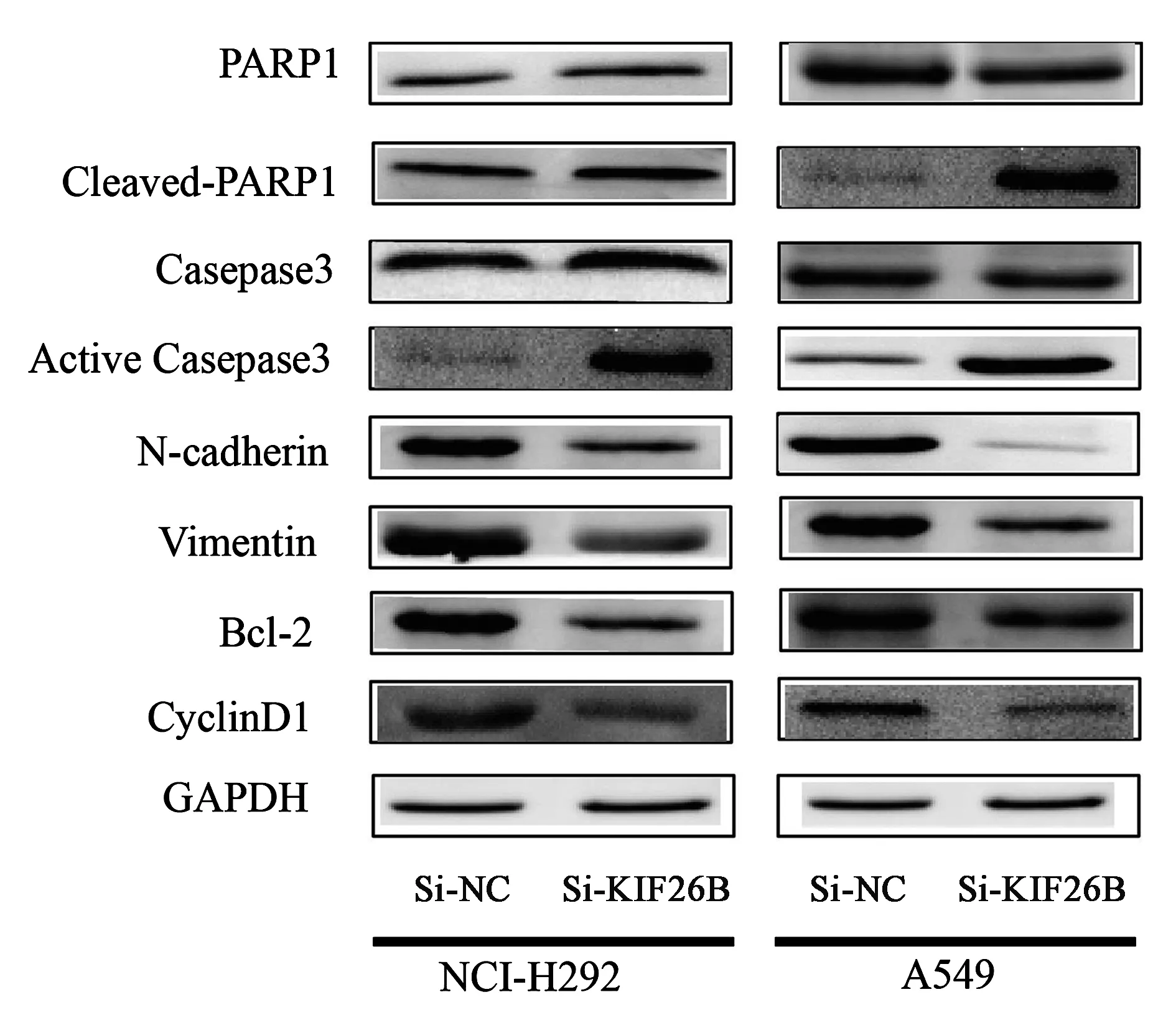
图8 敲低KIF26B对蛋白表达的影响Fig.8 The effect of knocking down KIF26B on >protein expression
聚ADP核糖聚合酶-1[poly(ADP-ribose)polymerase-1, PARP-1],是一类存在于多数真核细胞中具有重要生理功能的蛋白质翻译后修饰酶,其主要定位于细胞核内,少量存在于细胞质内。在DNA的损伤修复、DNA复制、细胞增殖分化调控、细胞凋亡及基因组的稳定方面发挥着重要作用[36]。Caspase-3是Caspases家族中重要的成员之一,大多数触发细胞凋亡的因素最终均需通过Caspase-3介导的信号传导途径导致细胞凋亡。Hay 等[20]研究表明,重组蛋白 IAP 可以下调 Caspase-3 或 Caspase-7 的表达,阻止细胞凋亡。PARP-1 是 Caspase-3 下游的信号分子,在大量自由基和氧化剂存在的情况下会引发 PARP-1过度激活,引起 ATP 的过度消耗,引发细胞凋亡。本研究结果显示敲低KIF26B使得Caspase 3 激活,其剪切底物 PARP1 被剪切,Cleaved PARP1 蛋白表达水平显著上调,对细胞凋亡起抑制作用的 Bcl-2 蛋白表达水平显著下调。实验结果表明KIF26B 的下调激活 Caspase-3/PARP1 信号通路,促进 NSCLC 细胞凋亡。
总之,本研究结果有助于理解NSCLC进展的分子机制,并可能有助于开发更好的治疗NSCLC的靶点。但是KIF26B与其基因的互作以及它与其他相关通路的互作尚不清楚,还需进一步研究,本实验结果为后续NSCLC靶点的开发打下了研究基础。
