M 1型巨噬细胞源外泌体增强卵泡膜细胞的活力*
2020-06-09高琳芝魏莉娜吕林艳姚嘉慧梁晓燕刘贵华
高琳芝, 谢 云, 周 怡, 魏莉娜, 张 弛, 吕林艳,姚嘉慧, 梁晓燕, 刘贵华, 杨 星△
(1中山大学附属第六医院生殖医学研究中心,广东广州510655;2中山大学附属第一医院男科,广东广州510080)
多囊卵巢综合征(polycystic ovary syndrome,PCOS)是最常见的育龄期女性排卵障碍疾病,严重影响女性生殖内分泌功能,是导致年轻女性月经紊乱、闭经和不孕最常见的原因[1-2]。PCOS最主要的病理生理特点为卵泡膜细胞过度增生及卵巢雄激素合成增加所致高雄激素血症[3]。虽然目前针对降低PCOS患者雄激素水平药物已广泛应用于临床,但这些药物只能暂时性控制高雄激素血症[2]。因此,了解PCOS的发病机制对于发现新的有效治疗靶点至关重要。慢性亚急性炎症状态是导致PCOS患者高雄激素血症的重要因素,而M1型巨噬细胞是参与形成PCOS患者体内慢性炎症的关键细胞,其在PCOS体内堆积并分泌大量炎症因子[4-6]。卵泡膜细胞是女性合成雄激素最重要的效应细胞,PCOS患者卵泡膜细胞较正常对照增殖明显,是导致PCOS雄激素合成增加的关键原因。多项研究表明M1型巨噬细胞通过分泌炎症因子促进雄激素合成并不能完全解释PCOS患者M1型巨噬细胞堆积对卵巢雄激素合成的影响[7]。因此,PCOS患者慢性炎症状态如何影响卵巢雄激素合成功能仍有待阐明。
外泌体(exosomes,Exo)是一种可由多种细胞主动分泌、直径为30~150 nm的磷脂双分子层结构囊泡,近年来因其具有携带一系列生物分子如功能性蛋白质及mRNA等进行细胞或组织间远距交流的靶向调控能力而备受关注[8]。已有研究报道外泌体在PCOS发病中起重要作用[9]。相关研究提示使用细菌脂多糖(lipopolysaccharide,LPS)刺激活化的M1型巨噬细胞能模拟机体慢性炎症状态,并通过分泌外泌体发挥靶向调控作用,是多种疾病发生发展的关键因素[10]。然而,尚无研究M1型巨噬细胞来源外泌体在PCOS高雄激素血症发生中作用和机制的报道。因此,我们假设M1型巨噬细胞分泌的外泌体可调节卵泡膜细胞的功能,研究来自M1型巨噬细胞分泌的外泌体对卵泡膜细胞活力的影响,并阐明其潜在的作用机制。
材料和方法
1 动物
SPF级昆明雌性小鼠,4周龄,由中山大学实验动物中心提供,许可证号为SCXK(粤)2016-0029。
2 主要试剂和仪器
DMEM培养基和DPBS缓冲液均购自Gibco;胎牛血清购自AUSGENEX;脂多糖、外泌体荧光标记PKH67试剂盒及外泌体分泌抑制剂GW4869购自Sigma;CCK-8试剂盒购自Dojindo;BCA蛋白浓度分析试剂盒和ECL显影试剂盒购自Thermo;兔/鼠抗CD63、CD81、肿瘤易感基因101蛋白(tumor susceptibility gene 101 protein,TSG101)、钙连蛋白(calnexin)和细胞周期蛋白依赖性激酶抑制因子1B(cyclin-dependent kinase inhibitor 1B,CDKN1B)单克隆抗体购自Abcam;细胞周期试剂盒购自凯基生物;引物由上海生工公司合成。
流式细胞仪和Optima XE-100型超高速低温离心机(Beckman Coulter);H-7650型生物性透射电镜(Hitachi);纳米流式检测仪(厦门福流生物科技有限公司)。
3 主要方法
3.1 巨噬细胞培养 小鼠巨噬细胞系Raw264.7由CytoBiotech惠赠。采用含10%胎牛血清及1%青、链霉素的高糖DMEM培养基培养于37℃、5%CO2恒温培养箱。采用LPS诱导巨噬细胞构建M1型炎性巨噬细胞,浓度为100μg/L。
3.2 卵泡膜细胞的提取、培养和鉴定 小鼠卵泡膜细胞的培养参考文献中的方法[11-12]。收集卵巢于DPBS中,体式显微镜下去除卵巢旁组织,无菌穿刺针穿刺卵巢释放卵泡液及颗粒细胞。DPBS冲洗卵巢组织,无菌剪刀剪碎卵巢至约1 mm×1 mm×1 mm碎片,转移至含I型胶原酶(5 g/L)的DMEM/F12培养基中,置于37℃水浴锅中消化90 min,每10 min吹散组织碎片。消化结束后,使用40μm滤网过滤细胞悬液,去除未消化的组织碎片。DPBS清洗细胞悬液3次,使用1 mL DPBS重悬细胞,利用不连续密度梯度法纯化卵泡膜细胞。吸取1 mL 50%Percoll梯度液于15 mL无菌离心管,1 mL 40%Percoll梯度液置于50%梯度液上层,细胞悬液置于40%梯度液上层,4℃下400×g离心20 min,纯化后的卵泡膜细胞位于40%Percoll液层。使用DPBS清洗卵泡膜细胞悬液3次后,使用含10%胎牛血清及1%青、链霉素的DMEM/F12培养基重悬并接种于细胞培养瓶,37℃、5%CO2恒温培养箱培养。
3.3 巨噬细胞与卵泡膜细胞共培养 LPS诱导的M1型巨噬细胞在Transwell小室中孵育过夜,卵泡膜细胞以每孔3×104细胞培养于24孔板中,细胞贴壁后,将上述Transwell小室转移至24孔板中,构建巨噬细胞-卵泡膜细胞共培养体系。为了明确M1型巨噬细胞是否通过外泌体影响卵泡膜细胞的活力,使用10μmol/L GW4869预处理M1型巨噬细胞24 h,抑制其外泌体分泌。
3.4 Raw264.7巨噬细胞外泌体的提取 Raw264.7巨噬细胞生长至70%左右覆盖时,DPBS清洗细胞2遍,换用无外泌体血清的完全培养基继续培养,48 h后,收集细胞上清,细胞正常传代。将收集到的细胞上清液于4℃连续离心(依次为300×g10 min,4 000×g10 min,12 000×g30 min)以除去死细胞及细胞碎片;上清液转移至新的离心管中,4℃、100 000×g离心70 min;收集试管底部沉淀,使用0.22μm过滤后的DPBS重悬沉淀,0.22μm的滤网过滤;再次4℃、100 000×g离心70 min,得到的沉淀物即为外泌体。一部分沉淀物用过滤后的DPBS重悬,-80℃保存用于电镜观察、纳米流式检测及小鼠体内注射实验;余下加入含1%蛋白酶抑制剂的RIPA裂解液,提取外泌体总蛋白,-80℃保存用于后续Western blot实验[13-14]。
3.5 Raw264.7巨噬细胞外泌体的鉴定 取上述实验得到的外泌体样品20μL,将样品置于透射电子显微镜网格上室温孵育2 min,再滴加3%磷钨酸室温静置2 min,蒸馏水清洗网格,电子透射显微镜下观察并拍照。取0.5 mL外泌体母液,1 mL超纯水稀释,用纳米流式检测仪对其粒径进行检测。取出外泌体蛋白样品,SDS-PAGE进行分离,将蛋白转移至PVDF膜上,5%脱脂奶粉室温封闭,加入抗CD63、calnexin、CD81和TSG101抗体及相应的II抗,凝胶成像系统拍照。
3.6 实验分组 将稳定培养的卵泡膜细胞分为2个处理组,分别为正常巨噬细胞源外泌体(MC-Exo)处理组和M1型巨噬细胞源外泌体(M1-Exo)处理组。2组均在细胞贴壁后采用相同体积的培养基培养,外泌体(30 mg/L)提取过程严格遵守无菌操作,超速离心后得到的外泌体使用DMEM/F12完全培养基重悬。2组同时换相应的培养基培养24 h。
3.7 外泌体荧光标记示踪 上述超速离心法获得的外泌体,用DPBS溶解后,加入PKH67混悬液中,充分重悬混匀,室温静置5 min染色,加入等体积无外泌体血清终止染色,再次4℃、100 000×g离心70 min,沉淀为PKH67标记的外泌体,DPBS重悬后,再次超速离心,沉淀用培养基重悬后,并对卵泡膜细胞进行换液处理。将PKH67荧光标记的外泌体与24孔板内接种的卵泡膜细胞共孵育24 h,孵育结束后,使用PBS稀释的1%多聚甲醛固定卵泡膜细胞15 min,4℃条件下DAPI染色30 min,荧光显微镜下检测各组细胞荧光强度。
3.8 CCK-8法检测细胞活力 卵泡膜细胞以每孔5×103密度接种于96孔,培养过夜至完全贴壁,每孔分别给予10μL外泌体PBS混悬液处理,继续培养24 h后,每孔加入10μL CCK-8,于细胞培养箱中继续孵育2 h,450 nm波长处检测各组吸光度(A)。
3.9 流式细胞术检测细胞周期分布 取对数生长期卵泡膜细胞,接种于6孔板中,对照组加入DMEM/F12完全培养基培养,加入含外泌体的DMEM/F12完全培养基,培养24 h后,按照细胞周期检测试剂盒操作说明书,PBS清洗细胞,以70%无水乙醇固定细胞过夜。固定结束后,PBS清洗固定液,加入500μL染色工作液,室温避光孵育30~60 min。上机检测,记录激发波长488 nm处红色荧光。
3.10 qPCR实验 12孔板内卵泡膜细胞按各组处理24 h后,采用TRIzol法进行细胞总RNA提取,根据TaKaRa逆转录试剂盒根据相应操作对总RNA进行逆转录,获取cDNA。使用SYBR Green qPCR Kit进行CDKN1B的qPCR检测,以β-actin为内参照。PCR步骤为:95℃预变性5 min;95℃变性15 s、60℃退火延伸30 s、72℃延伸30 s,共40个循环。引物序列见表1。

表1 qPCR引物序列Table 1. The sequences of theprimers for qPCR
3.11 Western blot实验 6孔板内卵泡膜细胞按各组处理24 h后,采用RIPA裂解液提取细胞总蛋白。BCA定量后,采用20μg蛋白上样于15%分离胶下进行电泳,电泳结束后,将蛋白转移至PVDF膜上,5%脱脂奶粉室温封闭1 h,分别加入抗CDKN1B抗体稀释液,孵育过夜后,使用相应的II抗孵育1 h,孵育结束后,化学发光显影仪下显影,采用ImageJ软件进行灰度值统计分析。
4 统计学处理
用SPSS22.0软件分析。计量资料表示为均数±标准差(mean±SD),两组间均数比较采用Student'st检验,多组间均数比较采用单因素方差分析及LSD-t检验。以P<0.05为差异有统计学意义。
结 果
1 小鼠卵泡膜细胞培养及鉴定
小鼠卵泡膜细胞贴壁后呈纺锤形,折光性好。细胞免疫荧光染色结果显示,提取的细胞表达3β-羟基类固醇脱氢酶(3β-hydroxysteroid dehydrogenase,3β-HSD),阳性率大于95%,见图1。这表明我们成功提取了卵泡膜细胞,并能进行后续研究。
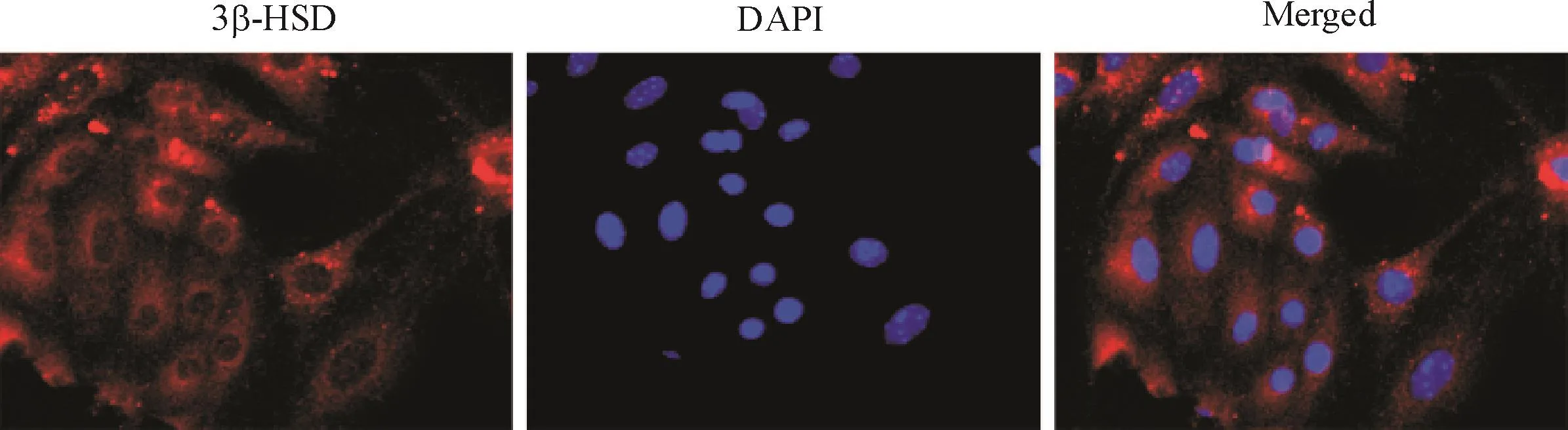
Figure 1.Identification of the cultured theca cells by observing the immunofluorescence of 3β-HSD(×200).图1 卵泡膜细胞3β-HSD免疫荧光鉴定图
2 M 1型巨噬细胞对卵泡膜细胞细胞活力的影响
为了明确M1型巨噬细胞是否影响卵泡膜细胞活力,我们在共培养系统中将LPS诱导后的M1型巨噬细胞与卵泡膜细胞共培养,同时使用外泌体分泌抑制剂GW4869预处理M1型巨噬细胞,抑制其外泌体的释放。CCK-8实验结果表明,共培养组卵泡膜细胞的活力增强,而在GW4869处理后,这一作用被消除,见图2。
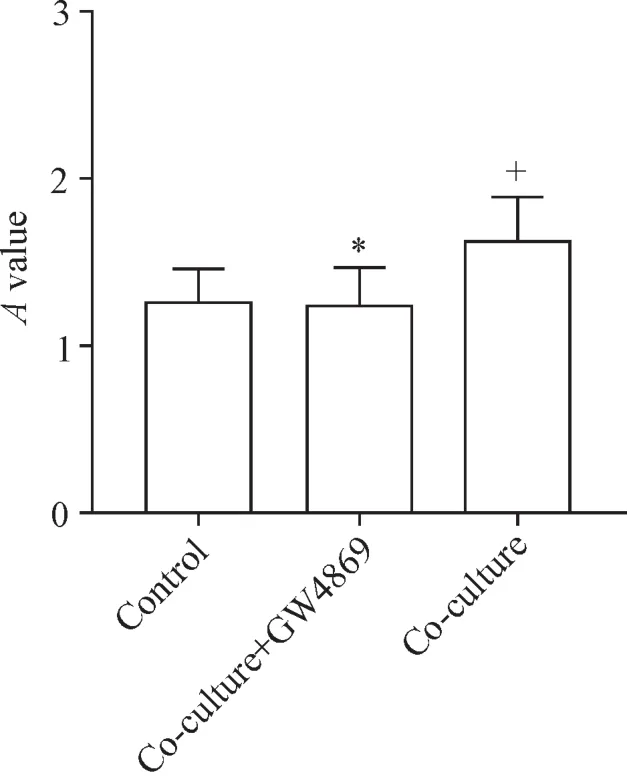
Figure 2.M1 macrophages enhanced the viability of theca cells.GW4869,a well-known inhibitor of exosome secretion,was used at a concentration of 10μmol/L to reduce the release of exosome from M1 macrophages.Mean±SD.n=6.*P<0.05 vs co-culture group;+P<0.05 vs control group.图2 M 1型巨噬细胞对卵泡膜细胞活力的影响
3 巨噬细胞来源外泌体的鉴定
我们利用超高速离心法提取巨噬细胞培养上清液中的外泌体,将所提取的外泌体置于透射电镜下观察,可见大小均一的杯状结构,包膜完整,单个分布或聚集成群,粒径大小在60 nm左右,见图3A;纳米流式检测仪的结果显示,所提取的外泌体平均粒径为(69.4±19.4)nm,90%以上处于30~150 nm直径范围内,见图3B;Western blot结果显示,所提取的外泌体含有CD63、CD81和TSG101这3种外泌体标志蛋白,且不含calnexin,见图3C。上述结果表明,M1型巨噬细胞分泌的外泌体被成功分离。
4 巨噬细胞分泌的外泌体能被卵泡膜细胞摄取
为了验证巨噬细胞分泌的外泌体能否被卵泡膜细胞摄取,我们采用PKH67荧光标记的巨噬细胞源外泌体与卵泡膜细胞共孵育24 h,荧光显微镜下拍照,结果显示共培养组卵泡膜细胞内出现明显的PKH67绿色荧光,而对照组无荧光,见图4。
5 M 1型巨噬细胞源外泌体对卵泡膜细胞活力的影响
将M1型巨噬细胞分泌的外泌体与卵泡膜细胞共孵育24 h,采用CCK-8法检测细胞活力,结果显示,M1型巨噬细胞源外泌体处理组卵泡膜细胞的活力较对照组显著增强(P<0.05),见图5。
6 M 1型巨噬细胞源外泌体对卵泡膜细胞的细胞周期分布和CDKN1B表达的影响
流式细胞术结果显示,与对照组相比,M1型巨噬细胞源外泌体处理组G0/G1期细胞比例明显降低(P<0.05),S期细胞比例显著升高(P<0.05),见图6。既往研究表明,M1型巨噬细胞源外泌体可通过调控CDKN1B的表达影响靶细胞的增殖能力[15]。我们通过qPCR及Western blot实验发现,M1型巨噬细胞源外泌体处理后的卵泡膜细胞CDKN1B的mRNA及蛋白表达水平均明显降低(P<0.05),见图7。
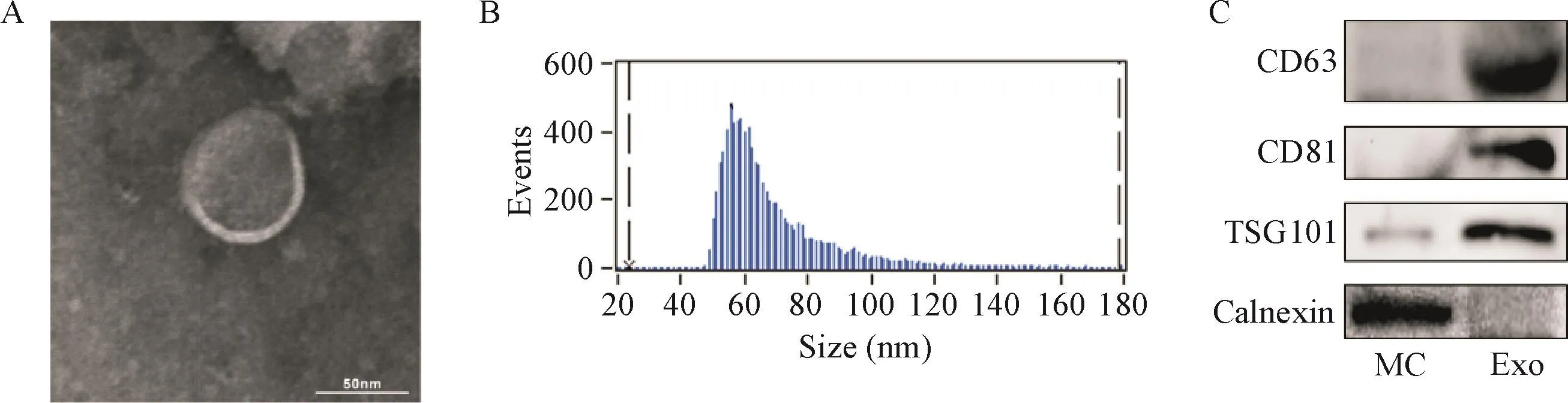
Figure 3.The extraction and identification of exosomes(Exo)secreted by Raw264.7 macrophages(MC).A:electron microscopic analysis(the scale bar=50 nm);B:the size distribution of the exosomes detected by flow nanoanalyzer;C:the expression of exosome-specific markers CD63,CD81 and TSG101 measured by Western blot.图3 Raw264.7巨噬细胞来源外泌体的提取与鉴定
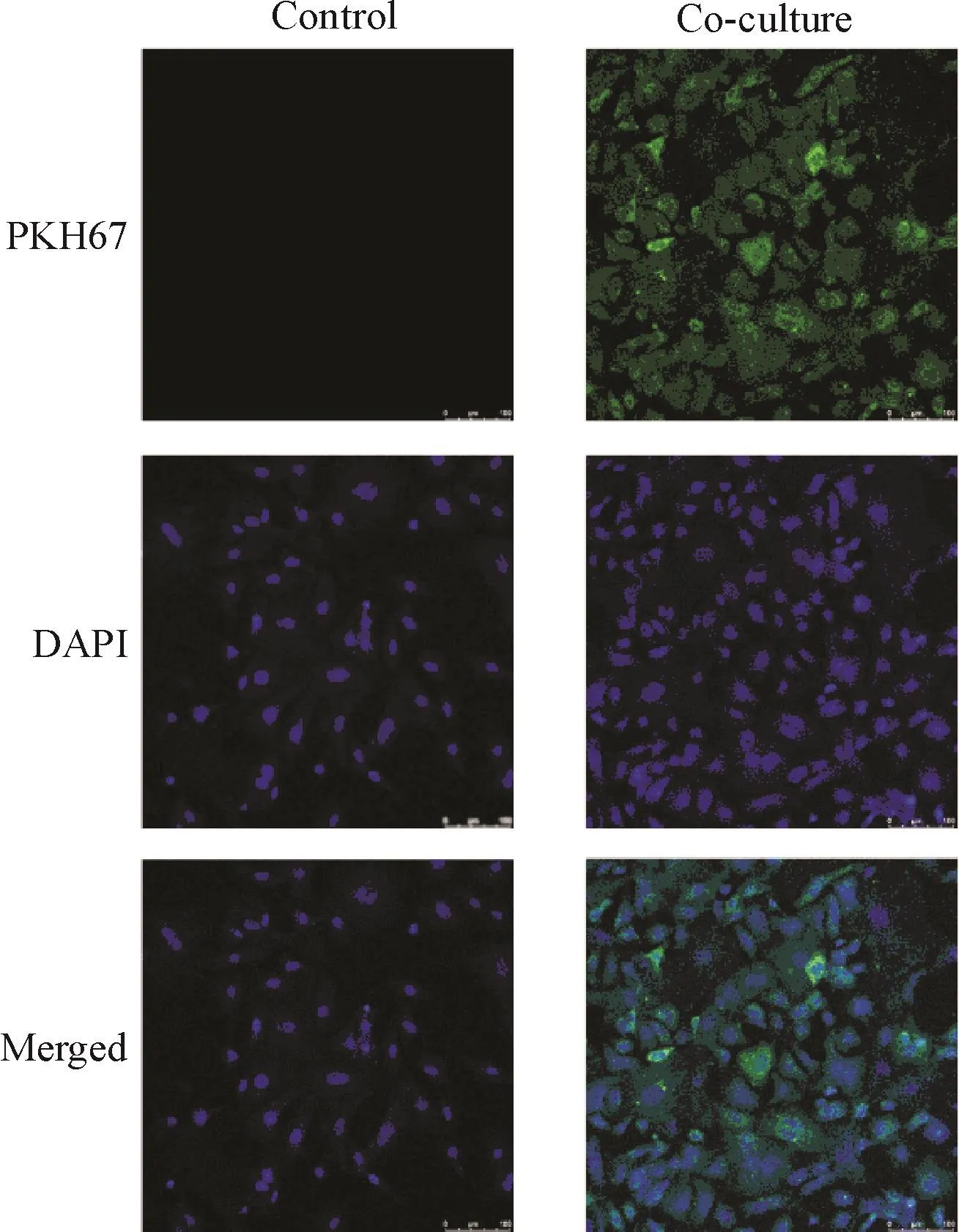
Figure 4.Fluorescence microscopic observation of theca cells after incubation with PKH67-labeled macrophage-derived exosomes(×200).图4 卵泡膜细胞内示踪PKH67标记的巨噬细胞源外泌体
讨 论
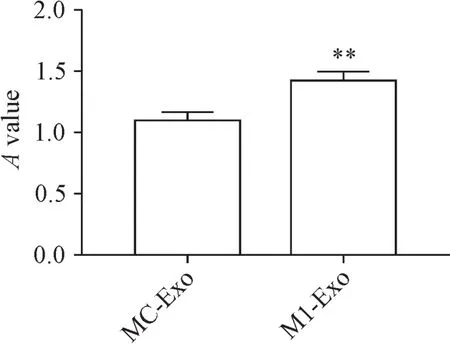
Figure 5.The effects of exosomes secreted by M1 macrophages on the viability of theca cells.Mean±SD.n=6.*P<0.05 vs MC-Exo group.图5 M 1型巨噬细胞源外泌体对卵泡膜细胞活力的影响
卵泡膜细胞对卵泡的发育及卵子成熟至关重要,且可调节卵巢甾体激素的合成,是卵巢雄激素合成的主要来源;卵泡膜细胞功能失调是PCOS患者高雄激素血症的关键原因[2,16]。3β-HSD是卵泡膜细胞特异性表达的分子,我们采用梯度离心法分离纯化得到的小鼠卵泡膜细胞95%以上表达3β-HSD蛋白,证实成功获取小鼠卵泡膜细胞。慢性亚急性炎症长期以来被认为在PCOS的发病机制中发挥着重要作用,是卵巢卵泡膜细胞功能障碍继而雄激素合成增加的主要原因;PCOS患者体内慢性亚急性炎症表现为局部组织M1型巨噬细胞堆积,伴随炎症因子分泌增加[12-13]。然而,M1型巨噬细胞导致卵泡膜细胞功能障碍的机制尚未被阐明。有研究表明使用LPS刺激巨噬细胞,可诱导产生形成体内慢性炎性状态的M1型巨噬细胞,模拟PCOS患者体内的慢性炎症状态[14]。本研究根据此方法使用LPS刺激Raw264.7巨噬细胞构建M1型慢性炎性巨噬细胞模型,用以模拟PCOS患者体内的慢性炎症状态[17]。外泌体作为广泛认可的包裹多种生物学分子的细胞外囊泡,具有调控靶细胞的功能[18]。最近研究表明,巨噬细胞分泌的外泌体是其发挥靶向调控作用的关键途径[19]。我们构建了M1巨噬细胞-卵泡膜细胞共培养体系,并使用GW4869抑制巨噬细胞外泌体分泌,CCK-8实验结果表明M1巨噬细胞通过外泌体增强卵泡膜细胞活性。进一步使用超速离心法富集巨噬细胞分泌的外泌体,通过Western blot、电镜及纳米粒径分析仪进行鉴定,我们发现巨噬细胞源外泌体具有典型的杯状结构,直径在50~100 nm之间,且表达外泌体标志蛋白CD63、CD81和TSG101等,提示成功提取巨噬细胞外泌体。

Figure 6.The effect of the exosomes derived from M1 macrophages on the cell cycle of theca cells was detected by flow cytometry.Mean±SD.n=6.*P<0.05 vs MC-Exo group.图6 M1型巨噬细胞分泌的外泌体对卵泡膜细胞细胞周期分布的影响

Figure 7.The effects of the exosomes derived from M1 macrophages on the mRNA(A)and protein(B)expression levels of CDKN1B were detected by qPCR and Western blot,respectively.Mean±SD.n=3.*P<0.05 vs MC-Exo group.图7 M 1型巨噬细胞分泌的外泌体对卵泡膜细胞CDKN1B表达水平的影响
既往研究认为M1型巨噬细胞可能通过分泌炎症因子,改变卵巢局部微环境进而导致卵泡膜细胞功能障碍[4]。但是针对体内炎症因子的治疗并不能有效控制高雄激素血症,结合我们共培养实验结果,提示M1型巨噬细胞可能通过外泌体途径调控卵泡膜细胞功能。我们通过外泌体示踪实验发现,使用PKH67标记的巨噬细胞源外泌体与卵泡膜细胞共培养后,卵泡膜细胞内出现PKH67绿色荧光,提示巨噬细胞源外泌体可被卵泡膜细胞摄取。
卵泡膜细胞增生是 PCOS 重要的病理特征[2,20]。我们通过CCK-8实验发现M1型巨噬细胞源外泌体促进卵泡膜细胞的活力,提示PCOS患者体内异常活化的M1型巨噬细胞可能通过分泌外泌体促进卵泡膜细胞生长,参与PCOS发病过程。我们进一步借助流式细胞术发现,与M1型巨噬细胞源外泌体共孵育后,卵泡膜细胞较对照组G0/G1期缩短,S期细胞相对增多,提示M1型巨噬细胞通过分泌外泌体促进卵泡膜细胞由G1期进入S期。CDKN1B是细胞周期素依赖性激酶抑制因子(cyclin-dependent kinase inhibitor,CDKI)家族的成员,与细胞周期关系密切,可以阻断细胞从G1期到S期[21]。本研究通过qPCR及Western blot实验检测组间CDKN1B表达水平的差异,发现M1型巨噬细胞源外泌体抑制卵泡膜细胞CDKN1B的mRNA及蛋白表达。这提示M1型巨噬细胞源外泌体通过负向调控卵泡膜细胞CDKN1B的表达,进而促进卵泡膜细胞由G1期进入S期。多项研究发现M1型巨噬细胞源外泌体通过转运miRNA、mRNA等,调控细胞周期相关蛋白的表达,进而影响靶细胞增殖及功能,可能是外泌体增强卵泡膜细胞活力的潜在机制[15]。
综上所述,本研究证实了M1型巨噬细胞可以通过分泌外泌体引起卵泡膜细胞活力的改变,其潜在的机制可能是通过下调CDKN1B的表达进而促进卵泡膜细胞由G1期进入S期。这为进一步探讨PCOS疾病状态下慢性炎症状态导致高雄激素血症的作用机制提供新的思路,外泌体可能成为改善PCOS高雄激素血症的潜在重要靶点。
