白斑狗鱼雌、雄基因组混池重测序研究
2020-06-09张俊杰赵瑞阳李胜忠
张俊杰,赵瑞阳,蒋 丽,胡 琼,李 菁,唐 露,李胜忠
(1.新疆农业大学动物科学学院,乌鲁木齐 830052;2.中国水产科学研究院,北京 100141)
白斑狗鱼(EsoxLucius)属鲑形目(Salmoniformes)狗鱼科(Esocidae)狗鱼属(Esox),自然分布于北美洲及欧亚大陆北部淡水流域,在我国仅见于新疆北部的额尔齐斯河流域[1,2]。白斑狗鱼作为自然水体中的主要顶级捕食者,其生长迅速,体型较大,具有重要经济价值[3]。自人工繁殖取得成功以来,白斑狗鱼已经成为新疆重要的特色养殖鱼类,并逐渐向全国推广,取得了显著的经济效益。
研究表明,白斑狗鱼雌鱼的生长速度明显快于雄鱼,而且性成熟时间更晚,寿命更长,体型更大[4-7]。Luczynski等[8]通过性逆转与雌核发育结合,确定了白斑狗鱼属于XX/XY(雌性同型)的染色体决定类型,但近年来对白斑狗鱼的研究主要集中在生物学特性、繁殖生物学、生态学等方面,其性别鉴定只能在性成熟后通过观察和挤压生殖孔等方法进行[9-13]。基因组重测序技术能够在个体或群体样本的全基因组水平上筛选出相关性状的基因序列差异,已在多种鱼类中获得性别特异分子标记[14-17]。本实验通过对雌、雄白斑狗鱼进行混池重测序(BSA-seq),探究白斑狗鱼雌、雄性别的基因组差异,以期筛选出雌、雄特异分子标记,实现对白斑狗鱼的性别控制技术及全雌鱼单性生产。
1 材料与方法
1.1 实验材料
实验所用白斑狗鱼购自乌鲁木齐北园春市场,体重500~800 g,解剖后通过性腺观察进行生理性别鉴定,然后剪取鳍条,在无水乙醇中保存,用于后续基因组DNA的提取。
1.2 实验试剂
实验所用试剂主要有:组织裂解液[1 mL Tris-HCl(1 mol/L,pH 8.0),1 mL EDTA(0.5 mol/L,pH 8.0),20 mL NaCl(0.5 mol/L),10 mL SDS(10%)]、乙酸铵(7.5 mol/L)和PCR反应预混液(天根生化科技北京有限公司)。所用引物均由生工生物工程(上海)股份有限公司合成。
1.3 实验方法
1.3.1 白斑狗鱼DNA制备
选取鉴定性别后的雌、雄白斑狗鱼各20尾,使用醋酸铵法提取基因组DNA,经全波长酶标仪(InfiniteM200,瑞士TECAN公司)测定浓度和A260 nm/A280 nm值后,送至上海凌恩生物科技有限公司进行测序。用同样方法提取和测定雌、雄各24尾白斑狗鱼的DNA,并稀释至50 ng/μL,用于性别特异标记的PCR验证。
1.3.2 混池重测序与数据质控
将20尾雌性和20尾雄性白斑狗鱼的DNA分别混合,构建雌、雄2个基因组DNA样品池,将其序列分别随机打断,电泳回收长度为300~500 bp的DNA片段,两端加上接头后进行cluster制备,构建重测序文库,在Illumina Hiseq 4000平台进行测序(上海凌恩生物科技有限公司)。将重测序获得的原始测序数据(reads),通过Trimmomatic(https://github.com/timflutre/trimmomatic)软件进行过滤和质量检测,得到待分析测序数据(clean reads)。
1.3.3 性别标记筛选关联分析与差异片段筛选
使用bwa(https://github.com/lh3/bwa)和samtools(https://github.com/samtools/samtools)将重测序获得的clean reads与NCBI中的白斑狗鱼参考基因组序列(NCBI登录号:GCA_000721915.3)进行比对和排序。将clean reads和参考基因组使用bwa进行比对,再用samtools将比对后的基因组文件进行格式转换和排序,接着使用GATK(https://github.com/broadinstitute/gatk)软件包对上一步的结果文件进行SNP和Indel检测,通过MarkDuplicates进行去重以及HaplotypeCaller分析,得到SNP和Indel的数据集,将比对质量值大于20的SNP位点作为最终SNP位点,并对得到的每个SNP和Indel位点进行注释。使用SNP-Index算法进行标记与性别之间的关联分析,筛选性别特异SNP位点,并对性别相关侯选区域进行选择,在这些候选区域中进行候选基因的注释,随后在STRING(https://string-db.org)网站对这些基因进行功能互作分析。
将比对到参考基因组上的雌、雄基因组序列进行相互比对,找出差异序列作为性别特异候选序列。同时将不能比对到白斑狗鱼参考基因组上的雌、雄基因组序列使用SOAPdenovo(http://soap.genomics.org.cn)进行拼接,然后将拼接的雌、雄序列进行相互比对,排除共有序列后,剩余序列也作为该性别特异候选序列,最后逐一将这些特异序列使用BLAST进行比对。
1.3.4 性别特异候选序列的验证
随机挑取部分雌、雄候选特异序列,使用primer 5.0设计PCR引物,以雌、雄个体基因组DNA为模板,用PCR扩增进行两个阶段的验证。首先用4尾雌鱼和4尾雄鱼的DNA进行验证验,再根据验证结果,用24尾雌鱼和24尾雄鱼的DNA进行验证。PCR反应体系如下:DNA模板1 μL,PCR反应预混液6.25 μL,正反引物各0.5 μL(10 μmol/L),加ddH2O使体积达到12.5 μL。PCR反应程序为:95 ℃预变性5 min;95 ℃变性30 s,57 ℃退火30 s,72 ℃延伸1 min,35个循环;72 ℃再延伸5 min,最后4 ℃保存。用1.5%琼脂糖凝胶电泳检测PCR扩增产物。
2 结果
2.1 混池重测序数据质量评估
雌、雄样本混池后进行重测序得到的原始测序读长数目分别为304 730 496条和305 121 064条;碱基数分别为45 709 574 400 bp和45 768 159 600 bp;碱基测序错误率(Q30)分别为90.66%和89.39%;测序深度50 X。对reads进行过滤后得到高质量的雌、雄混池数据,clean reads数目分别为282 400 688条和277 391 000条;碱基数分别为41 394 508 708 bp和40 501 950 971 bp;Q30分别提升至94.44%和93.98%,统计结果如表1所示。

表1 白斑狗鱼混池重测序数据质量统计Tab.1 Quality statistics of mixed pool resequencing data of E.lucius
2.2 性别特异标记筛选
通过表2可以看到,雌性池SNP位点总计2 076 647个,纯合SNP位点11 167个,占0.54%;雌性池Indel位点总计105 810个,缺失突变有54 234个,比插入突变多2 658个,雌性特异候选序列有524条。雄性池SNP位点总计2 076 942个,纯合SNP有12 573个,占0.61%;雄性池Indel位点共计647 466个,缺失突变有337 940个,比插入突变多28 414个,雄性特异候选序列500条。筛选得到了10个比对质量值大于20的性别特异SNP位点,其中转换位点7个,颠换位点3个。同时雌性SNP位点的碱基信息和雄性SNP位点碱基信息具有显著差异,具体情况如表3所示。

表2 白斑狗鱼雌、雄混池SNP和Indel位点以及性别特异候选序列Tab.2 SNP and Indel loci and sex specific candidate sequences in the female and male mixed pool of E.lucius

表3 重测序获得的白斑狗鱼性别特异SNP位点Tab.3 Sex specific SNP loci of E.lucius obtained by resequencing
2.3 性别特异候选基因分析
使用SNP-Index算法获得Δ(SNP-Index)的分布和局部加权回归(locally weighted regression,LOESS)拟合曲线(图1)。经bootstrap方法筛选得到26个差异显著(P<0.01)的Δ(SNP-Index)区间作为性别特异候选区域,SNP数目介于89~946。26个候选区域中存在不同数目的基因,基因总数为101,详细信息见表4。经STRING网站分析发现有27个基因存在部分相互作用,这些基因分别在生物体结构发育、细胞增殖和能量代谢等方面发挥作用,其中Pdhx和Prkaa1基因调控主要进行的信号通路(图2)。
2.4 性别特异片段的PCR实验验证
将雌、雄混池数据比对到参考基因组后筛选得到雌性特异序列35条、雄性特异序列14条,未比对到参考基因组数据(unmapping reads)经组装后筛选得到雌性特异序列489条、雄性特异序列486条。在1 024条性别特异片段中随机选取了276条可设计引物的片段进行PCR引物设计,其中雌性引物116对,雄性160对。通过对4尾雌鱼和4尾雄鱼的验证后,筛选出20对条带清晰且具有性别偏向性的引物(图3)。然后又通过对24尾雌鱼和24尾雄鱼的验证,最终得到1对引物(编号为2043138)(表5)的扩增产物出现性别差异,雌性阳性比率为4/24,雄性阳性比率为16/24,具有显著的雄性偏向性(图4)。将白斑狗鱼参考基因组和该序列进行BLAST比对,结果表明该序列不存在于白斑狗鱼参考基因组,组装出来的序列长度为773 bp(图5),其中PCR扩增产物长度为384 bp(图4)。
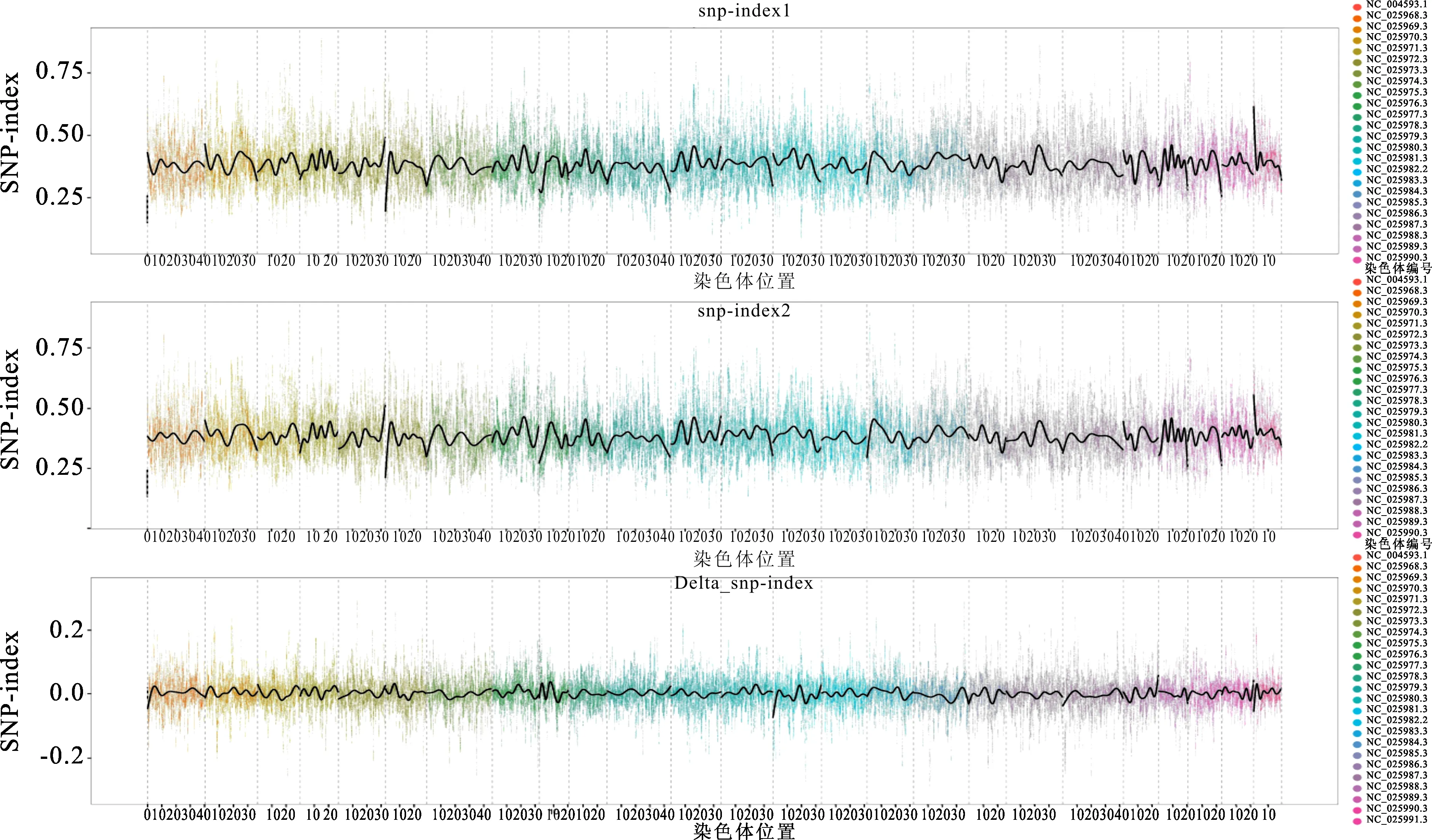
图1 白斑狗鱼染色体SNP标记的Δ(SNP-Index)分布和LOESS拟合曲线Fig.1 Δ(SNP-Index)distribution and LOESS fitting curve of SNP loci on the chromosome of E.lucius

表4 白斑狗鱼染色体性别特异候选区域信息统计Tab.4 Data statistics of sex special chromosome candidate region of E.lucius

续表
注:“染色体区域”中信息依次表示为“染色体编号:起始碱基数-结束碱基数”

图2 白斑狗鱼27个性别特异候选基因的相互作用Fig.2 Interaction of 27 sex special candidate genes of E.lucius蓝绿色线-相互关系来源于数据库;紫色线-相互关系来源于实验测定;绿色线-预测为基因邻接关系;红色线-预测为基因融合;蓝色线-预测为基因同现;黄色线-文本挖掘;黑色线-共表达;灰色线-同源蛋白质

图3 3个性别特异片段在4尾雌性和4尾雄性白斑狗鱼的PCR验证结果Fig.3 PCR result for 3 sex special fragments in 4 female and 4 male E.lucius性别特异片段编号从左向右依次为2019708、2022414、2043138

图4 性别特异片段编号2043138在24尾雌性和24尾雄性白斑狗鱼的PCR扩增结果Fig.4 PCR result for sex special fragment 2043138 in 24 female and 24 male E.lucius

图5 白斑狗鱼性别特异片段编号2043138完整序列Fig.5 Total sequence for sex special fragment 2043138 of E.lucius选中黑色部分为白斑狗鱼性别特异片段编号2043138的PCR产物区域。

表5 白斑狗鱼性别特异片段(编号2043138)引物设计Tab.5 Primer for sex special fragment 2043138 of E.lucius
3 讨论
鱼类性别相关研究不仅可以加强鱼类性别发育机制的基础研究,对于水产养殖业来说,进行鱼类性别控制也具有重要的应用价值[18]。但鱼类是低等脊椎动物,性染色体分化程度较低,多数鱼类性染色体间差异非常小,通过核型分析往往很难鉴定鱼类性别。由于鱼类性别决定方式非常复杂,而且环境因素也常作为重要影响因子,和遗传因子共同作用影响性别的形成过程,甚至出现生理性别与遗传性别不一致的情况[19]。通过筛选鱼类基因组中性别特有DNA片段或位点,开发出性别分子标记进行鱼类性别鉴定成为一种简便快速的方法。随着基因组测序技术的发展,开发出混合群体分离分析(又称混池重测序,Bulked Segregant Analysis,BSA)技术,为鱼类性别研究提供了一种有效方法[20]。林晓煜等[14]结合混池重测序和个体重测序,筛选出一个大黄鱼(Larimichthyscrocea)雄性特异SNP位点,Lin等[16]通过混池重测序和个体重测序,在大黄鱼基因组鉴定出雄性特异的15 bp缺失片段。
本研究利用BSA方法得到雌、雄混池数据,筛选得到26个性别特异候选区域,包含101个性别相关的基因,有27个基因之间存在不同程度的相互作用。其中Pdhx(pyruvate dehydrogenase complex component X,丙酮酸脱氢酶复合物X)和Prkaa1(AMP-activated protein kinase catalytic subunit alpha-1,AMP激活蛋白激酶α1基因)与其他基因互作联系较多,Pdhx基因[21]催化丙酮酸不可逆脱羧作用生成乙酰辅酶a,同时形成NADH,而且丙酮酸的还原氧化还与增强细胞增殖能力有关。Prkaa1基因[22]参与机体的能量代谢过程,在能量平衡的调节过程中起重要作用,且Prkaa1多态性与肌内脂肪含量显著相关。而在白斑狗鱼的雌、雄个体之间存在性别二型性,个体生长速率与能量代谢和脂肪含量之间可能存在性别差异,所以推测Pdhx基因和Prkaa1基因通过调控细胞增殖和能量代谢的过程与个体性别发育存在一定的关联。
经过雌、雄混池序列分析,以及PCR扩增的实验验证,获得1条源于unmapping reads具有雄性偏向性的序列,全长773 bp。基因组比对产生unmapping reads的主要原因是由于基因组结构变异、碱基数目大于组装软件所允许的错配数目和gap数目、测序误差、样本污染,同时非模式生物的基因组还可能受到核参考基因组质量差、不完全共生体、细胞器基因组的影响,由此unmapping reads仍可能有新的信息发现,例如它们可能提供有关病原体、共生体或参考基因组中缺失的序列/基因的信息[23-25]。将该序列经BLAST后未能获得与其他物种数据库中相匹配的序列,也未能在Pan等[26]上传的白斑狗鱼参考基因组数据库中搜索得到该序列甚至是相似序列,仅和鲫(Carassiusauratus)、恐龙鱼(Erpetoichthyscalabaricus)、金线鲃(Sinocyclocheilusrhinocerous)的uncharacterized protein K02 A2.6-like具有61.11%、63.24%、65.75%的相似度,和南亚野鲮(Labeorohita)的voltage-dependent L-type calcium channel subunit alpha-1D protein具有63.01%的相似度。同时该序列在雌、雄各15尾白斑狗鱼个体重测序数据中经BLAST比对后,结果显示该序列似乎并不存在于某一特定染色体,而是对应于不同个体的不同染色体(结果另文发表),其生物学功能还需要进一步研究。
本研究通过对白斑狗鱼雌、雄混池基因组的测序和筛选分析,对unmapping reads组装后筛选获得了1条雄性偏向性序列,可为以后进一步对白斑狗鱼的性别发育机制研究提供一定理论基础。
