抗AMPAR脑炎合并重症肌无力1例并文献复习
2020-06-09唐英超李晓佳曾泉滔冉宁晶杨东东杨旭红
唐英超,李晓佳,曾泉滔,冉宁晶, 肖 文,杨东东,杨旭红
(1.成都中医药大学附属医院 神经内科, 四川 成都 610075;2.四川省人民医院 神经内科, 四川 成都 610072)
抗α-氨基-3-羟基-5-甲基-4-异恶唑丙酸受体(α-amino-3-hydroxy-5-methyl-4-isoxazole propionic acid receptor, AMPAR)脑炎是一种比较少见的自身免疫机制介导的中枢神经系统疾病,而重症肌无力(myasthenia gravis, MG)伴胸腺肿瘤是一种神经肌肉接头传递障碍的自身免疫性疾病,两者并存发生其机制是否具有相似性,目前尚不清楚,需要更多的临床数据来验证说明。本文描述了1例以认知障碍1周就诊的患者,无精神行为异常、四肢抽搐、大小便失禁等表现,神经专科检查见反应迟钝,记忆力、计算力明显下降,经脑脊液、头胸部影像学检查诊断为抗AMPAR脑炎、MG伴胸腺肿瘤。该病例临床少见,其肿瘤较隐匿,值得临床医生学习和研究。
1 临床资料
患者女,47岁,患有“MG”3+年 ,平时长期服用嗅吡斯的明60 mg, 每日3次,症状控制可;本次以认知障碍1周于2019年3月5日就诊,主要表现记忆力下降,无明显精神行为异常、四肢抽搐、大小便失禁等表现,否认近期疫苗接种史。神经专科检查:神清语利,反应迟钝,记忆力、计算力明显下降,理解力,定向力尚可,脑膜刺激征阴性,余神经专科检查正常。简易精神状态量表(MMSE):得分7分(初中);实验室检查:脑脊液常规检查:有核细胞计数40×106/L, 单个核细胞98%, 分叶核细胞2%。脑脊液生化:糖5.36 mmol/L, 氯化物126.8 mmol/L, 蛋白定量0.29 g/L;脑脊液/血AMPAR2-R-Ab:阳性(1∶100);脑胸部平扫CT:左侧内囊前支见圆形稍低密度影,边界欠光整,长径约1.4 cm,右心房旁见一软组织团块影,最大层面约5.3 cm×3.0 cm,边界光整,实质密度尚均匀,致右肺受压,与右心房分界欠清,考虑占位性病变? 胸部增强CT:前纵隔右心房旁见一软组织团块影,最大层面约5.3 cm×3.0 cm,边界光整,实质密度尚均匀,增强不均匀强化,病灶致右肺受压,与右心房分界欠清,考虑肿瘤占位性病变?术前颅脑MRI+DWI+SWI示双侧大脑半球皮髓质交界区、左侧基底节区T2、FLAIR高信号、DWI病灶弥散信号、ADC序列混杂信号(见图1),余实验室检查和辅助检查未见异常。综上诊断:①自身免疫性脑炎(AMPAR2-R-Ab);②MG合并胸腺肿瘤。治疗上予以甲钴胺营养神经、甲强龙序贯疗法1 g,每日1次,连用3天、0.5 g ,每日1次, 连用3天、注射人免疫球蛋白22.5 g ,每日1次,连续5天冲击治疗,辅以保护胃黏膜、补钙、补钾等对症治疗;经胸外科会诊,患者纵膈占位有手术指征,转入胸外科在全身麻醉下行胸腔镜下行前纵膈肿瘤切除术,术后“前纵膈肿物”病理诊断符合AB型胸腺瘤(见图2)。术后胸部平扫CT提示“胸腺占位”术后,纵隔未见确切肿块影、结节影。患者病情稳定出院,交待门诊随访,但记忆力症状无明显缓解,长期继续口服激素维持治疗,逐渐减量停药,嘱定期门诊筛查肿瘤。
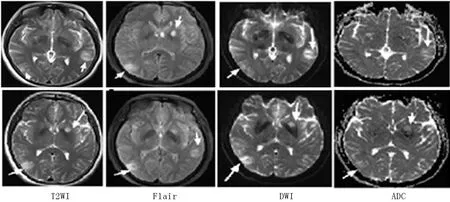
图1 术前颅脑MRI 双侧大脑半球皮髓质交界区、左侧基底节区T2、FLAIR高信号、DWI病灶弥散信号、ADC序列混杂信号
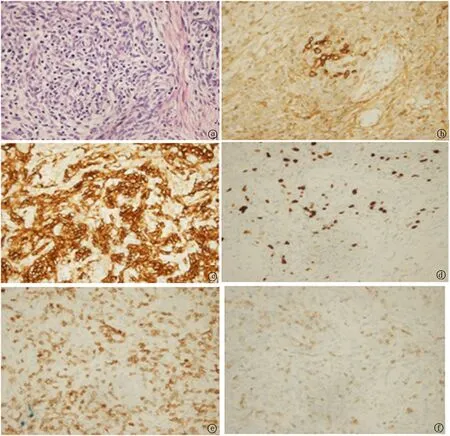
图2 前纵膈肿物病理a.HE染色:可见梭形、短圆形上皮细胞和梭形纤维母细胞样(×40);b.CD99(+):见少数未成熟T细胞(×40); c.CK(+):在细胞膜可见浅黄色或者棕黄颗粒(×40);d.Ki-67(+,约5%):肿瘤细胞细胞核表达阳性(×40);e~f. CD3、CD5, 可见T淋巴细胞阳性(×40)
2 讨 论
自身免疫性脑炎 (autoimmune encephalitis, AE) 泛指一类由自身免疫机制介导的脑炎,而抗AMPAR脑炎属于自身免疫性抗细胞表面抗原抗体脑炎一种亚型[1-3],该亚型在2009年首次临床上报道[4];其患者的典型症状为急性进行性边缘叶性脑炎,在临床上一般表现为急性或亚急性的记忆力减退、精神行为异常以及癫痫发作,多发于中年女性,通常发生在有严重免疫抑制的患者;抗N-甲基-D-天冬氨酸受体(N-methyl-D-aspartate receptor, NMDAR))脑炎[1]主要表现为弥漫性脑炎,相比之下,抗AMPAR边缘性脑炎的发病率较低[5-6]。
AE指的是由于神经元抗原成分的异常引起的中枢神经系统炎症性疾病,目前许多学者[7]依据是否有特异性抗原抗体反应对AE进行分类,分为特异性和非特异性抗原抗体相关脑炎,前者在经过免疫治疗后病情可缓解;依据特异性抗原抗体相关脑炎特异抗原所在部位不同[2-3, 8-9]可分为细胞内抗原相关抗体脑炎(PNDS)、抗细胞表面抗原、突触蛋白相关抗体脑炎和其他自身免疫介导的脑炎;细胞内抗原相关抗体脑炎者多为老年人,抗原与临床症状不直接相关,病程呈单相且不可逆,对免疫治疗反应差,主要介导细胞免疫反应,抗体可以诱发T细胞介导的炎症反应而导致神经细胞的损伤,并进一步破坏其功能;对于抗细胞表面抗原和突触蛋白相关抗体脑炎来说,此类脑炎的发病机制为特异抗体针对细胞表面抗原或突触蛋白发生作用,主要通过体液免疫机制引起相对可逆的神经元功能障碍。目前AE确切的神经功能障碍的发病机制仍尚未明确,有待进一步研究。自抗AMPAR脑炎概念第一次提出[4, 10],把抗AMPAR脑炎归为AE的一种亚型,其临床典型表现为认知障碍和癫痫等,病变部位主要为海马和杏仁核等处,常见于中年女性[6, 10],其中64%的患者常伴随肿瘤的发生,如比较常见的肺癌、乳腺癌及胸腺瘤[11],但是合并MG有胸腺瘤的非常罕见,目前仅有1例报道[12],本例为第2例。
抗AMPAR脑炎的病因及发病机制尚未完全阐明;有关文献报道[13]抗AMPAR抗体一般在细胞外谷氨酸受体1(GluR1)以及谷氨酸受体2(GluR2)亚单位抗原决定簇上产生反应,使受体出现反应和内化,进一步减少突触AMPAR簇;它主要存在于大脑皮层的基底神经节以及小脑内部,参与学习能力、记忆水平;所以通过头颅核磁共振,能够观察到单侧或双侧颞叶的T2和FLAIR象出现高表达,另外还能够观察到小脑、大脑皮质、基底节以及脑干部位的T2和FLAIR的信号出现异常;该患者的脑电图有十分典型的表现,我们可以观察到单侧或双侧颞叶出现局灶性痫性活动,还可以见到以弥漫性或多灶性为表现的慢波节律,以及尖波、慢波异常[12, 14]。总的来说,AE是一类免疫相关疾病,临床上,我们可以通过它的主要症状、自身抗体的检测以及影像学检查等途径对该疾病进行诊断,同时可根据脑脊液、血液抗体的检测对其进行确诊。本例病人的主要症状急进性的近记忆力减退,血清和脑脊液抗AMPAR抗体阳性,增强磁共振发现大脑半球皮髓质交界区、左侧基底节区异常信号,另外还发现了胸腺肿瘤病灶,它是抗AMPAR脑炎的重要诊断指标。
本例患者此次以认知障碍1周就诊,诊断AE即AMPAR2-R-Ab型、MG伴有胸腺瘤,长期院外口服嗅吡斯的明。值得关注的是,当前AE、MG伴胸腺瘤之间的发病机制是否具有重叠性或相似性还不清楚,还需要大量的样本数据来证明。
MG是自身抗体介导、T细胞参与和补体依赖的神经肌肉接头传递障碍的自身免疫性疾病,它主要以胸腺作为其靶器官[15],其胸腺是平衡免疫系统内环境、介导自身免疫耐受的重要免疫器官。MG经常伴随多种胸腺病变,如胸腺瘤、胸腺增生和萎缩等[16]。胸腺瘤占其中的15%,主要表现为前纵隔肿瘤。有文献表明,伴胸腺瘤MG患者胸腺瘤组织能够形成并向外周血中转移成熟的CD4+和CD45RA+细胞,如果正常乙酰胆碱受体(AchR)抗体反应性的成熟T细胞通过一系列的循环进入胸腺瘤中,可能会被刺激导致自身免疫性疾病。胸腺瘤中的T细胞转移至外周血或相应的淋巴器官,是导致自身免疫性和自身抗体产生的重要基础。Buckley等[17]表明,伴胸腺瘤MG病人的外周血T细胞中CD+4/CD+8的水平以及Treg细胞数目显著降低,且其功能和免疫抑制水平也出现障碍;据文献[18]表明,胸腺瘤合并自身免疫性疾病是由于细胞免疫以及体液免疫共同作用产生的。文献报道指出[18],大量由胸腺瘤产生的T细胞刺激CD4+T细胞,使其从细胞免疫转换至体液免疫,CD4+ T细胞的主要作用为介导机体产生体液免疫,刺激B细胞产生抗体;由此,我们推测伴有胸腺瘤的AE患者外周血中含有大量的自身抗体。
综上所述,通过对胸腺免疫功能的了解,推断出胸腺瘤病人有很大的概率患有自身免疫性疾病,如AE,可能主要与其细胞免疫和体液免疫联合作用的结果有关,但是目前对于该病的具体发病机制仍未完全阐明,需要大量样本量数据证明。因此,对患有AE伴有MG的胸腺瘤患者,其肿瘤较隐匿,临床医生应重视胸部胸腺影像学检查,以免造成漏诊。通过本文论述希望能够提高临床医生对AE合并MG疾病的重视及认识。
