“徐香”猕猴桃离体快繁研究
2020-06-09赵文娟吴杰新张汉尧
赵文娟,吴杰新,张汉尧
(西南林业大学西南地区生物多样性保育国家林业局重点实验室,云南昆明650224)
徐香猕猴桃是猕猴桃科(Actinidiaceae)猕猴桃属(Actinidia)多年生落叶藤本植物[1]。果实内不仅含有猕猴桃碱、蛋白水解酶、单宁、果胶和糖类等有机物质,还含有人体所需的17 种氨基酸和丰富的维生素C、柠檬酸、果糖、葡萄酸、苹果酸和钙、锌、硒、锗、钾等微量元素,营养价值高,市场前景良好。中国的猕猴桃产业不断扩大,市场应用前景广阔;广大顾客对猕猴桃苗的需求量也越来越大[2]。传统的猕猴桃繁殖方式主要采用种子播种,或采用实生苗作为砧木嫁接,育种周期长且产量较低;通过播种育苗,种子出苗率较低,还会引起后代性状变异;通过嫁接繁殖又会有砧木和接穗不亲和障碍、病毒复合感染的问题;而植物组织培养则利用细胞具有全能性的特点,通过离体器官的组织培养,降低了育苗成本;整个过程具有培养条件可控、生长周期短、繁殖力高、管理方便等优点;建立徐香猕猴桃的无菌体系,既能使其优良性状得以保存,又能大量培育出组培苗[3]。在生产生活中,可以用组培苗进行抗性筛选研究,得到能够抵御不良环境的徐香苗,提高育种效率,从而更好地应用于生产实践。本次实验对离体的徐香猕猴桃叶片进行培养,保存徐香猕猴桃的优良性状;因此,以植物组织培养技术为基础的离体快速繁殖技术将成为猕猴桃重要的良种繁育途径[4~5]。
1 材料与方法
1.1 供试材料
实验所需的外植体材料为西南林业大学温室大棚栽培的徐香猕猴桃嫩叶,或是通过室内水培的复幼嫩叶;实验及组织培养在西南林业大学西南地区生物多样性保育国家林业局重点实验室进行,组培室培养条件如下:光照采用日光灯光源,光照强度2000 Lux;温度 24 ℃;湿度 60%。
1.2 实验方法
1.2.1 MS 培养基的配制
空白培养基采用MS 培养基配方配制,培养基中加入 MS 粉 4.4 g/L,蔗糖 30 g/L,琼脂 4.5 g/L,用电磁炉煮沸水直至琼脂融化,将pH 值调至5.8。在压强98 kPa、温度121 ℃的条件下,灭菌21 min。
1.2.2 无菌体系的建立
选择无病虫害的根萌条、健康且生长旺盛的徐香猕猴桃嫩叶作为外植体。外植体消毒时,试验采用L9(23)正交实验筛选最佳消毒配方,其中因素1 为75%酒精的浸泡时间,3 个水平依次为 10 s、15 s、20 s;因素2 为0.1%升汞的浸泡时间,3 个水平分别是1 min、2 min、3 min;每个处理重复 3 次,每个重复 10 瓶。观察不同处理的生长情况,15 d 后统计污染叶片数(片)和褐化叶片数(片)。
1.2.3 愈伤组织诱导
实验使用细胞分裂素TDZ 和生长素IBA 在无菌体系建立的基础上,采用L9(23)正交实验筛选最佳诱导愈伤配比。因素1 为TDZ 的浓度,3 个水平分别是1 mg/L、1.5 mg/L、2 mg/L;因素 2 为 IBA 的浓度,3 个水平分别是 0.1 mg/L、0.2 mg/L、0.3 mg/L;每个处理重复3 次,每个重复10 瓶。30 d 后统计形成愈伤组织的情况。
1.2.4 不定芽分化诱导
选择6-BA 和NAA 作为本实验不定芽诱导的细胞分裂素,将生长良好的愈伤组织转接到不定芽诱导的培养瓶中,采用L9(23)正交实验筛选最佳不定芽诱导配方。其中因素1 为6-BA 的浓度,3 个水平分别为1 mg/L、1.5 mg/L、2 mg/L;因素 2 为 NAA 的浓度,3 个水平分别为 0.1 mg/L、0.2 mg/L、0.3 mg/L,且每个处理重复3 次,每个重复10 瓶。30 d 后统计不定芽的分化结果,统计不定芽分化的愈伤数量(株),平均出芽数(株),平均苗高(cm)。
1.2.5 生根诱导
生根诱导时使用1/2 MS 培养基,同样采用L9(23)正交实验筛选最佳生根配方。其中因素1 为IBA 的浓度,3 个水平分别为 0.5 mg/L、0.75 mg/L、1 mg/L;因素2 为 AC 的浓度,3 个水平分别为 0.1 g/L、0.2 g/L、0.3 g/L,且每个处理重复3 次,每个重复10 瓶。第7 d 起开始观察接入组培苗的生根情况,于第30 d 统计生根的株数、根长(cm)、计算生根率(%)。
1.2.6 炼苗与移栽
将长势旺盛,生根正常的组培苗移至自然光下生长,10 d 后开始慢慢松动瓶盖,15 d 后将组培瓶的瓶盖打开并用纱布掩住,20 d 后取出组培苗用流水将附着于根上的培养基冲洗干净,并用多菌灵溶液进行消毒泡洗5 min,之后在阴凉环境下晾干表面水分,栽种到经多菌灵杀毒处理过的不同配比的土壤基质中。实验选用的基质为腐殖土、生土、草炭土、珍珠岩,4 种基质比处理 1 为 1∶1 ∶1 ∶1、处理 2 为 2 ∶1 ∶1 ∶1、处理 3 为 3 ∶1 ∶1∶1、处理 4 为 4 ∶1 ∶1 ∶1。每个配方移栽 10 株生根苗,3 次重复。放置于阴凉处,用塑料薄膜或盖子将其盖住,保持温度在(26±3)℃,喷施水雾湿度控制在80%以上。20 d 后统计苗的长势情况,如是否健壮,有无萎蔫等。
2 结果与分析
2.1 不同消毒方法对徐香猕猴桃外植体的影响
表1 显示,外植体消毒的平均污染率在2.8%~88.9%,其中平均污染率最低的是处理8;平均成活率在7.8%~96.1%。平均成活率最高的是处理8,最低的是处理3。这说明0.1%升汞和75%酒精对外植体均有消毒效果,且消毒效果随酒精消毒时间的增加而增加,随0.1%升汞消毒时间的增加而呈现出先增后减的趋势;因此当75%酒精处理时间不足,0.1%升汞处理时间过长时(处理2)平均污染率高达88.9%;而适当的增加75%酒精消毒时长,外植体的平均污染率又有逐步降低的趋势,处理8 污染率降低至2.8%,同时外植体的成活率随升汞消毒灭菌时间的增加呈现出逐步减小的趋势,这与升汞消毒灭菌时对外植体细胞产生的毒害作用有关。不难看出,处理8 的消毒效果最好。
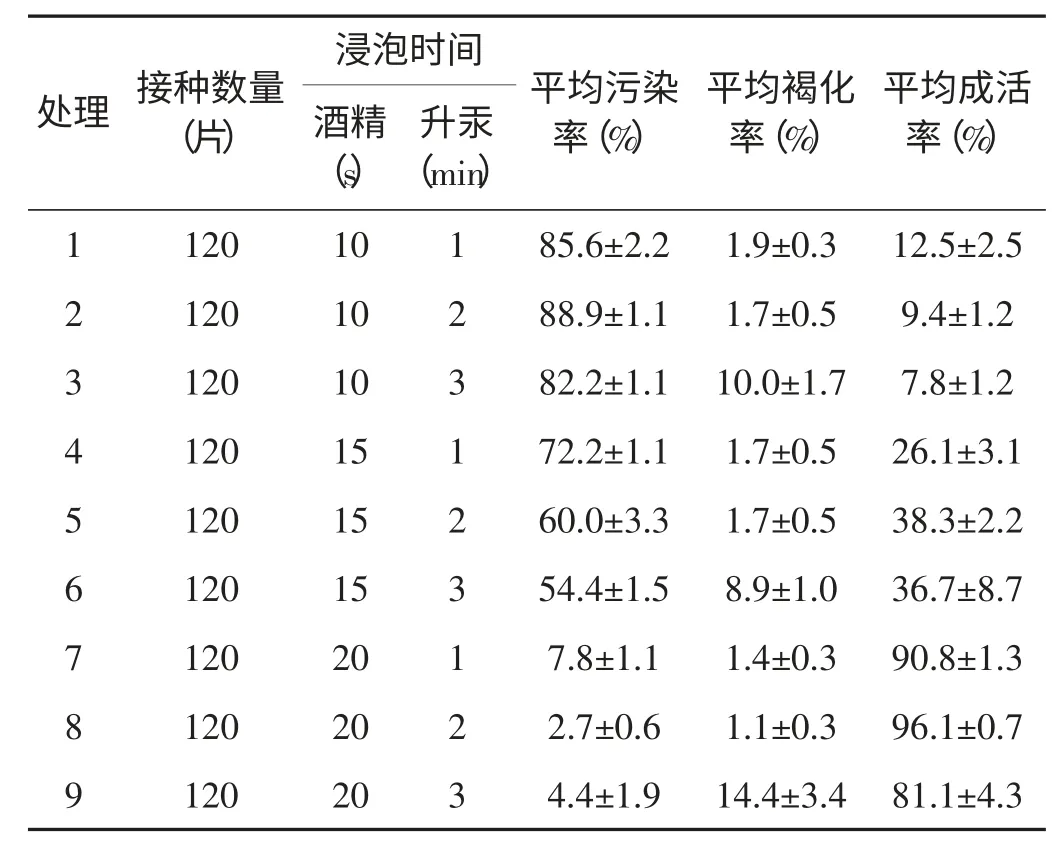
表1 徐香猕猴桃外植体各处理消毒效果

表2 外植体各处理消毒方差分析
如表2 所示,外植体消毒9 个处理间的污染率(P=0<0.01)差异极显著;褐化率(P=0<0.01)呈现极显著差异,成活率(P=0<0.01)也有极显著差异。
2.2 不同生长激素对徐香猕猴桃愈伤组织形成的影响
如表3 所示,30 d 后观察9 个处理的愈伤形成情况,平均死亡率在0%~74.5%,平均存活率在22.5%~92.5%,愈伤组织的形成率在29.2%~100%。其中平均存活率最高是处理6,高达92.5%;其愈伤形成率也最高,为100%,说明处理6 易诱导形成愈伤组织。
如表4 所示,愈伤组织诱导9 个处理间的褐化率(P=0<0.01)呈现极显著差异,成活率(P=0<0.01)也有极显著差异。
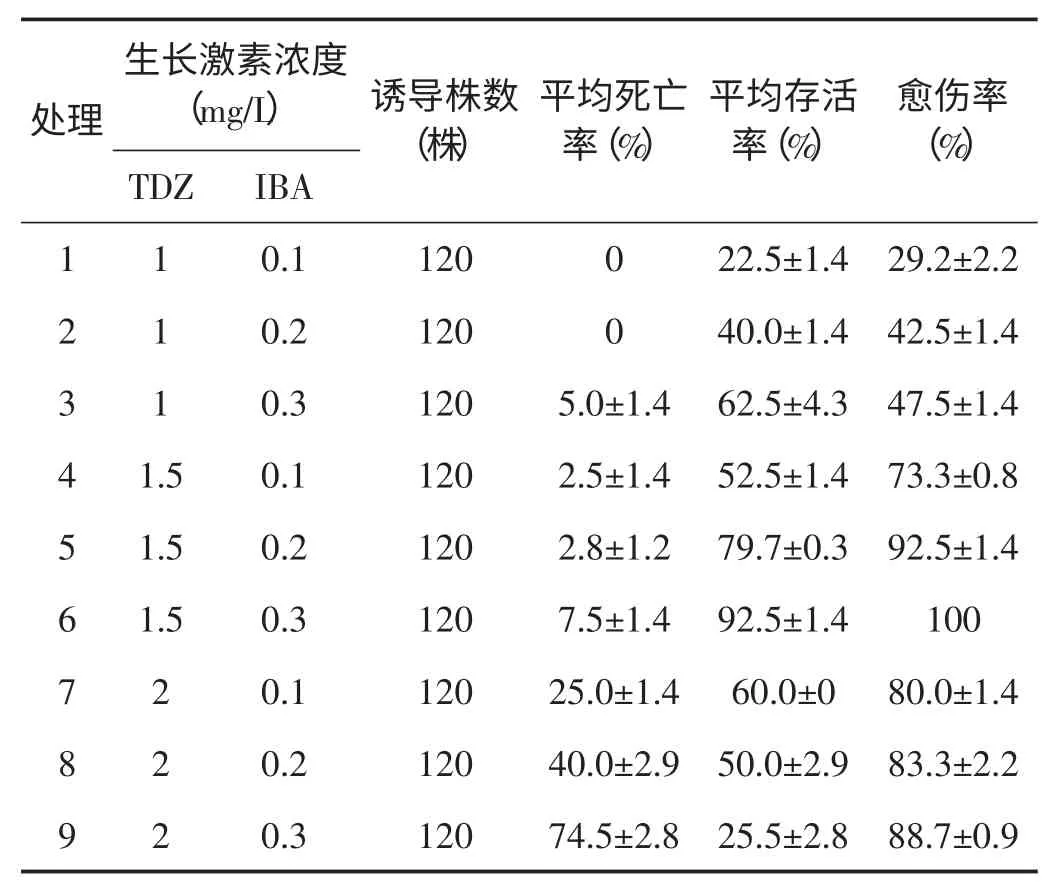
表3 不同生长激素对徐香猕猴桃愈伤组织形成的影响
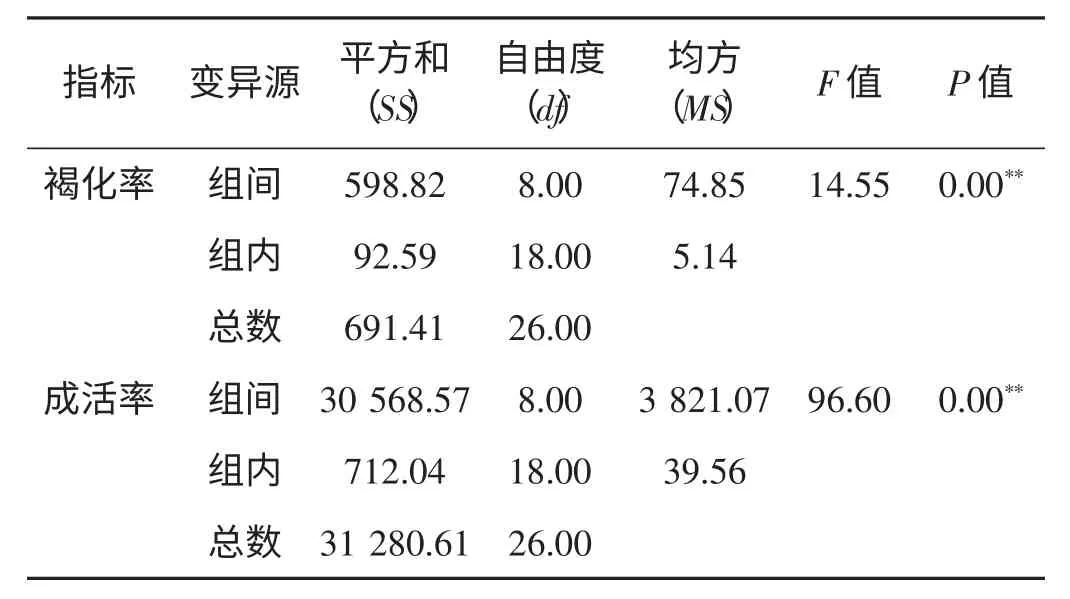
表4 愈伤组织诱导各处理的方差分析
2.3 不定芽诱导激素对徐香猕猴桃不定芽增殖的影响
如表5 所示,不定芽诱导平均株高9 个处理为0.5~1.77 cm,平均芽数0.86~9.62 个/株。其中处理9的平均株高最高,为1.77 cm,且其平均芽数也多,为9.62 个/株。
如表6 所示,不定芽诱导激素9 个处理间的平均芽高(P=0<0.01)有极显著差异;平均芽数(P=0.001<0.01)呈现极显著差异。

表5 不定芽诱导激素各处理效果

表6 不定芽诱导激素各处理方差分析
2.4 不同生根处理对徐香猕猴桃生根的影响
表7 表明,9 个生根处理的生根率在 46.7%~98.3%,平均根长在4.9~9.4 cm。其中,处理9 诱导生根效果最好,平均生根率可达98.3%,且诱导生长的根长最长,已达9.4 cm。

表7 不同生根处理对徐香猕猴桃生根的影响
如表8 所示,9 个处理间的生根率(P=0<0.01)有极显著差异;生根数(P=0<0.01)呈现极显著差异,根长(P=0<0.01)也有极显著差异。
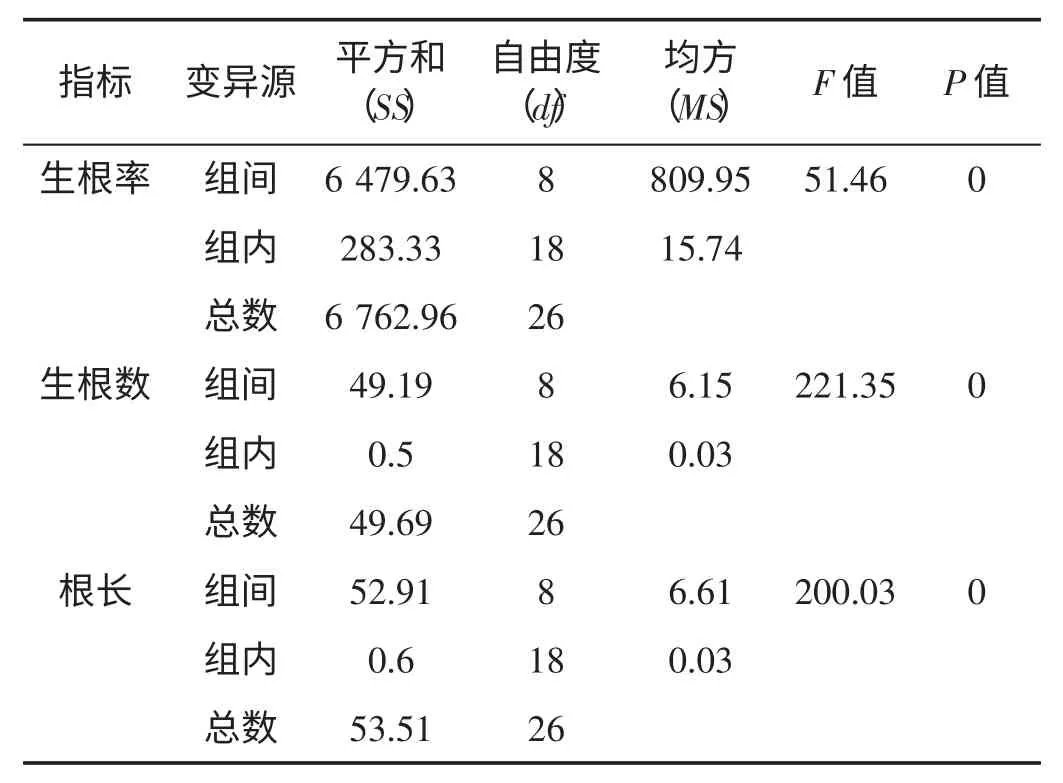
表8 不同生根处理方差分析
2.5 不同基质配比对徐香猕猴桃炼苗成活率的影响
如表9 所示,4 个处理生长成活率较高的是处理4,即腐殖土 ∶生土 ∶草炭土 ∶珍珠岩为 4 ∶1 ∶1 ∶1 时,苗木生长情况较其他处理更绿,苗木生长也比较健壮。

表9 不同基质配比对徐香猕猴桃炼苗成活率的影响
3 讨论
通过实验,得出最佳的外植体灭菌方法为流水冲洗30 min+75%酒精消毒20 s+0.1%升汞消毒2 min。75%的酒精灭菌消毒时间在外植体消毒杀菌过程中有着主要作用。当75%酒精处理20 s 时,可得到最佳的消毒灭菌效果,时间过短会增加外植体污染率;0.1%升汞消毒2 min 又优于消毒1 min 和3 min,这和葛新玲得出的最佳外植体消毒时间不同,葛新玲通过建立猕猴桃再生体系,得出最佳的酒精处理时间为10~15 s,然后用升汞处理8 min[6],这可能由于外界环境和外植体本身差异导致;0.1%升汞对外植体的消毒效果随消毒时间的增加出现先增后减的趋势,这和马欢[7]外植体消毒灭菌方法得出的结论相一致。
周红菊[8]用欧亚旋覆花为材料,探究了TDZ 在用叶片、根部诱导形成愈伤组织时得出,当培养基中加入TDZ 0.05 mg/L 时,欧亚旋覆花的根部长出的愈伤组织较好,且分化较快,愈伤组织分化率达到100%,分化出来的愈伤组织也有光泽。而潘伟明[9]采用环割进行压条时的实验结果表明,IBA 溶液对猕猴桃愈伤组织的形成有促进作用,且浓度越高效果越好。
本次实验表明,愈伤组织诱导效果最好的是当激素浓度TDZ 1.5 mg/L+IBA 0.2 mg/L 时,污染率最低,成活率达到92.5%,愈伤形成率可达100%。其中,IBA 的浓度作用效果与潘伟明得出的结论相符;最适宜诱导愈伤组织生长的TDZ 浓度与周红菊得出的结论不符,可能是由于实验材料、环境及其操作人员的不同造成。实验显示,当激素浓度为IBA 1 mg/L+AC 0.3 g/L 时,不定芽生根率较高,平均生根率可达98.3%,且诱导生根后根生长较好。王大平[10]对猕猴桃组织培养苗生根条件进行研究得出,最佳生根诱导培养基为1/2MS+IBA 1.0 mg/L+0.3%活性炭,与本实验结果相似。
