利川市藤茶黄酮成分研究
2020-06-08李宇刘翠君艾伦强张宇卢新鹏何美军冉亚兰
李宇 刘翠君 艾伦强 张宇 卢新鹏 何美军 冉亚兰


摘要:从湖北省利川市齐岳山(海拔1 500~1 600 m)采集藤茶(Ampelopsis grossedentata)样品,采用60%乙醇超声提取总黄酮,利用紫外可见光分光光度计双波长(λ=208.4 nm,λ=293.2 nm)检测藤茶幼嫩茎尖总黄酮,平均含量高达453.67±11.26 mg/g;利用硅胶柱色谱及半制备高效液相分离到3个化合物,利用LC-HR-ESIMS、1D和2D NMR波谱数据进行分析,鉴定其结构分别为二氢杨梅素(1)、杨梅素(2)和花旗松素(3);通过高效液相(HPLC)检测分析发现,利川市藤茶样品中二氢杨梅素、杨梅素和花旗松素的含量为别186.31±10.43、13.83±1.32、14.76±2.26 mg/g。
关键词:藤茶(Ampelopsis grossedentata);总黄酮;二氢杨梅素;杨梅素;花旗松素;利川市
中图分类号:S571.1 文献标识码:A
文章编号:0439-8114(2020)04-0098-04
Abstract: The total flavonoids were extracted by 60% ethanol-ultrasound from the samples of Ampelopsis grossedentata collected from Qiyueshan mountain (1 500~1 600 m),Lichuan city, Hubei province. The total flavonoids in the young tips of Ampelopsis grossedentata was up to 453.67±11.26 mg/g detected by ultraviolet-visible spectrophotometer at the double-wavelength (λ=208.4 nm,λ=293.2 nm). Three compounds were purified from the organic extract using LC-HR-ESIMS,1D and 2D NMR spectral data analysis. Their structures were identified to be dihydromyricetin(1), myricetin(2),and taxifolin(3). The contents of dihydromyricetin, myricetin and taxifolin were 186.31±10.43, 13.83±1.32 and 14.76±2.26 mg/g respectively detected by HPLC.
Key words: Ampelopsis grossedentata; total flavonoids; dihydromyricetin; myricetin;taxifolin; Lichuan city
黄酮类化合物是一类广泛存在于植物体内的次级代谢产物,其母核结构是由2个苯环(A环和B 环)与3个碳原子桥连所形成的C6-C3-C6化合物[1]。由于多数黄酮类化合物分子中存在A环和B 环与C3碳原子桥上的双键组成的交叉共轭体系,在紫外吸收区域内存在2个主要的峰带Ⅰ和峰带Ⅱ,其峰形可初步判断黄酮类化合物的母核結构特征。累计已超过9 000个黄酮类化合物在植物中被发现,成为天然产物中最大家族之一[2]。黄酮类化合物具有抗菌、抗病毒、抗炎、保护心脏、抗糖尿病、抗癌、抗衰老等多种生理活性[3-5]。
湖北省农业科学院中药材研究所天然产物科室从湖北省利川市齐岳山(海拔1 500~1 600 m)采集藤茶(Ampelopsis grossedentata)样品,藤茶为葡萄科(Vitaceae)蛇葡萄属(Ampelopsis Michx.)植物。藤茶粗提取物(VTE)具有抗氧化、抗炎、保护肝脏、抗肿瘤、抗酪氨酸酶、抗糖尿病、降血脂等多种生理功能[6-8]。本试验采用乙醇溶液超声提取藤茶总黄酮,利用紫外可见分光光度计双波长检测藤茶幼嫩茎尖总黄酮含量;利用硅胶柱色谱及半制备高效液相色谱分离化合物,利用LC-HR-ESIMS、1D和2D NMR波谱数据分析,鉴定其结构;通过高效液相(HPLC)检测分析其含量,以期为藤茶多糖的开发提供参考。
1 材料与方法
1.1 材料与仪器
藤茶样品是从湖北省利川市齐岳山(海拔 1 500~1 600 m)采集,由湖北省农业科学院中药材研究所鉴定。
Bruker AV700超导核磁共振波谱仪(700/175 MHz,TMS为内标),Agilent 1260型高效液相色谱仪(配DAD检测器),UV-1800型岛津紫外可见光分光光度计,KQ5200DE型数控超声波清洗器,Phenomenex色谱柱(50 mm×4.6 mm,ODS 5 μm);Agilent Poroshell反相色谱柱120 EC-C18(4.6 mm×150 mm,4 μm);HS-GF254硅胶薄层板;J & K色谱纯乙腈;黄酮化合物化合物标准品二氢杨梅素[(2R,3R)-Dihydromyricetin]、杨梅素和花旗松素均购自于阿拉丁试剂公司;其他试剂均为国产分析纯。
1.2 试验方法
1.2.1 藤茶乙醇提取物的获得 将恩施藤茶和西安藤茶打成粉末,共重710.31 g,用35.5 L的60%乙醇萃取,60%乙醇溶液浸泡18 h,500 W超声提取30 min,取上清液过滤,取滤液旋蒸,得到浸膏200.27 g。
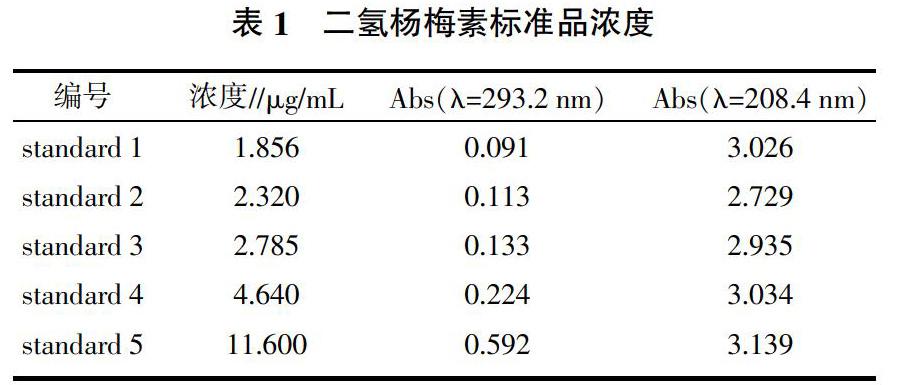
1.2.2 藤茶乙醇提取物总黄酮检测 选用双波长检测藤茶总黄酮含量[9],取乙醇提取浸膏,用乙醇稀释1×104倍备用,选用岛津紫外可见分光光度计(UV-1800),检测器设置波长扫描范围为190~700 nm,获得待测藤茶稀释样品的吸收波峰。对比分析确认藤茶样品提取液中的物质主要为黄酮类化合物。选择检测波长分别为208.4、293.2 nm,绘制二氢杨梅素的标准曲线,测定各样品黄酮化合物的含量。将标准品二氢杨梅素分别设置5个浓度梯度,并编号为standard 1、standard 2、standard 3、standard 4、standard 5,如表1所示。利用UVProbe 2.42 软件绘制校正曲线,计算样品浓度,再设置标准品加样回收试验,计算回收率,以保证试验方法的可靠性。
1.2.3 藤茶乙醇提取物化合物的分离鉴定 藤茶乙醇提取物浸膏用硅胶柱进行分离,以石油醚/乙酸乙酯体系(100∶0、80∶20、50∶50、20∶80、0∶100,V/V)和乙酸乙酯/甲醇体系(80∶20、50∶50、0∶100,V/V)洗脱,得到8个组分Fr.A1~Fr.A40。根据HPLC和TLC分析结果,将Fr.A25~Fr.A28合并正向硅胶分离,以氯仿/甲醇体系(100∶0、98∶2、96∶4、94∶6、92∶8、90∶10、80∶20,V/V)洗脱,得到10个组分Fr.B1~Fr.B10。根据HPLC分析,经半制备HPLC、ODS色谱柱(250 mm×10 mm,5 μm)分离Fr.B5,以CH3CN/H2O(15∶85至100∶0,V/V)体系洗脱30 min,流速为2.5 mL/min,得到化合物3(tR=21.7 min,10 mg)。将组分Fr.A6、Fr.A7合并,经半制备HPLC、ODS色谱柱分离,以CH3CN/H2O(15∶85至45∶55,V/V)体系洗脱30 min,流速为2.5 mL/min,得到化合物1(tR=11.5 min,30 mg)和化合物2(tR=15.3 min,12 mg)。
1.2.4 藤茶乙醇提取物黄酮类化合物含量的测定 利用高效液相外标法测定藤茶各黄酮化合物的含量。将标准品二氢杨梅素、杨梅素和花旗松素分别设置6个浓度梯度,配制成6组混标样品,高效液相数据处理软件外标法绘制校正曲线,计算样品浓度,再设置加样回收试验,计算回收率,以保证试验方法的可靠性。
2 结果与分析
2.1 藤茶乙醇提取物紫外吸收光谱
用岛津紫外可见分光光度计检测藤茶样品,藤茶样品在波长510.4 nm处有最大吸收峰。选择检测波长为208.4、293.2 nm双波长检测藤茶样品,利用UVProbe 2.42软件绘制绘制二氢杨梅素标准品的校正曲线,方程为(x为Abs,y为浓度):y=0.051 64x-0.009 13(r2=0.999 58)。
2.2 藤茶乙醇提取物的总黄酮含量
采集于利川市齐岳山的3个藤茶样品MDB1、MDB2、MDB3总黄酮类化合物含量分别为441.0±4.5、480.0±15.5和440.0±14.0 mg/g,检测到利川藤茶幼嫩部位干重总黄酮含量≥40%(表2),是已知报道的植物中总黄酮含量最高的物种之一。
2.3 藤茶乙醇提取物黄酮类化合物的鉴定及含量测定
藤茶乙醇提取物黄酮类化合物鉴定结果表明,化合物1为白色无定型粉末,(+)HR-ESI-MS分析显示其在m/z 321.1出现[M+H]+峰。化合物1的UV吸收光谱在218.7、292.5 nm处显示2个最大吸收波长,提示可能为黄酮母核结构。1H NMR谱表明,该化合物含4个芳香质子(2个δH 6.51、1个δH 5.84、1个δH 5.87),苯环上的2个芳香质子δH 5.84、δH 5.87耦合,耦合常数为J=13.2 Hz,说明2个邻位或者间位。2个连氧次甲基质子(δH 4.44,δH 4.84),耦合常数为J=11.2 Hz,说明2个邻位C上。13C NMR谱给出12个芳碳信号(C 96.4~C 168.7),其中除2个C 108.2(C-11、C-15)是苯环对称位置的非连氧芳碳,其余全是连氧碳。另有2个连氧次甲基碳(C 73.7、C 85.2)、1个羧基碳(δC 198.3)。结合化合物1的DEPT135谱信息推测,有6个季碳原子(C 73.7、C 85.2、C 96.4、C 97.5、C 108.2、C 108.2),其余全为叔碳。化合物1的1H和13C NMR化学位移值与文献[10]报道的二氢杨梅素的核磁谱相近,推断该化合物为二氢杨梅素。
鉴定结果中,化合物2為绿色无定型粉末,(+)HR-ESI-MS分析显示其在m/z 319.0出现[M+H]+峰。化合物1的UV吸收光谱在210.2、260.6、379.0 nm处显示3个最大吸收波长,提示可能为黄酮母核结构。化合物2的1H及13C NMR数据与化合物1数据相似(表1),说明化合物2是黄酮类化合物。与化合物1相比,C-8=73.7,C-9=85.2化学位移值移动到低场C-8=136.9、C-9=146.9。结合化合物2的DEPT135谱信息推测,2个季碳原子(C 73.7、C 85.2)的氢被取代,C8、C9形成双键。化合物2的1H和13C NMR化学位移值与文献[11]报道的杨梅素的核磁谱相近,推断该化合物为杨梅素。
鉴定结果表明,化合物3为绿色无定型粉末,(+)HR-ESI-MS分析显示其在m/z 305.1出现[M+H]+峰。化合物3的UV吸收光谱在211.5、290.4 nm处显示2个最大吸收波长,提示可能为黄酮母核结构。化合物3的1H及13C NMR数据与化合物1数据相似(表3),说明化合物3是黄酮类化合物。与化合物1相比,C-15=108.6化学位移值移动到低场C-15=121.1,结合化合物3的DEPT135谱信息推测,C-15的-OH被-H取代。C15-H与邻位C16-H耦合,耦合常数为J=11.6 Hz。化合物3的1H和13C NMR化学位移值与文献[10]报道的Taxifolin的核磁谱相近,推断该化合物为花旗松素(Taxifolin)。
试验分离到的3个黄酮类化合物的结构式如图1所示。
2.4 藤茶乙醇提取物黄酮类化合物含量测定
利用高效液相外标法测定利川市各黄酮化合物的含量:二氢杨梅素为186.31±10.43 mg/g、花旗松素为14.76±2.26 mg/g、杨梅素为13.83±1.32 mg/g。設置加样回收试验,计算回收率,如表4所示。3种黄酮类化合物的回收率分别为91.36%、93.26%、92.52%。
3 小结
本试验研究发现,利川市产区藤茶幼嫩茎尖总黄酮平均含量高达453.67±11.26 mg/g,是已知所有植物种类中总黄酮含量最高的物种之一。从藤茶幼嫩茎尖乙醇提取物中分离鉴定了3个化合物:二氢杨梅素(1)、杨梅素(2)和花旗松素(3),并测定藤茶幼嫩茎尖中3种化合物的含量分别为186.31±10.43、13.83±1.32、14.76±2.26 mg/g。研究表明,二氢杨梅素具有抗氧化、抗神经炎症、神经保护、抗老年痴呆症、抗菌、抗癌等多种生理活性[12]。杨梅素具有抗炎、抗糖尿病和抗癌的作用[13]。花旗松素具有抗氧化、抗炎、保护心血管、保护肝脏、抗老年痴呆症、抗菌和抗癌等多种生理活性[14]。目前,尚无关于藤茶植物体内黄酮类化合物的次级代谢途径以及二氢杨梅素的大量积累机制的报道,后续将通过藤茶次级代谢产物分离鉴定和转录组测序,进一步研究其黄酮类化合物的次级代谢途径以及二氢杨梅素的大量积累机制。
参考文献:
[1] WANG T Y,LI Q,BI K S.Bioactive flavonoids in medicinal plants:Structure,activity and biological fate[J].Asian journal of pharmaceutical sciences,2018,13(1):12-23.
[2] WANG Y,CHEN S,YU O. Metabolic engineering of flavonoids in plants and microorganisms[J].Applied microbiology and biotechnology,2011,91(4):949.
[3] ZHANG X X,WU Q F,YAN Y L,et al. Inhibitory effects and related molecular mechanisms of total flavonoids in Mosla chinensis Maxim against H1N1 influenza virus[J].Inflammation research,2018,67(2):179-189.
[4] HWAN L,SEULKI L,YU S,et al. Anti-cancer effect of quercetin in xenograft models with EBV-associated human gastric carcinoma[J].Molecules,2016,21(10):1286.
[5] PATIL L,KALIWAL B B. Microalga Scenedesmus bajacalifornicus BBKLP-07, a new source of bioactive compounds with in vitro pharmacological applications[J].Bioprocess and biosystems engineering,2019,42(6):979-994.
[6] ZHANG X,XU Y,XUE H,et al. Antioxidant activity of vine tea (Ampelopsis grossedentata) extract on lipid and protein oxidation in cooked mixed pork patties during refrigerated storage[J].Food science & nutrition,2019,7(5):1735-1745.
[7] ZHENG Z W,GUO C X,MAO J,et al. Inhibitory effects of vine tea extract on proliferation of SGC-7901 human stomach cancer cells[J].Lishizhen medicine and materia medica research,2009,20(5):1158-1159.
[8] SHENG G,CHEN Y S,ABBASI A M,et al. Tannin fraction from Ampelopsis grossedentata leaves tea (Tengcha) as an antioxidant and α-lucosidase inhibitory nutraceutical[J].International journal of food science & technology,2016,51(12):2692-2700.
[9] XIE Y,LIU Q Q,LU Z Y,et al.The Processing technology of compound beverage and analysis on flavone of Ampelopsis grossedentata from fanjing mountain[J].Food research and development,2018,39(14):84-89.
[10] WANG L,LI X,ZHANG S,et al. Natural products as a gold mine for selective matrix metalloproteinases inhibitors[J].Bioorganic & medicinal chemistry,2012,20(13):4164-4171.
[11] WANG Y,ZHOU L,LI R,et al. Studies on the chemical constituents from Ampelopsis grossedentata[J].J Chin Med Mat,2002,25(4):254-256.
[12] JIA L G,WANG Y,SANG J C,et al. Dihydromyricetin inhibits alpha-synuclein aggregation,disrupts preformed fibrils,and protects neuronal cells in culture against amyloid-induced cytotoxicity[J].Journal of agricultural and food chemistry,2019, 76(14):3946-3955.
[13] PAN X X,CHEN T T,ZHANG Z J,et al. Activation of Nrf2/HO-1 signal with myricetin for attenuating ECM degradation in human chondrocytes and ameliorating the murine osteoarthritis[J].International immunopharmacology,2019,75(1):1-14.
[14] SUNIL C,XU B J,et al. An insight into the health-promoting effects of taxifolin(dihydroquercetin)[J].Phytochemistry,2019,7(5):1735-1745.
