Apelin-13通过调节YAP入核抵抗缺氧诱导的视网膜Müller细胞凋亡
2020-06-08孙磊,陶勇
孙 磊,陶 勇
0引言
爱帕琳肽(Apelin/APLN)是由77个氨基酸构成的多肽,为血管紧张素样G蛋白偶联受体(APJ)的配体[1]。Apelin-13是Apelin的亚型之一,在心血管系统、神经系统、内分泌系统及消化系统中发挥重要生物学作用[2]。Müller细胞为脊髓动物视网膜中的主要神经胶质细胞,表达多种功能性的酶,对视网膜结构和功能维持具有重要作用[3]。生理条件下,Müller细胞能支持血-视网膜屏障的完整性,而病理条件下其可参与视网膜水肿形成[4]。研究显示,Apelin能诱导Müller细胞对缺氧或葡萄糖剥夺的耐受[5]。另有研究报道,Apelin-13通过GLP-1R/PI3K/Akt信号通路抑制神经细胞凋亡,并减轻蛛网膜下腔出血后的早期脑损伤[6]。还有研究显示,Apelin-13可能通过调节胶质纤维酸性蛋白(glial fibrillary acidic portein,GFAP)和血管内皮生长因子(vascular endothelial growth factor,VEGF)的表达从而介导Müller细胞的增殖、迁移及存活[7]。提示,Apelin-13与Müller细胞存活或凋亡有关。yes相关蛋白(yes-associated protein,YAP)为一种转录共激活因子,主要在Hippo通路下游发挥细胞增殖和凋亡调控作用[8]。目前,还未有研究报道YAP是否与Apelin-13介导的细胞存活或凋亡相关,本研究主要对此进行探讨。
1材料和方法
1.1材料胎牛血清(fetal bovine serum,FBS)、DMEM/F12培养基购自美国Gibco公司;YAP抗体(货号4912)、GFAP抗体(货号80788S)、Phospho-YAP(Ser127)(D9W2I)抗体(货号13008)、Phospho-LATS1(Ser909)抗体(货号9157)购自美国CST公司;LATS1抗体购自美国abcam公司(货号ab70561);GAPDH抗体(货号AP0063)、抗兔IgG-HRP二抗(货号BS13278)、抗小鼠IgG-HRP二抗(货号BS12478)购自南京巴傲得公司;总蛋白提取试剂盒和细胞裂解液购自上海碧云天公司;聚偏二氟乙烯膜(PVDF)购自美国Millipore公司。主要仪器设备:Elx808全波段多功能酶标仪,美国BioTek公司;AI600凝胶成像仪,美国GE公司;PIPETMAN L微量可调加样器,法国Gilson公司产品; Allegra 64R Centrifuge台式高速冷冻离心机,美国Beckman Coulter公司产品;Eclipse Ti-s倒置显微镜,日本Nikon公司。
1.2方法
1.2.1 Müller细胞的提取分离和培养将新西兰乳兔处死,迅速取下眼球,用含庆大霉素(10U/mL)的生理盐水冲洗2~3次,去掉眼前部组织及玻璃体,剥取视网膜神经层,冲洗掉粘着的色素上皮细胞,铺平视网膜组织,撕下不含血管和髓放线的部分组织,用Ⅳ型胶原酶(1mg/mL)和0.2%透明质酸酶(100U/mL)消化30~40min,以DMEM/F12(含10% FBS)终止消化,吹散细胞并用100μm滤网过滤,800r/min离心5min后弃去上清,用DMEM/F12(含20% FBS)重悬细胞并接入培养瓶中,置于37℃、5% CO2的培养箱中培养。待细胞贴壁后每隔1d换液,生长至80%密度时进行传代。
1.2.2免疫荧光检测GFAP和YAP的表达情况将Müller细胞在4%多聚甲醛中固定30min后,室温下用Triton X-100透核膜10min。用含5% BSA的PBS封闭2h,于4℃下孵育一抗GFAP和YAP(1∶500)过夜,同时以DAPI染核。分别室温孵育对应荧光二抗2h,PBS洗片后应用荧光显微镜观察拍照,记录软件显示的荧光强度值。
1.2.3结晶紫染色观察细胞形态将Müller细胞接种于6孔板中,当细胞生长至80%密度时进行结晶紫染色,细胞用PBS轻柔地洗2遍,每孔加入4%多聚甲醛1mL,37℃固定10min,PBS洗2遍,每遍1min,各加入1mL结晶紫染色液染10min,双蒸水洗涤后拍照。实验重复3次。
1.2.4 MTT法检测细胞活力取Müller细胞铺于96孔板中,每孔细胞数为9×103个,以正常条件下培养的Müller细胞作为对照组,缺氧条件下(92% N2、5% CO2和3% O2)以Apelin-13(0、0.01、0.1、1、10μmol/L)处理24h,每组设置5个复孔,同时设置调零孔。24h时每孔加入10μL MTT溶液,培养箱孵育4h,酶标仪测定OD值(450nm),计算细胞活力。细胞活力=(Apelin-13组OD值-调零孔OD值)/(对照组OD值-调零孔OD值)×100%。
1.2.5 TUNEL染色检测细胞凋亡将Müller细胞分为对照组、缺氧组和实验组,对照组细胞培养于正常环境中,缺氧组细胞培养于缺氧环境中,实验组细胞培养于缺氧环境中并以Apelin-13(1μmol/L)处理24h。将处理好的对照组、缺氧组和实验组Müller细胞制成悬液后爬片,用固定液固定爬片1h,PBS漂洗,通透液冰上孵育2min,PBS漂洗玻片2次,干燥,加50μL TUNEL染色液于爬片区避光孵育1h,PBS漂洗3次,加入适量的DAPI染色5~10min,吸出染液,PBS漂洗3次,荧光显微镜下观察。随机选取5个非重叠200倍镜视野拍照,计数凋亡细胞数和细胞总数,计算凋亡率。
1.2.6蛋白印迹检测p-LATS1、p-YAP、LATS1及YAP蛋白表达变化将处理好的对照组、缺氧组和实验组细胞取出,用蛋白刮刀将贴壁细胞刮下,将细胞悬液收集于10mL离心管,1 200r/min离心5min,弃去上清液,将管内液体吸净,各组细胞加入含RIPA的细胞裂解液(含1mmol/L蛋白酶和磷酸酶抑制剂混合物),冰上裂解10min,4℃下12 000r/min离心20min,吸取上清液置于冰上备用,BCA法进行定量,制备样品。SDS-PAGE电泳分离蛋白(各样品上样量为30μg),转膜,5%脱脂牛奶封闭PVDF膜4h,TBST缓冲液洗膜3次,每次10min;然后按要求加入YAP(1∶2000)、p-YAP(1∶1000)、LATS1(1∶1000)、p-LATS1(1∶1000)或GAPDH抗体(1∶5000)4℃孵育过夜。次日,TBST洗膜3次,再加入相应的二抗(1∶5000),室温孵育1h,以ECL化学发光液进行显色,凝胶成像仪进行成像并检测灰度值。
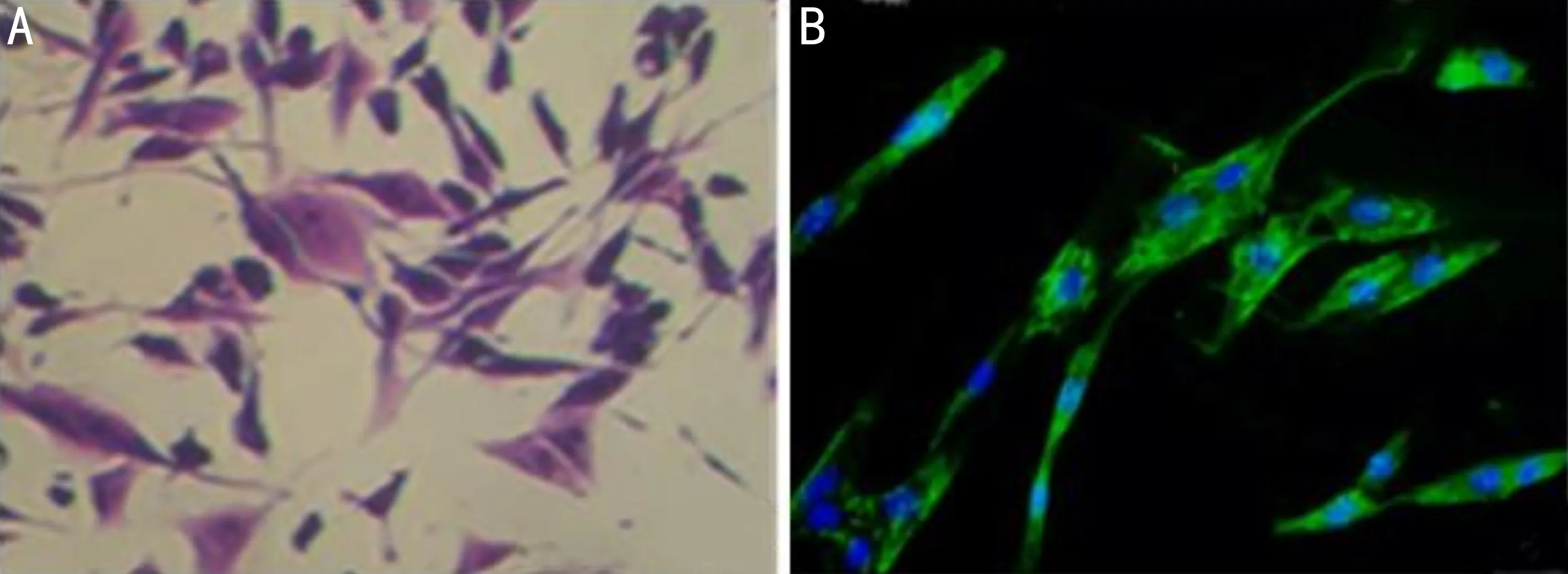
图1 Müller细胞的鉴定图(×200) A:Müller细胞结晶紫染色;B:Müller细胞以绿色荧光标记的GFAP抗体进行免疫荧光染色(绿色:GFAP染色阳性细胞;蓝色:细胞核)。
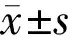
2结果
2.1 Müller细胞的鉴定提取分离的Müller细胞传代后贴壁生长,细胞呈长梭形、多角形、圆形等形态,细胞质丰富,细胞核呈圆形,见图1A。绿色荧光标记的GFAP抗体染色,荧光显微镜下发现,大部分细胞呈现绿色荧光,见图1B。
2.2 Apelin-13抵抗缺氧诱导的Müller细胞活力降低MTT实验结果显示,以正常条件下的Müller细胞作为对照组,细胞活力为100%,缺氧条件下0、0.01、0.1、1、10μmol/L Apelin-13处理24h后的Müller细胞活力分别为(61.1±4.3)%、(66.3±4.7)%、(71.5±6.0)%、(82.3±7.1)%、(81.3±7.9)%,组间总体比较差异具有统计学意义(F=18.56,P<0.0001)。与对照组相比,缺氧(0μmol/L Apelin-13处理组)诱导Müller细胞活力显著下降(P<0.0001);而缺氧条件下,与0μmol/L Apelin-13处理组相比,0.01~10μmol/L Apelin-13均能抵抗缺氧诱导的细胞活力下降,其中0.1、1、10μmol/L Apelin-13处理组差异显著(P=0.041、0.0006、0.0008),见图2。
2.3 Apelin-13抵抗缺氧诱导的Müller细胞凋亡TUNEL染色结果显示,对照组、缺氧组及实验组细胞24h凋亡指数为(3.20±0.03)%、(18.62±1.66)%、(3.86±0.03)%,组间总体比较差异具有统计学意义(F=413.5,P<0.0001)。与对照组相比,缺氧组凋亡指数明显升高,差异有统计学意义(P<0.0001);与缺氧组相比,实验组细胞凋亡指数明显降低,差异有统计学意义(P<0.0001),见图3。
2.4 Apelin-13抑制缺氧条件下Müller细胞的YAP磷酸化蛋白印记结果显示,24h时,对照组、缺氧组及实验组细胞p-LATS1相对蛋白表达水平为(123.2±7.6)%、(119.8±7.9)%、(29.3±2.0)%,组间差异有统计学意义(F=205.6,P<0.0001)。各组p-YAP相对蛋白表达水平为(156.2±9.3)%、(155.2±9.8)%、(36.5±3.1)%,组间差异有统计学意义(F=205.6,P<0.0001)。与对照组相比,缺氧组细胞p-LATS1和p-YAP蛋白表达无明显差异;而与缺氧组相比,实验组细胞p-LATS1和p-YAP蛋白表达明显降低,差异有统计学意义(P<0.0001),见图4。
2.5 Apelin-13诱导缺氧条件下Müller细胞YAP入核24h时,对照组、缺氧组及实验组细胞YAP细胞核荧光强度为68±6、70±6、106±8,组间总体比较差异具有统计学意义(F=30.26,P=0.0007)。对照组和缺氧组细胞无明显差异;而与缺氧组相比,实验组细胞YAP细胞核荧光强度明显升高,差异有统计学意义(P=0.0006),见图5。
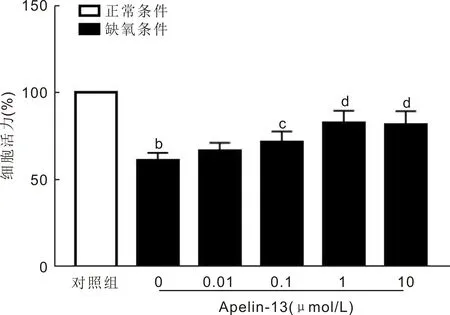
图2 Apelin-13对缺氧条件下Müller细胞活力的影响bP<0.01vs对照组;cP<0.05,dP<0.01vs0μmol/L Apelin-13组。
3讨论
Müller细胞是视网膜组织中主要的胶质细胞,几乎贯穿分布于从内界膜到外界膜的视网膜感觉神经全层[9]。Müller细胞具有调节视网膜内酸碱平衡、参与视网膜细胞代谢、维持视网膜内谷氨酸平衡、传递神经信号及维持视网膜的完整性等重要的生理功能[10-11]。同时,Müller细胞参与多种视网膜病理过程[12]。因此,如何有效调节或维持Müller细胞的正常生理功能具有重要意义。
本研究参考文献方法[13]提取分离了兔Müller细胞。常规培养条件下发现细胞传代后贴壁生长,细胞呈长梭形、多角形、圆形等形态,细胞质丰富,细胞核呈圆形。这与文献报道的Müller细胞形态相一致[13]。免疫荧光实验发现,大部分细胞明显表达GFAP。Müller细胞属于胶质细胞,而GFAP为胶质细胞的重要标志物[9,14]。这些说明本研究成功提取分离出Müller细胞。进一步实验发现,0.1、1、10μmol/L Apelin-13处理24h后明显抑制缺氧诱导的Müller细胞活力下降,而1μmol/L Apelin-13的抑制效应最好,因此选取此浓度进行后续实验。研究显示,Apelin-13通过GLP-1R/PI3K/Akt信号抑制神经细胞凋亡,并减轻蛛网膜下腔出血后的早期脑损伤[6]。而Müller细胞凋亡可引起多种相关生理功能失调,最终诱发眼科疾病。本研究通过TUNEL染色观察了Apelin-13和Müller细胞凋亡的关系,结果发现Apelin-13可明显抑制缺氧诱导的Müller细胞凋亡,这与研究报道的Apelin-13作用相类似。YAP作为一种转录共激活因子,主要在Hippo通路下游发挥作用,可参与凋亡调控[8],因此本研究观察了YAP的变化。实验发现缺氧条件下Apelin-13可诱导Müller细胞p-YAP蛋白表达明显降低,并且还能诱导其上游信号蛋白p-LATS1蛋白表达下调。提示,p-YAP蛋白表达变化依赖于p-LATS1蛋白。研究已证实,当LATS1磷酸化后可引起下游效应物YAP磷酸化,最终使YAP核转位至细胞质中,从而使后者失去转录活性[15-17]。因此,本研究进一步采用免疫荧光技术验证缺氧条件下Apelin-13对YAP核表达的影响。实验发现,缺氧条件下,Apelin-13促进YAP的细胞核表达。这些提示,Apelin-13可能通过促进YAP入核从而抵抗缺氧诱导的Müller细胞凋亡。
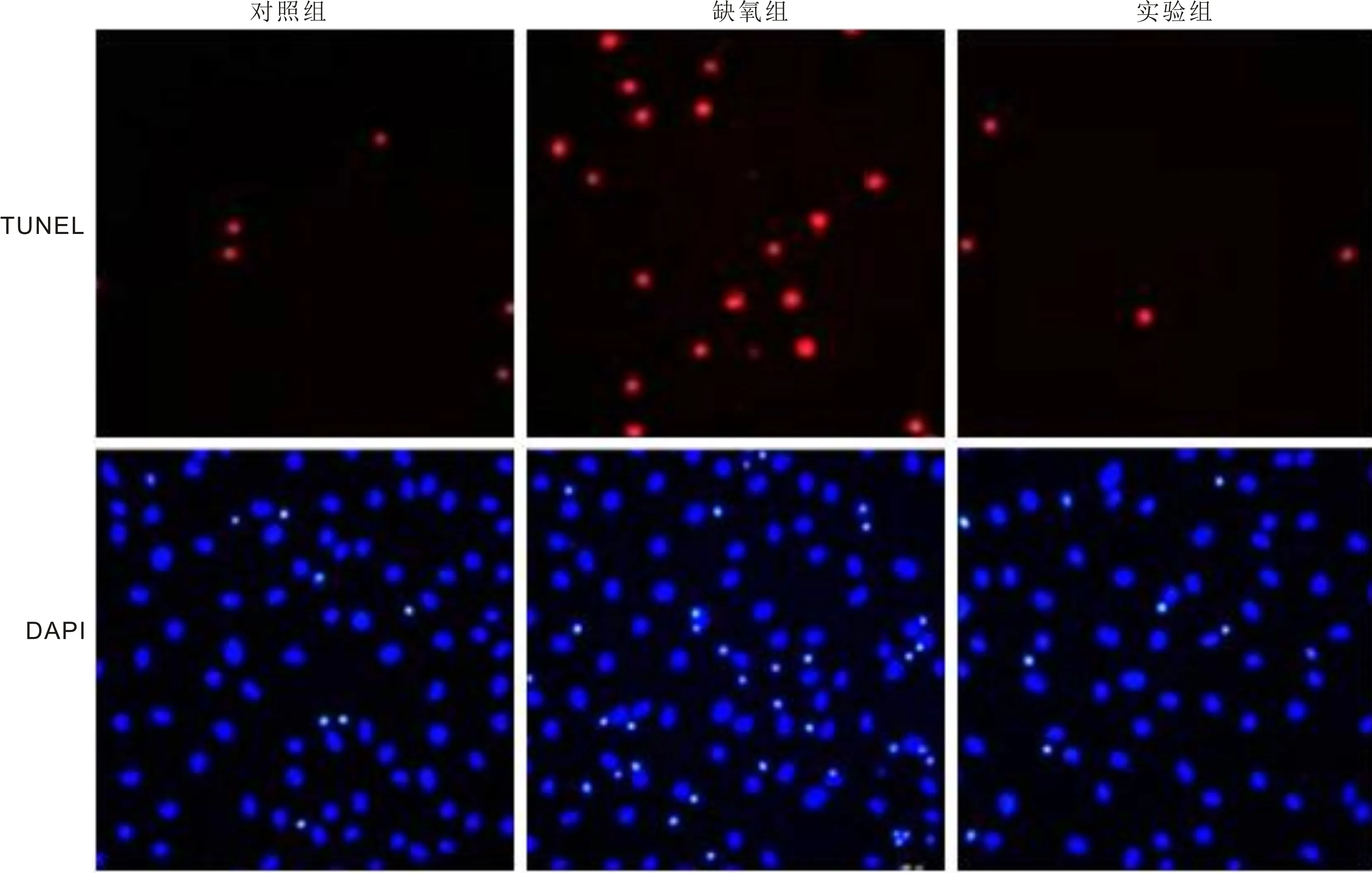
图3 各组Müller细胞TUNEL染色结果(×200)。

图4 各组蛋白表达变化bP<0.01vs缺氧组。

图5 Apelin-1对缺氧条件下Müller细胞YAP细胞核表达的影响(×400)。
YAP缺乏明显的DNA结合结构域,需要与转录因子结合,因此被认为是转录共激活因子调节下游基因的转录[18]。研究显示,YAP的活化可引起细胞增殖,同时抑制细胞凋亡[19]。本研究发现Apelin-13能抵抗缺氧诱导的Müller细胞凋亡,而该作用可能与促进YAP入核有关。但YAP调节的下游信号靶点还不明了,有待于进一步研究。
