不同颜色糙米多酚提取工艺优化及其酚类物质分析
2020-06-08姜忠丽满朝坤
姜忠丽, 满朝坤, 张 欢
(沈阳师范大学 粮食学院, 沈阳 110034)
0 引 言
糙米是营养丰富的全谷物之一,具有降低心脏病、心血管病、癌症等慢性疾病的作用[1-4],研究表明,这与谷物中的酚类物质有关,如酚酸、黄酮、香豆素、单宁、花青素等[5-8]。目前国内外关于有色稻米多酚的报道多为黑米、红米与普通米之间的比较,关于绿色米的研究报道很少[9-11],尚未检测出有关黑、紫、红、黄、绿5种颜色稻米的集中比较。本试验选取同一产地的5种颜色糙米,在前期试验基础上,采用响应面分析法得到超声酶解提取糙米多酚的最佳工艺,并采用HPLC法分析糙米中10种酚类物质的含量和组成,初步探索糙米多酚组成的品种间差异性。
1 材料与方法
1.1 材料与试剂
黑、红、绿、黄、紫糙米:购自陕西洋县;纤维素酶(≥6 000 U/mg);没食子酸、儿茶素、对羟基苯甲酸、绿原酸、咖啡酸、丁香酸、对香豆酸、阿魏酸、香豆素(色谱纯):购自南京源值生物有限公司(纯度≥98%);石油醚(沸程60~90 ℃);福林酚、磷酸、无水碳酸钠、柠檬酸、柠檬酸钠(分析纯);甲醇(色谱纯)。
1.2 仪器与设备
ESJ120-4B电子天平:沈阳龙腾电子有限公司;UV-1200S型紫外分光光度计:翱艺仪器(上海)有限公司;RRHP-200型万能粉碎机:欧凯莱芙宝业公司;DHG-9146A型电热恒温鼓风干燥箱:上海精宏实验设备有限公司;15A481超声清洗机:宁波新芝生物科技有限公司;Avanti J高效离心机:贝克曼库尔特商贸有限公司;SPD-16型高效液相色谱仪紫外-可见检测器:岛津仪器(苏州)有限公司。
1.3 超声酶解提取糙米多酚的工艺优化
1.3.1 标准曲线绘制
配置0.1 mg/mL的没食子酸标准液。分别吸取0、0.1、0.2、0.3、0.4、0.5 mL标准液,加入1 mL福林酚和2 mL的15%Na2CO3溶液,摇匀,定容,避光2 h后测760 nm处的吸光度。以没食子酸质量浓度和吸光度绘制标曲,得回归方程:
Y=0.109 3X+0.024 1,R2=0.999 4。
1.3.2 样品测定
以黑色糙米为工艺优化原料。将脱脂后的样品加入一定比例的纤维素酶和pH5.4的柠檬酸-柠檬酸钠缓冲液,超声提取后离心。取上清液0.5 mL,按标曲制作方法测定样品中总酚含量。按下式计算多酚提取量:
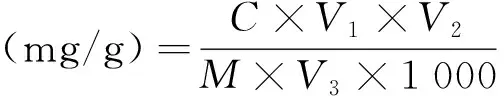
式中:C为样液中多酚质量浓度,(μg/mL);V1为稀释体积,mL;V2为样液体积,mL;V3为取样体积,mL;M为样品质量,g。
1.3.3 响应面试验
根据前期试验结果,以料液比、酶添加量、超声时间和超声功率为自变量,以多酚提取量为响应值,利用Box-Behnken设计原理进行四因素三水平的试验设计。试验因素和水平见表1。
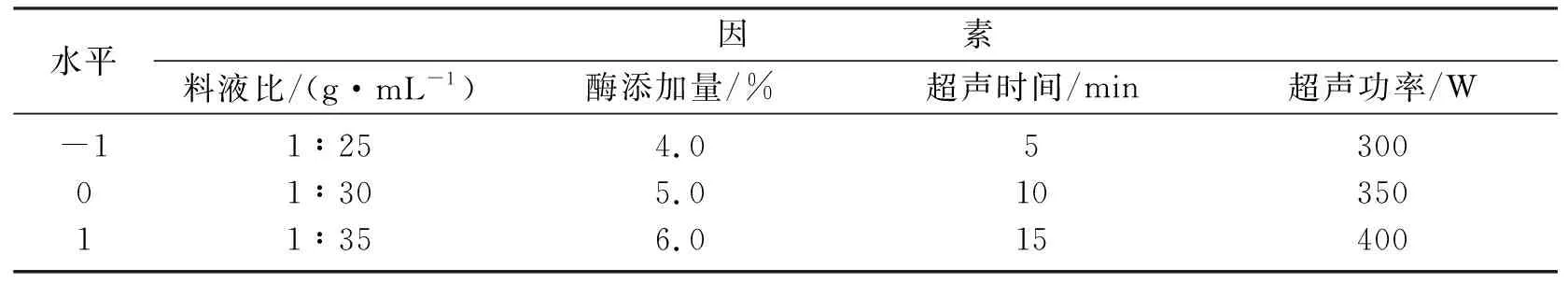
表1 响应面试验设计因素水平编码表Table 1 Horizontal coding table of response surface test design factors
1.4 HPLC法对糙米中10种酚类化合物含量的鉴定
1.4.1 混标及样品溶液的制备
配置2 mg/mL的10种标准品母液。分别吸取各母液6 μL混合并定容至10 mL,得1.2 μg/mL的混标溶液,将其稀释成0.1、0.2、0.4、0.8 μg/mL,冷冻保存。样品多酚的提取同1.3.2,将上清液冷冻保存。所有样品经0.45 μm微孔滤膜过滤后,作为待测液。
1.4.2 色谱条件
色谱柱:C18柱(250 mm×4.6 mm);紫外检测器,检测波长280 nm;流动相A(甲醇)∶B(0.2%磷酸水)=24∶76;流速1.0 mL/min;柱温35 ℃;进样量10 μL;检测时间40 min。
1.5 数据处理
所有数据均为5次重复试验的平均值,应用Microsoft Excel 97-2003、Design Expert.V8.0.6.1 和IBM SPSS Statistics 22软件进行数据处理分析。
2 结果与分析
2.1 响应面工艺优化试验
2.1.1 响应面试验方案及结果
以料液比、酶添加量、超声时间和超声功率为自变量,以糙米多酚提取量为响应值,进行四因素三水平的Box-Behnken优化试验。试验设计及结果如表2所示。
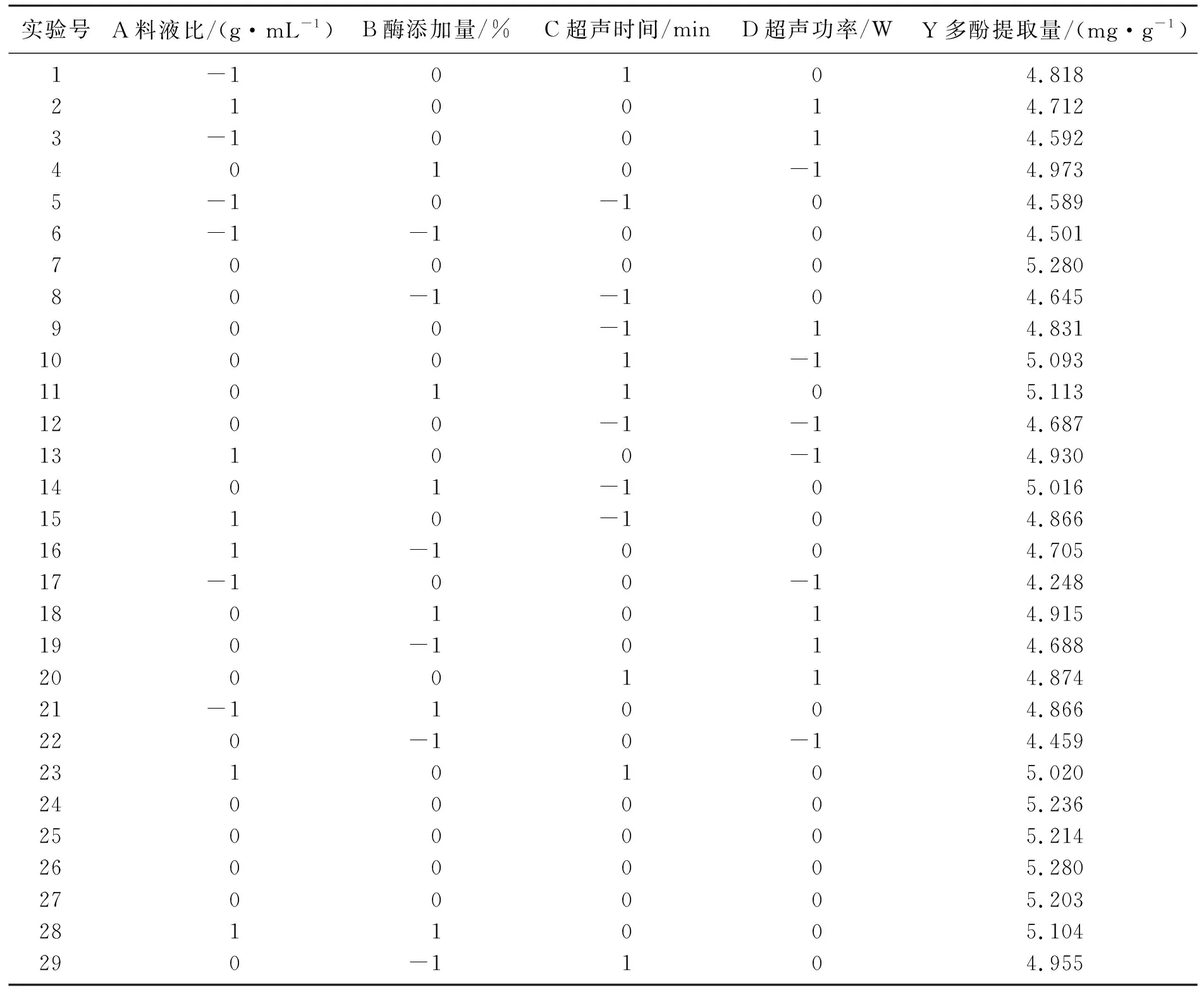
表2 Box-Behnken试验设计及结果Table 2 Box-behnken experimental design and results
2.1.2 模型建立与显著性分析
通过Design-Expert.V8.0.6.1软件对表2数据进行拟合,获得响应值与4个因素的二次多项式的回归模型如下:
为检验该模型的有效性,进行方差分析及显著性检验,结果见表3。
由表3知,因素A、B、C、A2、B2、C2、D2对响应值的影响极显著,且影响因素的大小顺序为:B>A>C>D。交互项AD的影响极显著,BD、CD表现为显著。从整体分析,该模型P值<0.000 1,表示极显著,失拟项P=0.101 4>0.05,不显著,表示模型可靠。R2=0.971 3,说明该模型与实际结果的拟合度良好。Radj2=0.942 6,说明该模型在94.26%的程度上可以用于解释试验结果[12]。
2.1.3 响应面优化分析
通过Design-Expert.V8.0.6.1软件获得各因素交互作用的响应面图,如图1所示。
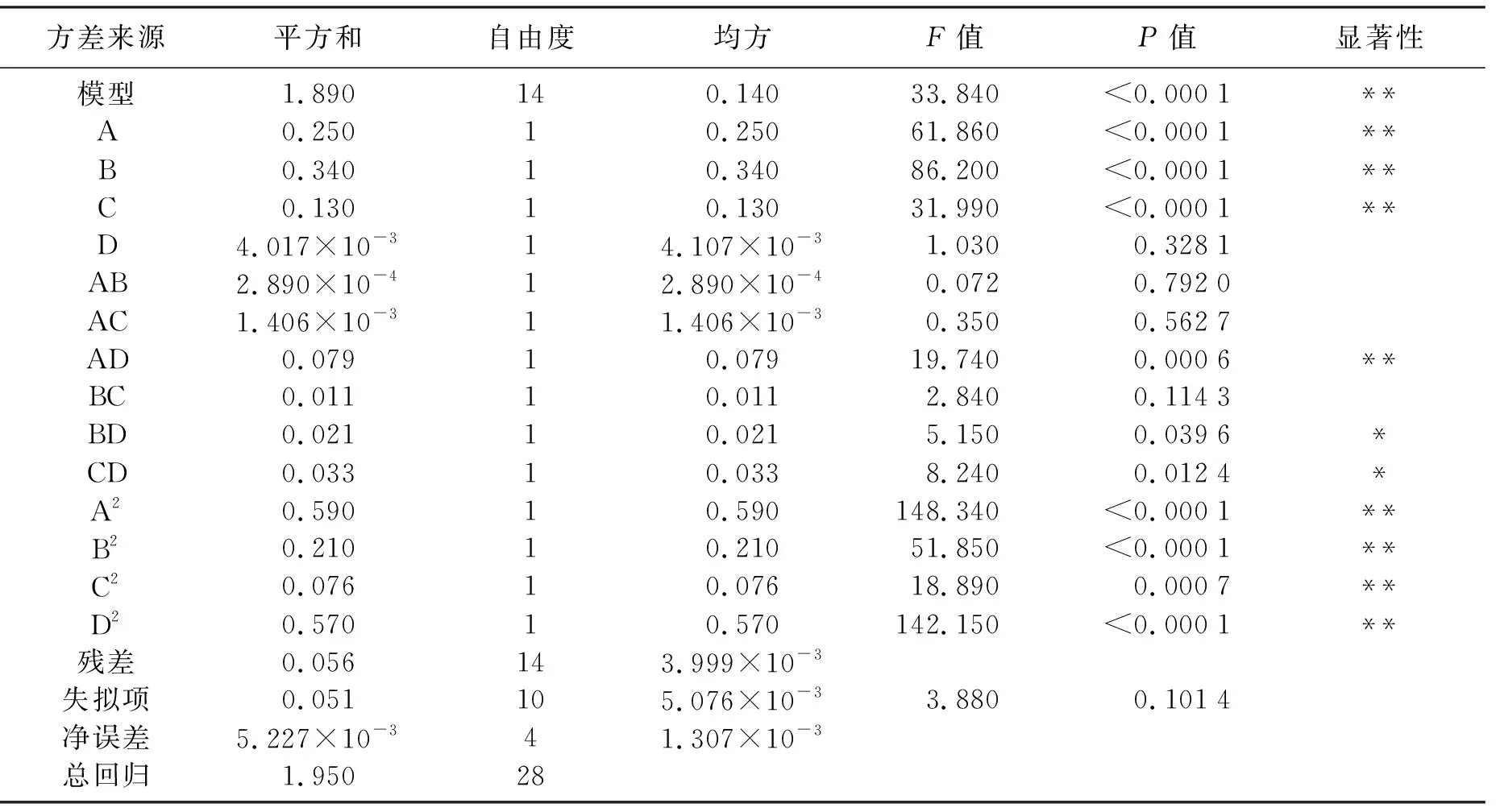
表3 回归模型方差分析表Table 3 Analysis of variance of regression model
注: **差异极显著(P≤0.01);*差异显著(P≤0.05)。
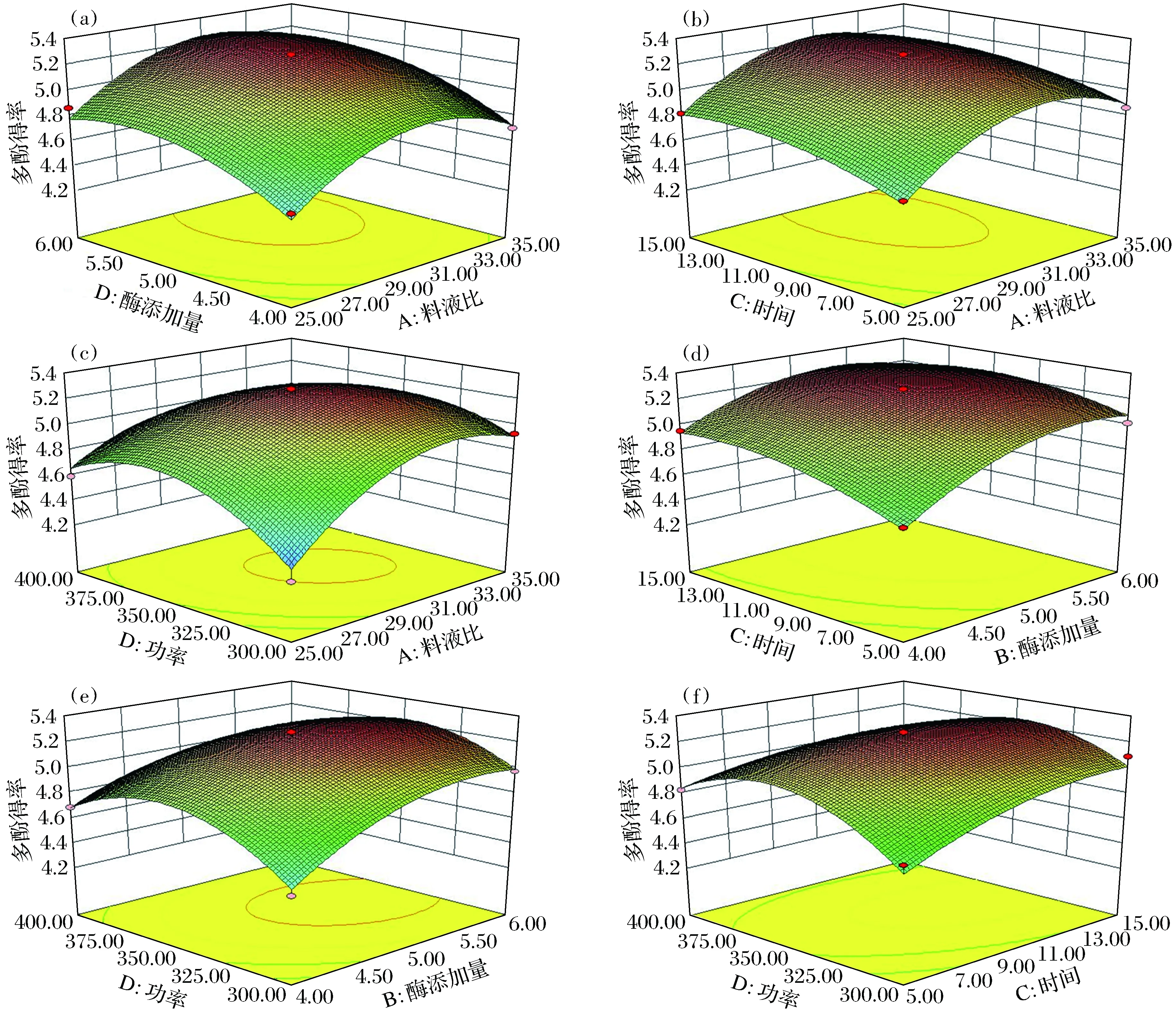
图1 各因素交互作用对多酚提取量的响Fig.1 Interaction of various factors on the extraction amount of polyphenols
由图1(a)知,料液比与酶添加量的交互作用不显著。料液比为1∶25时,随酶添加量的增加,多酚提取量先增加后趋于平稳。当料液比变化到1∶35时,提取量为先上升后下降。
由图1(b)知,料液比与时间的交互影响不显著。随时间延长多酚提取量先增加后略有降低,在10 min提取量最大。
由图1(c)知,料液比与功率的交互作用极显著。溶剂量与功率较小时,多酚提取量随溶剂和功率的增加而明显增加,当溶剂超过30 mL、功率大于350 W时,提取量下降。
由图1(d)知,酶添加量与时间的交互作用不显著。随着酶量增加和时间的延长,提取量先增加后变化不大,在5.0%酶用量和10 min时提取量最大。
由图1(e)知,酶添加量和功率间的交互作用显著。随着酶量、功率的增加,多酚提取量明显增加,在酶添加量5.0%、350 W时达到最大值,而后呈明显下降趋势。
由图1(f)知,超声时间与功率的交互作用显著。在时间和功率均较小时,提取量随之增大而明显提高,达到最大值后逐渐下降。
2.1.4 最佳工艺的优化
通过Design-Expert.V8.0.6.1软件得出黑糙米的最佳多酚提取工艺:料液比1∶31.33(g/mL)、酶添加量5.45%、超声时间12.03 min、超声功率342.54 W,预测值为5.319 mg/g。结合实际,将其调整为料液比1∶30(g/mL)、酶添加量5.5%、超声时间12 min、超声功率340 W,进行5次平行验证试验得到的实际平均提取量5.318 mg/g。
2.1.5 不同颜色糙米的总酚含量
经过试验,表明黑色糙米多酚的最佳提取工艺亦适合其他4种糙米。对所有样品进行多酚提取及含量测定,得到5种颜色糙米的总酚含量为:黑色5.318 mg/g>紫色3.892 mg/g>红色3.874 mg/g>黄色3.425 mg/g>绿色3.136 mg/g,说明糙米颜色越深,其多酚含量越高。
2.2 HPLC分析检测结果
2.2.1 色谱分离效果
对2.1.5得到的糙米多酚提取液进行HPLC分析。标准品和样品的色谱图如图2所示。
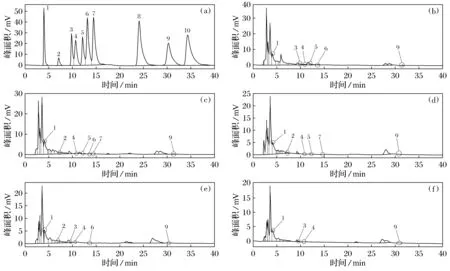
注: 1—没食子酸; 2—儿茶素; 3—对羟基苯甲酸; 4—绿原酸; 5—香草酸;6—咖啡酸; 7—丁香酸; 8—对香豆酸; 9—阿魏酸; 10—香豆素
图2(a)~图2(f)分别为混标溶液、黑糙米、紫糙米、红糙米、黄糙米和绿糙米的液相色谱图。由图2(a)可知,该色谱条件下10种多酚化合物能较好分离且峰形良好。以标准品质量浓度(μg/mL)为横坐标,峰面积(mV)为纵坐标,绘制标准曲线。得到10种酚类化合物的回归方程及线性关系如表4所示。
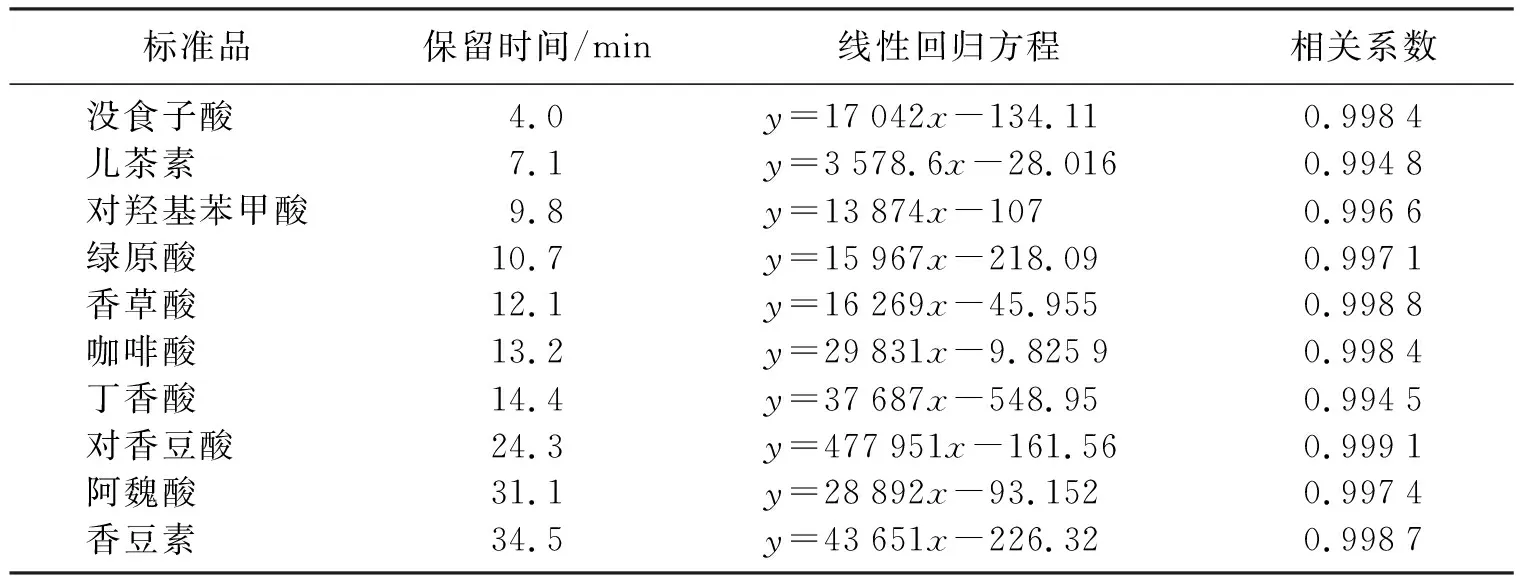
表4 线性回归方程及相关系数Table 4 Linear regression equation and correlation coefficient
2.2.2 精密度试验
将同一混标溶液按色谱条件进样3次,连续测定5d,按出峰时间记录10种酚类化合物的峰面积,测得日内RSD分别为0.56%、1.20%、1.01%、1.51%、0.93%、1.41%、1.04%、1.44%、1.30%和0.90%,日间RSD分别为0.43%、0.77%、1.77%、1.04%、3.14%、1.52%、2.73%、0.71%、6.04%、2.87%,均小于10%,表明该色谱条件精密度良好,符合测定要求。
2.2.3 稳定性试验
将待测样品溶液分别在0、2、4、6、8h按色谱条件进样分析,记录峰面积,测得10种酚类化合物的RSD按出峰顺序分别为8.37%、6.85%、4.34%、4.95%、6.86%、5.15%、5.68%、0(未检测出,下同)、6.34%、0,均小于10%,样品在8h内稳定性良好,可以进行定量分析。
2.2.4 回收率试验
以黑色糙米为回收试验样品。在已知浓度的样品中加入一定量的混标溶液,按色谱方法重复5次进样分析,计算加标回收率和RSD值,如表5所示,10种标准品的回收率在83.67%~100.17%,RSD值在1.39%~7.71%,说明回收率较高,结果较准确。
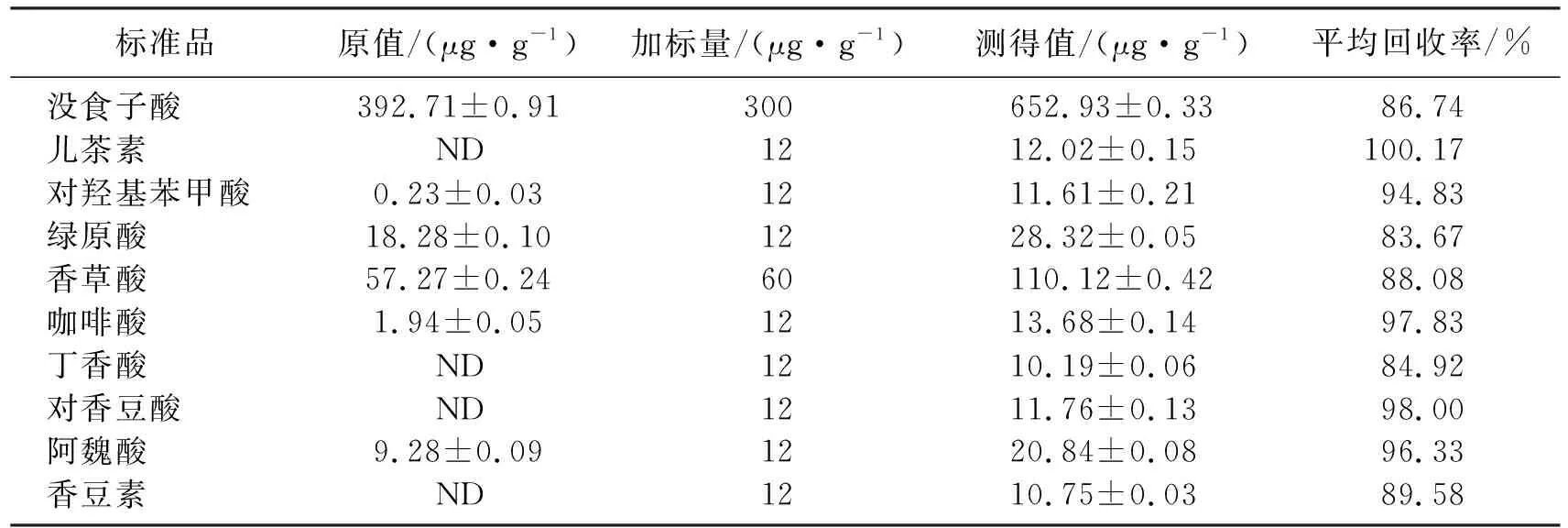
表5 回收率试验结果Table 5 Results of recovery test
注: ND表示未检测出。下同。
2.2.5 样品测定
样品图见图2(b)~图2(f),可明显看出总峰面积、出峰数量与糙米颜色呈正相关。各酚酸含量计算结果见表6。5种糙米中均含有没食子酸、绿原酸和阿魏酸,且没食子酸含量显著高于其他9种酚酸含量,范围在202.7~392.71 μg/g。儿茶素含量在红色、紫色和黄色糙米中较高,范围在94.92~151.56 μg/g,在黑色和绿色糙米中未检测到。香草酸主要存在于黑色和紫色糙米中。咖啡酸和丁香酸在糙米样品中含量较少。对香豆酸和香豆素在5种糙米中均未检测出。可知对于所检10种酚酸化合物,不同颜色糙米含量各不相同,多酚组成和含量与糙米品种间存在显著性差异。
本试验结果与一些研究者的研究结果类似,总酚含量表现为黑米>红米>普通大米[13-15],与Rao S等[16]的研究结果中红色米多酚含量>紫色>黑色不同,这可能是与不同生长条件、栽培技术、提取工艺等因素有关[7],有待进一步研究。
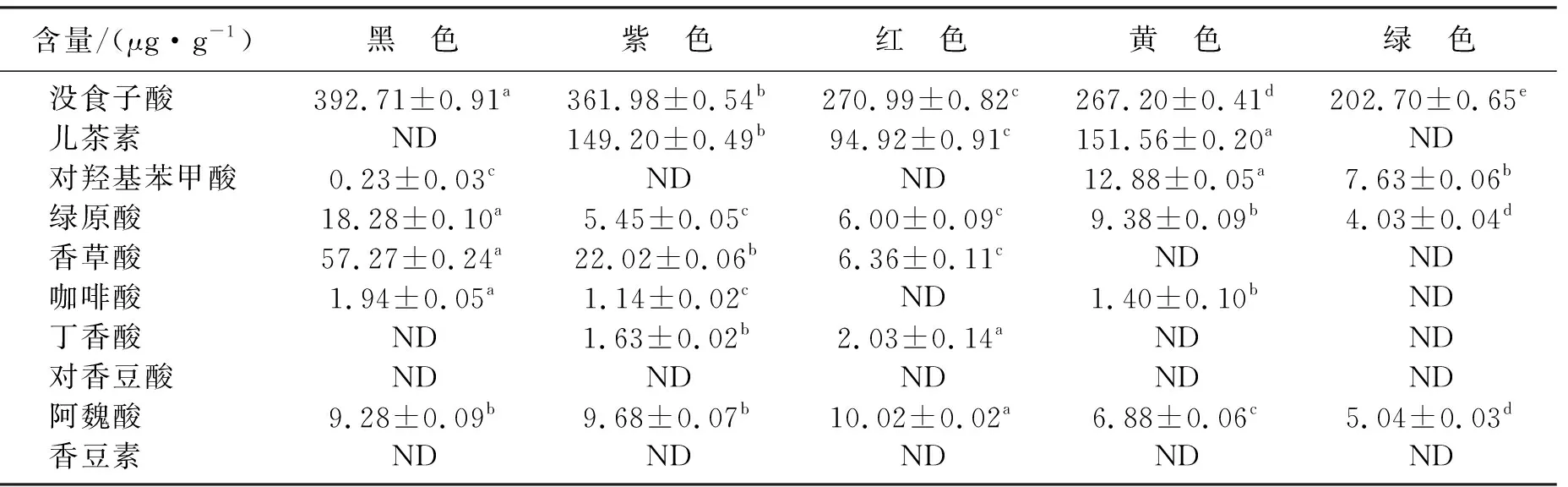
表6 不同颜色糙米中酚类物质含量Table 6 Contents of phenols in brown rice with different colors
注: 同一列内不同小写字母表示差异显著性在5%水平(P<0.05)。
3 结 论
本试验超声酶解法提取糙米多酚的最佳工艺为:料液比1∶30(g/mL)、酶添加量5.5%、超声时间12 min、超声功率340 W、超声温度55 ℃,方差分析及显著性检验表明该回归模型有效。得到5种糙米的总酚含量大小依次为黑色5.318 mg/g>紫色3.892 mg/g>红色3.874 mg/g>黄色3.425 mg/g>绿色3.136 mg/g,且多酚含量与糙米颜色之间呈正相关。HPLC法结果表明,不同颜色糙米的酚类物质组成和含量各不相同。黑色糙米以没食子酸、香草酸和绿原酸为主;紫色和红色糙米以没食子酸、儿茶素、香草酸和阿魏酸为主;黄色糙米以没食子酸、儿茶素、对羟基苯甲酸为主;绿色糙米主要含没食子酸,对羟基苯甲酸、绿原酸和阿魏酸含量较少,其余酚酸均未检测出,可知绿色糙米的酚酸组成最简单,含量也最少。此外SPSS分析结果表明5种糙米样品的酚酸组成及含量之间具有不同程度的差异性。
