ASPM基因在乳腺癌中的表达及临床意义
2020-06-08吕珊妹徐文杰王艺臻董学君
吕珊妹 徐文杰 王艺臻 董学君
乳腺癌是全球女性癌症死亡的主要原因[1, 2]。尽管手术结合放化疗的诊疗手段取得了一定的提高,但其预后不良的情况并未改善[3,4]。因此,从分子水平深入研究乳腺癌潜在的发生、发展机制,对延长乳腺癌患者的生存时间具有重要意义。细胞有丝分裂相关基因ASPM (abnormal spindle microtubule assembly)位于1号染色体,编码3477个氨基酸残基组成的蛋白质,在正常细胞有丝分裂过程中发挥纺锤体功能是必不可少的[5, 6]。近年来研究发现,ASPM在多种癌症中异常表达,且与肝癌、卵巢癌、胰腺癌和前列腺癌等多种肿瘤的不良预后显著相关[6~9]。然而,ASPM参与癌症进展的机制尚不明确,并且其在乳腺癌中的表达和作用机制的研究较少。为深入研究ASPM与乳腺癌的相关性,本研究使用Oncomine在线数据库分析ASPM在乳腺癌中的表达水平,并利用GEO (gene expression omnibus)和TCGA (the cancer genome atlas)公共数据库中的乳腺癌基因芯片数据,探讨ASPM与乳腺癌患者临床病理指标的相关性及其对预后的影响。通过基因富集分析 (gene sets enrichment analysis, GSEA)、String以及TIMER数据库进一步预测ASPM在乳腺癌发生、发展中可能参与的信号通路及作用机制。同时RT-qPCR验证ASPM在乳腺癌临床组织样本中的表达情况。
材料与方法
1.ASPM表达量分析:利用Oncomine数据库 (https://www.oncomine.org/resource/login.html) 分析ASPM在乳腺癌组织中的表达情况。以正常组织为对照,选择差异表达倍数大于2倍、基因排位于前10%且P=0.000的结果,选择箱式图展现结果。本研究设置的筛选条件:①Gene:ASPM;②Analysis Type:cancer vs normal analysis;③Cancer Type:breast cancer;④Data Type:mRNA;⑤Sample Type:Clinical Specimen。
2.ASPM与乳腺癌患者临床资料相关性分析:在美国国立生物技术信息中心 (National Center for Biotechnology Information, NCBI)上的GEO公共数据库 (https://www.ncbi.nlm.nih.gov/geo/)中下载乳腺癌基因表达谱数据集GSE3494的系列矩阵数据文件,以获得表达原始数据和临床资料。GSE3494采用的平台是Affymetrix公司的GPL96基因表达芯片 (Affymetrix Human Genome U133A Array),包含251例乳腺癌样本及对应的临床信息。从TCGA公共数据库 (https://cancergenome.nih.gov/)中共下载1090例乳腺癌组织样本,排除目的基因表达值和临床信息缺失的病例。根据ASPM表达值的中位数分为高表达组和低表达组,χ2检验分析ASPM表达与临床病理指标的相关性。GSE3494数据库中采用Kaplan-Meier法分析ASPM表达与乳腺癌患者预后的关系。采用Kaplan-MeierPlotter在线数据库选取乳腺癌页面,分析ASPM表达与乳腺癌患者总生存期的关系。
3.基因富集分析:官方网站(http://software.broadinstitute.org/gsea/index.jsp) 下载GSEA 2.2.4版本并按照其运行说明进行GSEA分析。将GSE3494数据集中的乳腺癌样本根据ASPM (219918_s_at)表达值的中位数分为ASPM高表达组和ASPM低表达组。选择MsigDB数据库的KEGG基因集 (c2.cp.kegg.v6.0.symbols.gmt)作为参照基因集,按缺省加权富集统计的方法,设置随机组合次数为1000次,错误发现率 (FDR)<0.25以及P<0.05,预测高表达ASPM富集的基因集,探究ASPM可能参与的信号通路机制研究。
4.蛋白质相互作用网络分析:STRING数据库 (https://string-db.org/)是一个包含2031种物种和960万种蛋白质的在线数据库,利用该数据库可分析蛋白质之间的相互作用,结合基因富集分析结果,进一步分析乳腺癌中ASPM相关蛋白的相互作用。
5.TIMER数据库分析:利用TIMER数据库(https://cistrome.shinyapps.io/timer/),对ASPM在乳腺癌组织中的表达与BUB1、CCNA2、CDC20C、CDK1、DLGAP5C、KIF11C、KIF23、NCAPG、TTK的表达进行Spearman相关性分析。本研究设置的筛选条件:①Cancer Type:breast invasive carcinoma,共1093例;②gene symbols (Y-axis):ASPM;③gene symbols (X-axis):BUB1、CCNA2、CDC20C、CDK1、DLGAP5C、KIF11C、KIF23、NCAPG、TTK;④correlation adjusted by:tumor purity。
6.RT-qPCR:采用Trizol 法提取乳腺癌组织样本总RNA,使用TaKaRa One Step SYBR PrimeScriptTMRT-PCR Kit Ⅱ进行PCR扩增,反应条件为: 42℃ 5min, 95℃ 10s (反转录);95℃ 5s,60℃ 20s,40个循环(PCR反应);95℃ 0s,65℃ 15s,95℃ 0s (溶解曲线分析)。以β-actin为内参,用2-△△Cq法计算ASPM mRNA的相对表达量。PCR引物序列如下:ASPM上游引物:5′-TCCGAAGTTGTAATCGCAGT-3′,下游引物: 5′-GTTGCAGGGGATTTGTGATT-3′; β-actin上游引物:5′-CATGTACGTTGCTATCCAGGC-3′,下游引物:5′-CTCCTTAATGTCACGCAC-GAT-3′。

结 果
1.乳腺癌组织中ASPM的表达情况:Oncomine数据库显示,与正常乳腺组织比较,ASPM基因在乳腺癌组织中高表达,共有9个数据库,2880个样本。在TCGA Breast芯片包含的6个子数据库中,ASPM在乳腺癌组织中的表达分别是正常乳腺组织的9.248、7.378、9.379、8.673、6.466、7.590倍 (P<0.01,图1)。
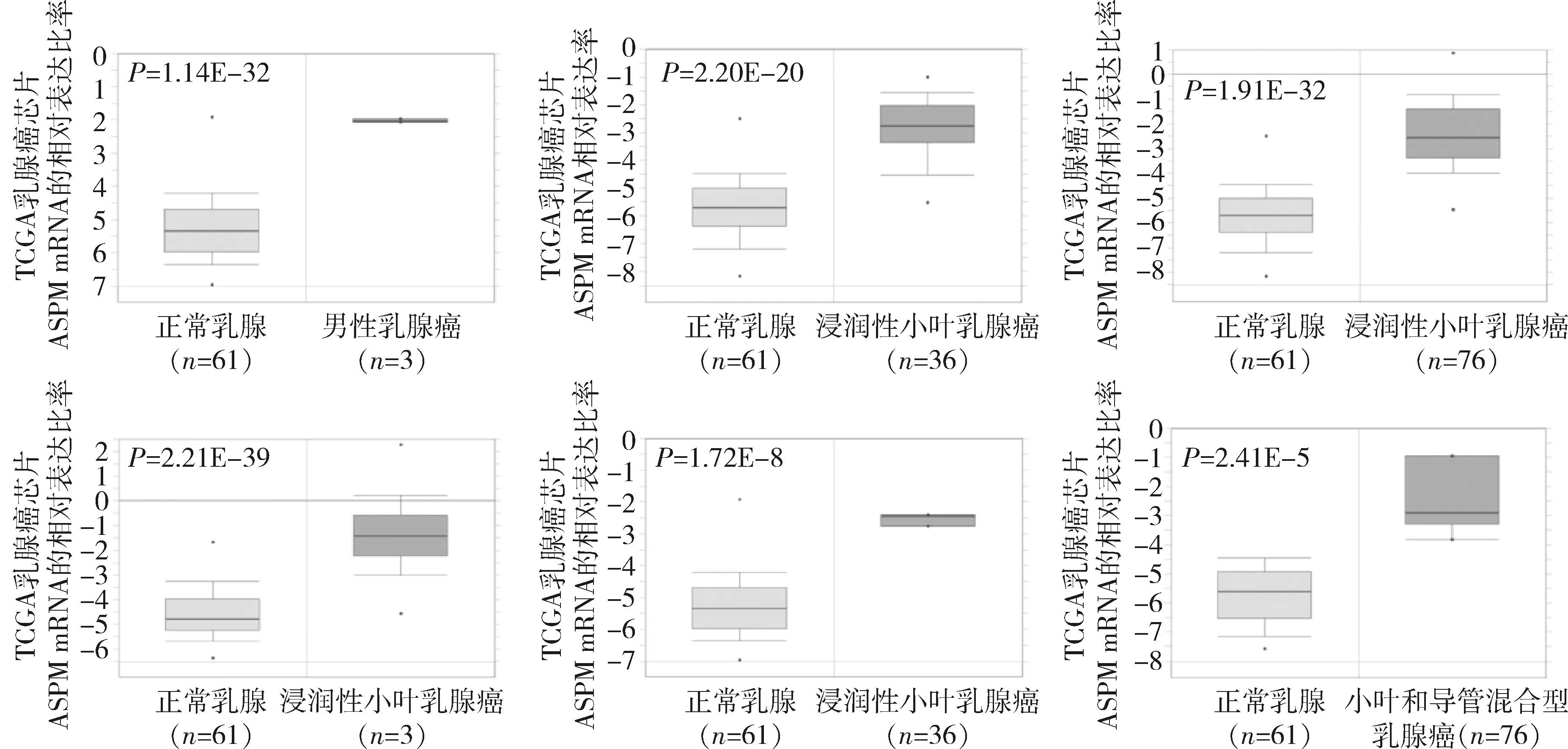
图1 Oncomine子数据库中ASPM mRNA在正常乳腺组织和乳腺癌组织中的表达
2.乳腺癌组织中ASPM表达与临床病理指标的相关性:本研究利用TCGA数据库中1090例乳腺癌患者 (表1)和GSE3494数据集中251例乳腺癌患者 (表2)的ASPM mRNA相对表达量及临床随访资料,研究ASPM表达与乳腺癌临床病理指标的相关性。在两个数据库中,ASPM表达均与ER、PR水平 (P=0.000)显著相关,在TCGA数据库中ASPM表达还跟年龄 (P=0.002)以及TNM分期中的T分期 (P=0.000)和N分期 (P=0.030)显著相关。GSE3494数据集分析结果显示,ASPM还与肿瘤直径(P=0.000)和淋巴结浸润 (P=0.012)显著相关。
3.ASPM表达与乳腺癌患者预后的关系:本研究利用GSE3494数据集 (251例乳腺癌患者)和Kaplan-MeierPlotter在线数据库分析乳腺癌组织ASPM表达与预后的关系。GSE3494数据集生存分析结果为Log-Rank=9.821,P=0.002 (图2A);Kaplan-MeierPlotter在线数据库结果为HR=1.71, 95%CI: 1.38~2.13,P=0.000(图2B),ASPM高表达乳腺癌患者总体生存率短于低表达患者,差异有统计学意义。

表1 ASPM与乳腺癌患者 (GSE3494)的临床病理指标的相关性
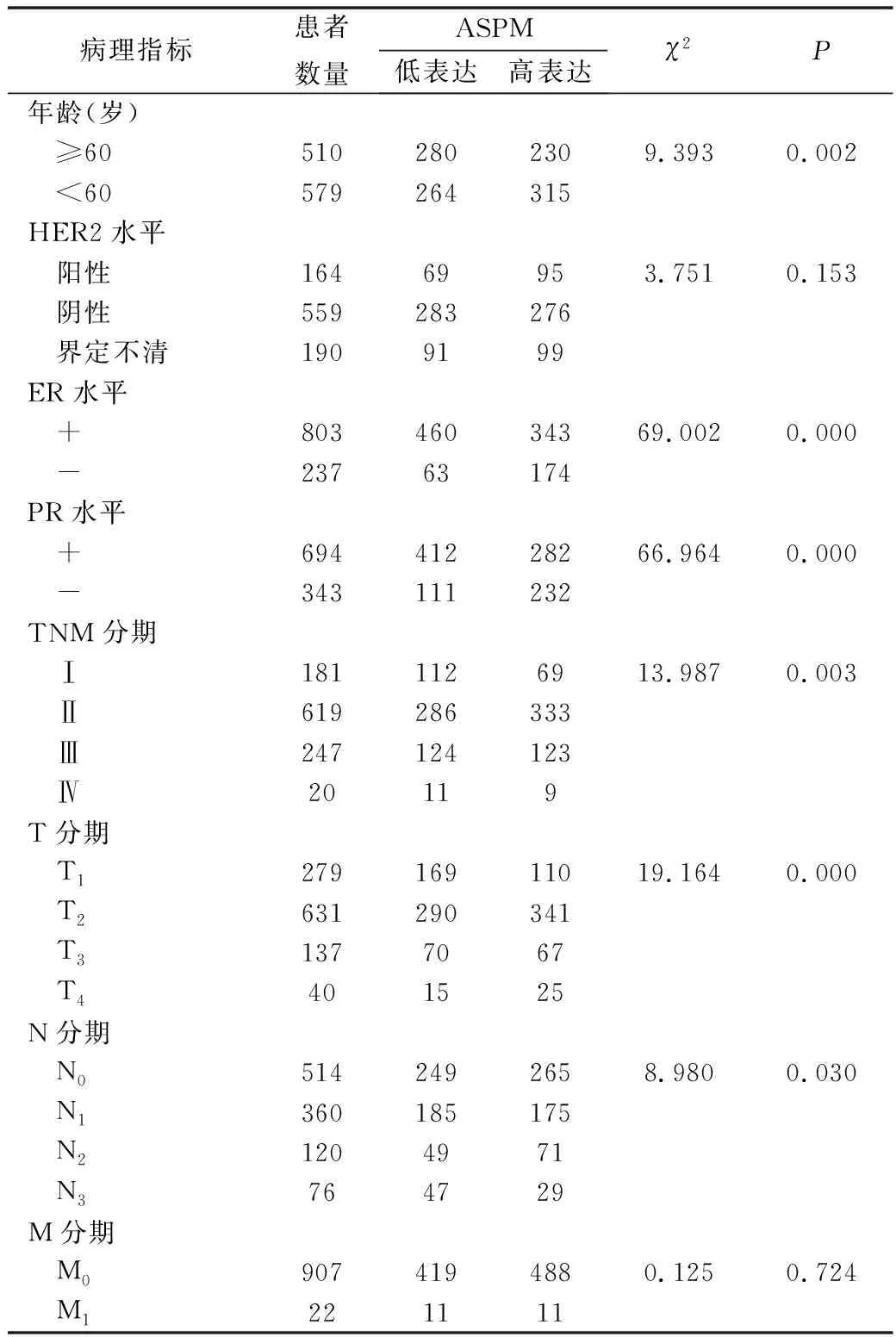
表2 ASPM与乳腺癌患者 (TCGA)的临床病理指标的相关性
4.ASPM高表达的基因集富集分析:本研究在明确ASPM基因与乳腺癌多个临床病理指标及预后的相关性后,进一步分析ASPM基因促进乳腺癌发生、发展的作用机制。将GSE3494数据集中的251个乳腺癌样本按照ASPM (219918_s_at)表达值的中位数分为ASPM高表达组 (n=126)和ASPM低表达组 (n=125),选用 MsigDB 数据库中的KEGG基因集作为参照基因集进行GSEA分析。ASPM高表达组乳腺癌样本主要富集在细胞周期 (图3A)、氧化磷酸化 (图3B)、DNA修复 (图3C)、错配修复 (图3D)、剪接体 (图3E)和蛋白酶体 (图3F)基因集。
5.与ASPM相关蛋白的分析:本研究通过STRING在线数据库分析ASPM蛋白的相互作用,发现多个蛋白与ASPM相互作用,其中包括BUB1、CENPE、KIF23、KIF11、DLGAP5、CCNA2、NCAPG、TTK、CDC20、CDK1 (图4)。结合GSEA分析结果,在细胞周期中, BUB1、CCNA2、TTK、CDC20、CDK1这些相关蛋白与ASPM表达上调有关。同时,在TIMER数据库中相关性分析显示,乳腺癌组织中ASPM与BUB1 (r=0.878,P=4.62e-320,图5A)、CCNA2 (r=0.848,P=3.11e-275,图5B)、TTK (r=0.851,P=3.08e-279,图5C) 都具有强相关性,与CDC20 (r=0.683,P=1.62e-137,图5D)和CDK1 (r=0.774,P=2.27e-199,图5E)也有一定的相关性。
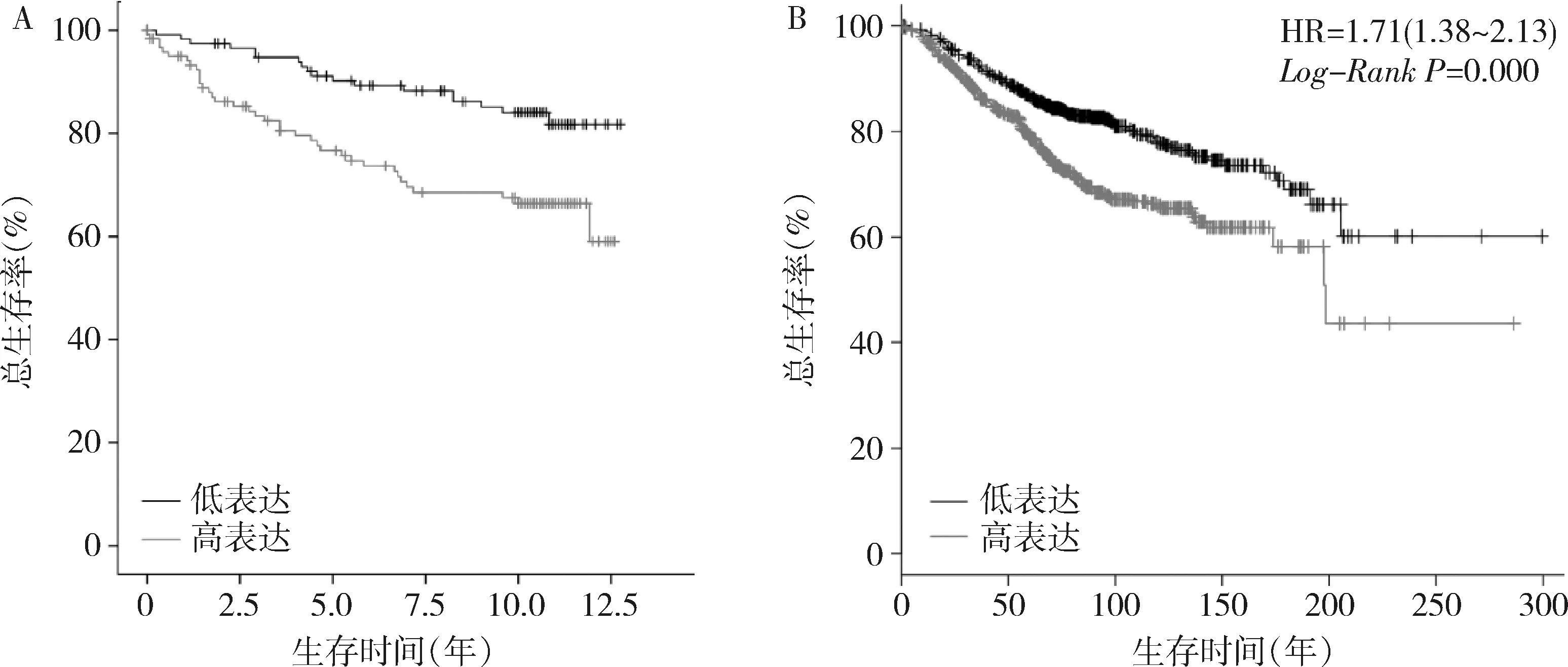
图2 Kaplan-Meier法分析ASPM表达水平与乳腺癌预后的相关性A.GSE3494数据集;B.Kaplan-Meier Plotter在线数据库
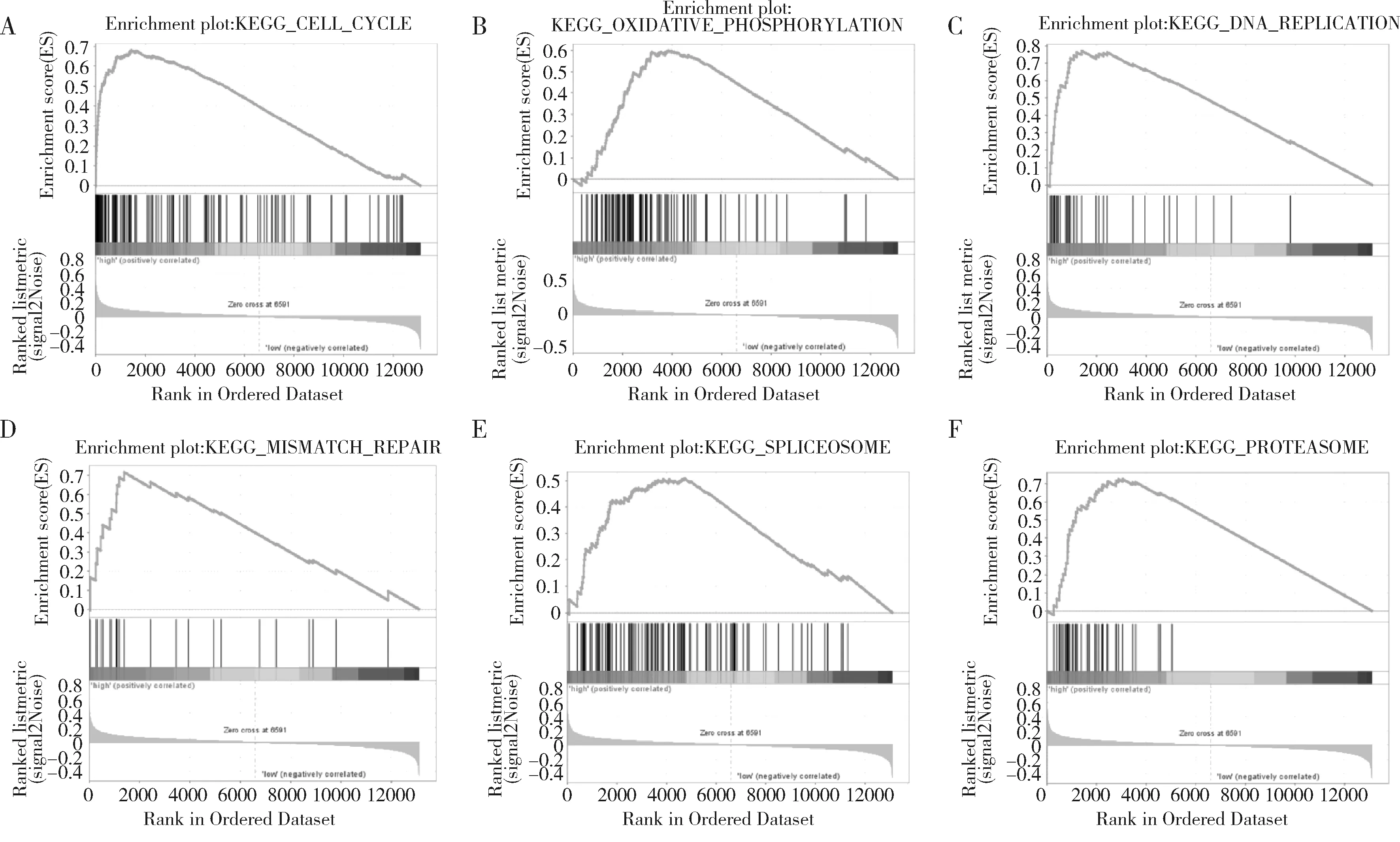
图3 GSEA分析ASPM高表达的乳腺癌样本富集基因集A.细胞周期 (P=0.000;FDR=0.003;ES=0.68);B.氧化磷酸化 (P=0.002;FDR=0.004; ES=0.60);C.DNA修复 (P=0.000;FDR=0.003;ES=0.77);D.错配修复 (P=0.000;FDR=0.008;ES=0.71);E.剪接体 (P=0.010;FDR=0.008;ES=0.51);F.蛋白酶体 (P=0.000;FDR=0.007;ES=0.73)
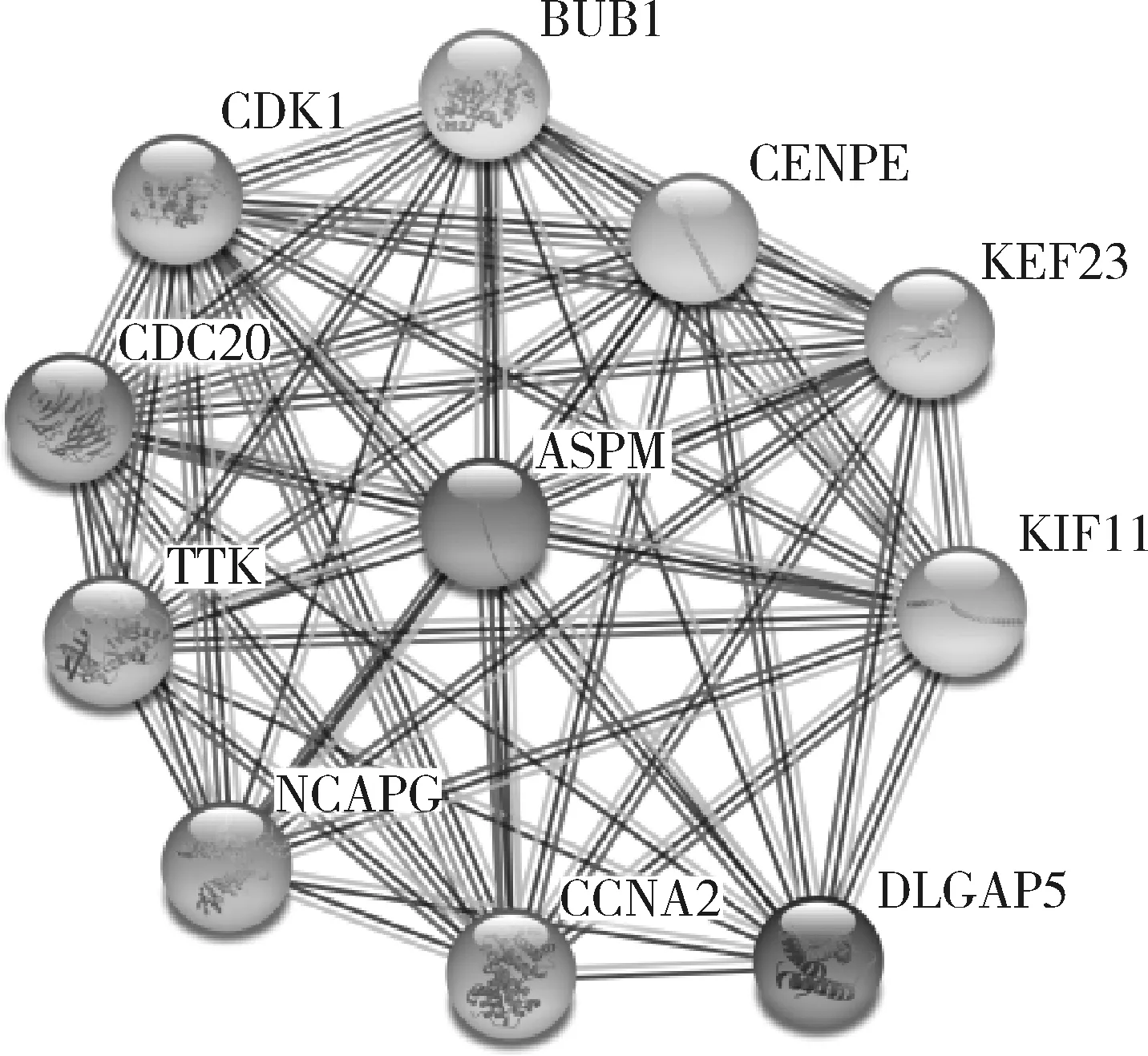
图4 String数据库中与ASPM相互作用的蛋白质
6.RT-qPCR验证ASPM mRNA在乳腺癌组织中的表达:本研究通过RT-qPCR检测了13对乳腺癌及癌旁组织中ASPM的mRNA表达情况,结果显示乳腺癌病灶组织中ASPM的表达水平显著高于其配对的癌旁组织,差异有统计学意义 (P<0.01, 图6),与Oncomine数据库的分析结果一致。
讨 论
ASPM位于人类染色体1q31,编码由3477个氨基酸残基组成的蛋白质,在维持有丝分裂纺锤体功能的过程中发挥重要作用,与肿瘤的发生、发展密切相关[5]。ASPM基因可能参与了DNA损伤修复的相关过程,该基因的缺失会影响细胞有丝分裂、分裂方向和分化方式,造成DNA损伤增加和细胞凋亡[10]。最新的研究表明,ASPM在胶质母细胞瘤和恶性胶质瘤中过表达,干扰ASPM表达可以减少肿瘤细胞和神经干细胞的增殖[11~13]。ASPM与肝细胞癌、卵巢癌、胰腺癌和前列腺癌的预后不良显著相关[14]。上述研究均提示,ASPM异常表达与癌症进展密切相关,然而ASPM表达与乳腺癌临床指标的相关性及预后的研究仍较为缺乏。
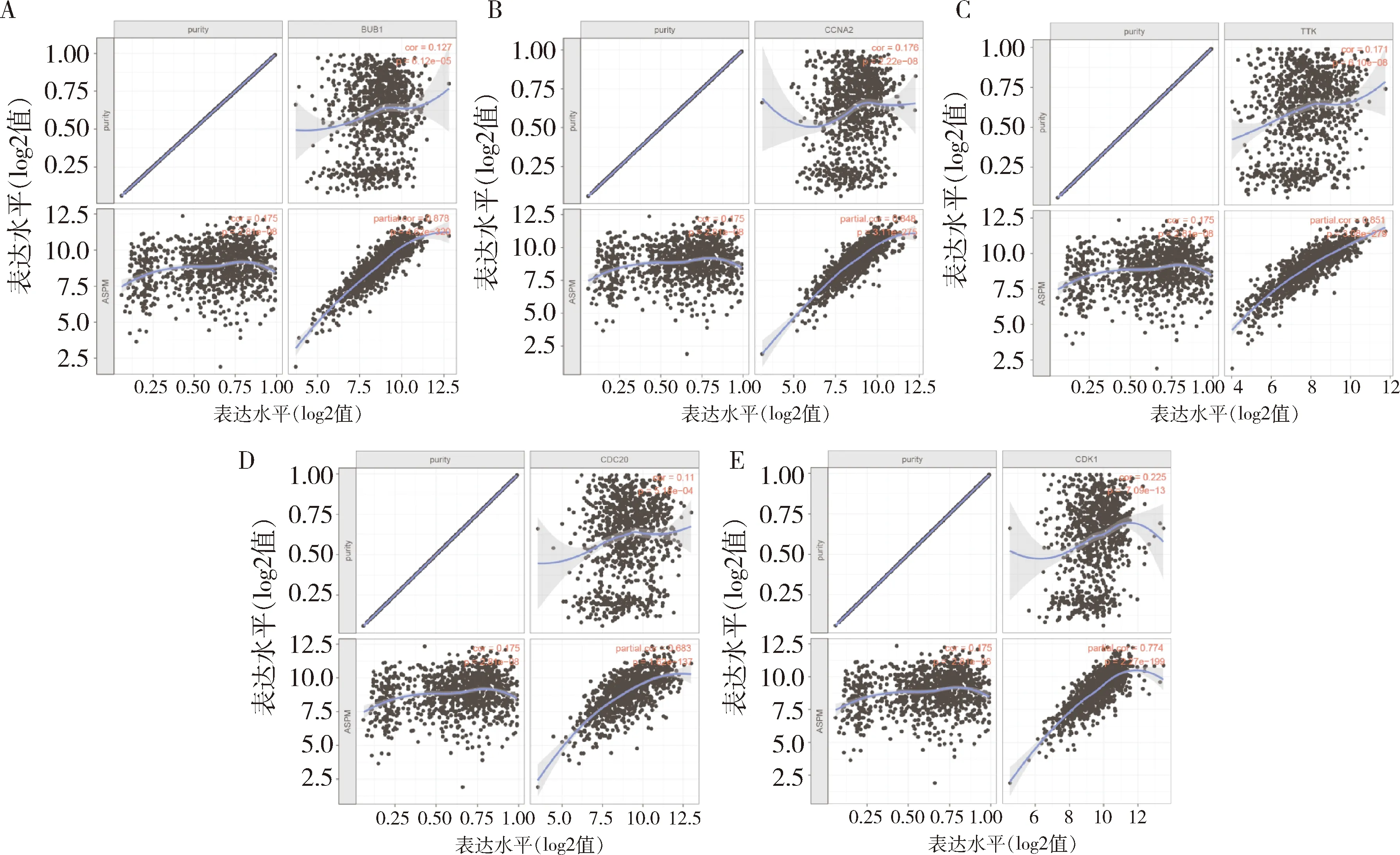
图5 TIMER数据库进行Spearman相关性分析A.ASPM与BUB1的相关性 (r=0.878,P=4.62e-320);B.ASPM与CCNA2的相关性 (r=0.848,P=3.11e-275);C.ASPM与TTK的相关性 (r=0.851,P=3.08e-279);D.ASPM与 CDC20的相关性 (r=0.683,P=1.62e-137);E.ASPM与CDK1的相关性 (r=0.774, P=2.27e-199)
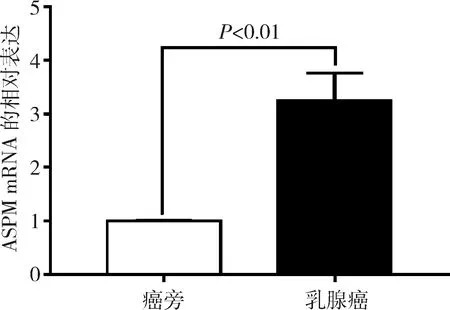
图6 RT-qPCR验证ASPM在13对乳腺癌配对组织中mRNA的表达
本研究首先利用Oncomine数据库分析发现,与正常的乳腺组织比较,ASPM在乳腺癌组织中的表达异常升高。进一步对收集的乳腺癌配对组织进行RT-qPCR检测,发现与配对的癌旁组织比较,ASPM的mRNA水平在乳腺癌组织中显著上调。通过GSE3494数据集和TCGA数据库中临床资料完整的乳腺癌样本,回顾性分析发现,ASPM与多项临床指标显著相关。在两个数据库中均发现ASPM与ER水平、PR水平显著相关 (P=0.000)。ASPM与年龄仅在TCGA数据库中显著相关 (P=0.002),可能是TCGA数据库包含有1090例乳腺癌患者,而GSE3494只含有251例,样本量不够大。此外,在GSE3494数据集中,ASPM与肿瘤直径、淋巴结浸润显著相关 (P=0.000);在TCGA数据库中,ASPM与TNM分期中的T分期 (P=0.000)、N分期 (P=0.03)显著相关,与M分期 (P=0.724)无相关性,提示ASPM在乳腺癌的发生、发展中可能发挥癌基因的作用。通过GSE3494数据集中的乳腺癌患者的临床随访数据资料,发现ASPM高表达的乳腺癌患者预后较差。Kaplan-MeierPlotter在线数据库也证实了ASPM高表达患者的总体生存率显著低于ASPM低表达患者。这些结果提示ASPM表达水平升高与预后不佳有关,可作为乳腺癌预后评估的临床指标。
本研究进一步利用GSE3494数据集的251例乳腺癌样本进行基因富集分析,发现ASPM高表达与细胞周期、氧化磷酸化、DNA修复、错配修复、剪接体和蛋白酶体等基因集关系密切。多数肿瘤细胞常表现出染色体的改变,包括缺失、易位和多倍体等[15]。细胞周期是细胞增殖过程中的主要步骤,肿瘤的发生都有一个共同特征即细胞周期调控机制紊乱。而ASPM与细胞周期过程中的纺锤体功能密切相关,影响着细胞周期的进展,从而影响细胞的增殖[16]。ASPM还能与Cdk2/Cyclin E复合物相互作用,通过调节其泛素化、磷酸化和在细胞核内的定位来调节细胞周期蛋白的活性[17]。胃癌的起源细胞,缺乏特定的生物学标志物,唯一表达的转录因子E2F1,可以参与干细胞的自我更新和胃癌发展,其与ASPM密切相关,共同参与了关键细胞的调控机制,故ASPM可作为胃癌干细胞生物学标志物[18]。ASPM可以通过增强Wnt-β-catenin信号通路维持前列腺癌细胞的干性特征[19]。这些结果提示ASPM可能通过调节乳腺癌细胞的细胞周期及癌细胞的干性,影响乳腺癌的增殖能力,从而促进乳腺癌细胞的发生、发展。
综上所述,通过GSE3494数据库和TCGA数据库的分析,发现ASPM与乳腺癌多个病理指标有关,可以通过多种途径来促进肿瘤的进展,从而影响患者的临床预后水平,其有望成为预警乳腺癌不良预后的生物学标志物。然而,其促进肿瘤发生、发展的具体机制仍需要开展进一步研究。
