尿白蛋白/尿肌酐比与2 型糖尿病下肢血管病变相关性研究
2020-06-08李文静汤淑涵刘佳瑞陈超周婉叶山东
李文静,汤淑涵,刘佳瑞,陈超,周婉,叶山东
(安徽医科大学附属省立医院、安徽省立医院内分泌科,合肥 230001)
2 型糖尿病(T2DM)是以慢性高血糖为特征的全身代谢性疾病,糖尿病血管病变是常见的并发病之一,包括大血管病变和微血管病变。其中,下肢血管病变是2 型糖尿病患者常见大血管并发症,我国调查显示,糖尿病患者下肢动脉病变患病率为20.4%[1]。糖尿病下肢血管病变主要的病理改变是下肢动脉粥样硬化(LEAD),早期常常表现为感觉异常,随着疾病进展,晚期严重时可出现肢端肌肉萎缩、皮肤溃疡、缺血性坏疽等表现,是糖尿病足的重要原因,严重影响生活质量[2]。尿白蛋白排泄增加是糖尿病肾脏损害的敏感指教,有研究[3]认为它也是糖尿病大血管病变的独立危险因素。本研究进一步分析2 型糖尿病患者尿白蛋白/尿肌酐比值(UACR)与下肢血管病变的关系,判断其在下肢血管病变发生发展中的变化,为早期诊断及治疗2 型糖尿病LEAD 提供帮助。
1 对象与方法
1.1 研究对象 选取2016 年6 月至2019 年1 月于安徽省立医院内分泌科住院的577 例T2DM 患者,其中男339 例,女238 例;年龄(62.35 ±11.89)岁;病程(12.87 ±7.77)年。所有患者符合1999 年WHO 糖尿病诊断标准[4]。所有的患者采用超声多普勒血流探测仪测定踝肱指数(ABI)。《2017 年中国2 型糖尿病防治指南》[5]:ABI ≤0.90,诊断LEAD,故根据ABI 结果,将所有患者分为两组,下肢血管病变组(LEAD 组)105 例,无下肢血管病变组(NLEAD 组ABI >0.90) 472 例。
1.2 纳入与排除标准 纳入标准:(1)所有T2DM诊断符合世界卫生组织(WHO)2 型糖尿病诊断标准;(2)年龄>18 岁;(3)糖尿病下肢血管病变诊断符合中国2 型糖尿病防治指南的定义。(4)踝肱指数ABI 的结果完整。排除标准:(1)1 型糖尿病、妊娠期糖尿病;(2)继发性T2DM;(3)合并糖尿病急性并发症:如糖尿病酮症酸中毒、高渗性高血糖综合征;(4)合并严重的心功能不全及肝功能不全;(5)合并急性肾功能不全、原发性肾脏疾病;(6)合并各种感染性疾病;(7)合并恶性肿瘤、甲状腺疾病、骨质疏松史的患者;(8)近期有创伤和手术等应激病史。
1.3 方法
1.3.1 一般资料 测定身高、体质量,计算体质指数(BMI)。记录患者性别、年龄、病程、吸烟史、收缩压(SBP)和舒张压(DBP)和吸烟史。
1.3.2 实验室指标的测定 研究对象禁食8~12 h,于次日清晨空腹抽静脉血,使用全自动生化分析仪检测患者空腹血糖(FPG)、总胆固醇(TC)、三酰甘油(TG)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)、血肌酐(SCr)和尿酸(UA);采用高效液相色谱法测定HbA1c;留取晨尿采用采用免疫比浊法检测尿白蛋白,Benedict-Behre肌酐比色法测肌酐浓度,计算其比值为UACR,以UACR≥30 mg/g Cr 为异常。eGFR 根据肾脏病饮食改良公式计算:
eGFR(mL·min-1·1.73 m-2)=186 × (SCr/88.402) -1.154 ×年龄-0.203 ×(0.742 ×女性)。
1.3.3 ABI 的测量 用多普勒血流探测仪测定,患者仰卧位,置袖带于踝部及前壁肱动脉,测取胫前或胫后动脉、足背动脉以及肱动脉收缩压,两者之比为ABI 值,取两侧中的最低值作为ABI 结果。
1.4 统计学处理 采用SPSS 21.0 软件进行统计学分析。正态分布的计量资料用表示,组间比较采用t 检验;非正态分布计量资料以中位数及四分位间距[M(P25,P75)]表示,采用非参数Mann-Whitney U 检验。计数资料以例数(百分数)表示,采用χ2检验。UACR 与其他指标相关性分析采用Spearman 法。此外,采用二分类logistic 回归分析法分析2 型糖尿病合并下肢血管病变的危险因素。P <0.05为差异有统计学意义。
2 结果
2.1 两组临床指标的比较 与NLEAD 组比较,LEAD 组年龄、病程、吸烟率、SBP、LDL-C、UA、Cr 及UACR 上升,而eGFR 降低,差异有统计学意义(P <0.05),DBP、BMI、HbA1c、FPG、TC、TG 和HDL-C 差异无统计学意义(P >0.05)。见表1。
2.2 UACR 与各指标的Spearman 相关分析Spearman 相关分析结果显示,UACR 与年龄、病程、SBP、HbA1c、Cr 和UA 呈正相关,与eGFR、ABI 呈负相关。见表2。
2.3 2 型糖尿病合并下肢血管病变的多因素logistic回归分析 以有无T2DM 合并下肢血管病变为因变量,以SBP、LDL-C、UACR 等为自变量,行多因素logistic回归分析,结果显示,SBP、LDL-C 和UACR 是T2DM 合并下肢血管病变的危险因素。

表1 两组临床指标的比较
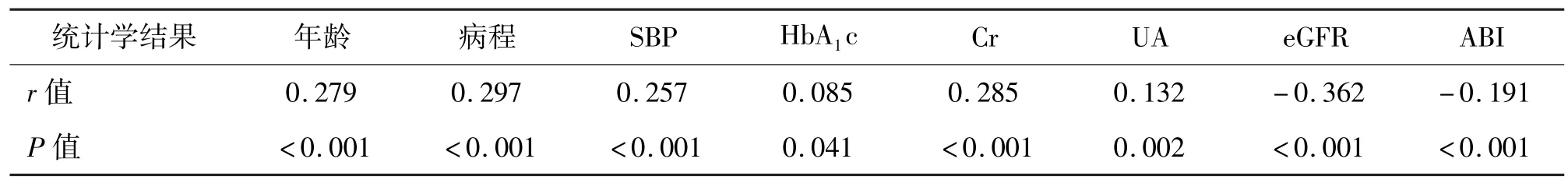
表2 UACR 与各指标的Spearman 相关分析
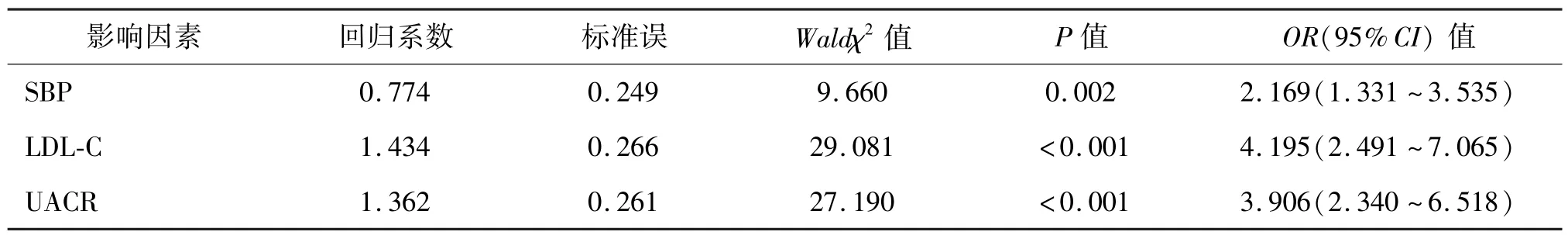
表3 2 型糖尿病合并下肢血管病变的多因素logistic 回归分析
3 讨论
糖尿病下肢血管病变具有低诊断、低治疗,以及高致残率和高死亡率的特点。已有大量临床研究证明,糖尿病肾脏疾病与心血管疾病、脑血管疾病和外周血管疾病等糖尿病大血管病变之间存在联系。不论是GFR 降低或者是尿白蛋白尿排泄增加,糖尿病大血管病变发生风险均明显增加[6]。
血管内皮细胞是维持其正常功能的关键因素,近年来研究显示血管内皮细胞功能障碍被视为慢性血管病变的基础[7]。糖尿病大血管病变与微血管病变之间有共同的病理基础,即均以内皮细胞功能损害为主要靶点,有研究显示UACR 是反映糖尿病肾脏损害的敏感指标,其与血管内皮细胞功能障碍和大血管病变的发生也密切相关。此外,国外的多个研究也已证实LEAD 是糖尿病患者出现微量白蛋白尿和肾功能减退的独立危险因素[8]。Tseng 等[9]对290 名中国台湾地区2 型糖尿病患者进行回顾性研究后认为,伴有外周血管病变的患者UACR 更高,与ABI 呈反比关系,且随着UACR 的增加,外周血管病变的发生率增加。严丽等[10]研究得出2 型糖尿病患者ABI 与ACR 呈显著负相关关系,提示了ABI 水平的变化可作为临床上早期糖尿病肾病的预测指标。本研究中,糖尿病LEAD 组患者的UACR水平明显高于无LEAD 组患者。相关分析显示UACR 与ABI 呈反比关系,logistic 回归分析显示UACR 是T2DM 合并下肢血管病变的独立危险因素,提示UACR 增高的糖尿病患者LEAD 发生风险增加。其可能的机制:(1)肾脏血管内皮损害时常与全身血管内皮损伤同时发生[11-12]。白蛋白尿可能提示T2DM 患者存在全身广泛的内皮细胞功能紊乱,内皮细胞功能损害不仅存在于肾脏微血管,也广泛存在于全身的大动脉[13]。(2)糖尿病下肢血管主要以动脉粥样硬化为病理基础,而动脉粥样硬化的主要始动环节是内皮细胞损伤,脂质渗入、平滑肌增殖和自由基损伤等诸多因素在动脉粥样硬化形成过程中均起到重要作用[14]。
多项研究[15-16]认为,糖尿病患者血管动脉粥样硬化与多种高危因素有关如糖尿病病程、高血压、血脂、吸烟及血糖水平等。糖尿病并发下肢血管病变是在持续高血糖的基础上由多种因素共同作用的结果[17]。本研究中,糖尿病合并LEAD 组患者的年龄、病程、吸烟率、SBP 和LDL-C 水平明显高于无LEAD 组患者。
综上所述,2 型糖尿病患者尿白蛋白排泄增加与LEAD 的发生风险相关,UACR、SBP 和LDL-C 是LEAD 发生的危险因素。定期监测UACR 对预测2型糖尿病患者下肢血管病变有价值。
