核糖体RNA加工蛋白15在肝细胞癌中的表达、功能和临床意义*
2020-06-08邹晓平
赵 典 张 斌 邹晓平
南京大学医学院附属鼓楼医院消化科1(210008) 南京鼓楼医院高淳分院消化科2
背景:核糖体RNA加工蛋白15(Rrp15)是一种主要定位于核仁,参与核糖体RNA加工处理的蛋白质。关于Rrp15基因在肝细胞癌(HCC)中的表达、功能和临床意义目前尚未见报道。目的:探讨Rrp15在HCC中的表达水平及其对患者预后和HCC细胞增殖能力的影响。方法:利用GEPIA网站、TCGA数据库和手术切除HCC组织标本分析Rrp15在HCC中的表达水平、其表达与患者临床病理特征的关系以及对预后的影响。利用慢病毒感染技术构建敲减Rrp15基因的人肝癌细胞株HuH7,以流式细胞术、台盼蓝排斥实验和平板克隆形成实验检测细胞凋亡、活性氧产生和细胞增殖能力。结果:HCC组织中的Rrp15 mRNA和蛋白表达水平显著高于癌旁组织(P<0.05);Rrp15高表达者总体生存率和无病生存率显著降低(P=0.012, P=0.049)。HCC组织中Rrp15的差异表达与肿瘤质量相关(P=0.020),与其他临床病理参数无明显相关性(P>0.05)。敲减Rrp15的HuH7细胞,细胞凋亡比例和细胞内活性氧水平增高(P<0.05),细胞短期和长期增殖能力均受抑(P<0.05)。结论:Rrp15在HCC中高表达并与肿瘤的恶性生物学行为和不良预后相关。敲减Rrp15基因可显著抑制HCC细胞的增殖能力。
肝细胞癌(hepatocellular carcinoma, HCC)是我国最常见的恶性肿瘤之一,也是主要癌症相关死因之一[1]。近年来,随着科学技术的不断进步,有关HCC的基础研究广泛开展,但其发病机制至今仍未完全阐明。核糖体RNA加工蛋白15(ribosomal RNA processing 15 homolog, Rrp15)是一种主要定位于核仁、参与核糖体RNA加工处理的蛋白质。我国学者Dong等[2]发现,Rrp15参与了包括核仁形成、核糖体生物合成、细胞周期检查点的调控等在内的多种生物学过程;敲减肿瘤细胞株中的Rrp15基因表达,可阻滞细胞周期,诱导细胞凋亡,提示Rrp15可能作为肿瘤治疗的新靶点。然而,Rrp15基因在HCC中的表达、功能和临床意义目前尚未见报道。本研究利用公共数据库资源分析Rrp15在HCC中的表达水平、其表达与患者临床病理特征的关系以及对预后的影响,并通过敲减人肝癌细胞株HuH7中的Rrp15基因表达,观察其对HCC细胞凋亡、增殖等恶性生物学行为的影响,以期为HCC的Rrp15靶向治疗提供基础理论依据。
材料与方法
一、病例资料和数据库
4对HCC组织及其相应癌旁组织为南京大学医学院附属鼓楼医院普外科的手术切除标本,采集后30 min内液氮速冻,-80 ℃冰箱保存备用。研究方案经医院伦理委员会审核批准,入组病例均签署知情同意书。
利用GEPIA(Gene Expression Profiling Interactive Analysis; http://gepia.cancer-pku.cn/)行Rrp15基因表达水平和预后分析,利用TCGA(The Cancer Genome Atlas; https://www.cancer.gov/about-nci/organization/ccg/research/structural-genomics/tcga)分析Rrp15基因表达与HCC患者临床病理参数的关系。
二、细胞株和主要试剂
人肝癌细胞株HuH7(中国科学院典型培养物保藏委员会细胞库)使用含10% FBS的DMEM培养基,于37 ℃、5% CO2培养箱中培养,细胞密度达80%~90%时传代或进行后续实验。
两种Rrp15基因shRNA(shRNA-Rrp15)慢病毒载体、阴性对照慢病毒和病毒感染试剂为上海吉凯基因医学科技股份有限公司产品。干扰序列1:5’-GGG AUG GAU GGA AGU ACA ATT-3’,干扰序列2:5’-GGA AAG UGA UGG GCC AGA UTT-3’;阴性对照序列:5’-UUC UCC GAA CGU GUC ACG UTT-3’。
TRIzol RNA分离试剂(Invitrogen, Thermo Fisher Scientific);PrimeScriptTMRT Master Mix(Perfect Real Time; Takara Bio Inc.);ChamQTMUniversal SYBR®qPCR Master Mix(南京诺唯赞生物科技有限公司);RIPA裂解液、BCA蛋白浓度测定试剂盒(上海碧云天生物技术有限公司);PMSF(南京生兴生物技术有限公司);蛋白酶抑制剂混合物(Roche Molecular Systems, Inc.);SDS-PAGE蛋白上样缓冲液(5×;Biosharp Life Sciences);兔抗人Rrp15多克隆抗体、鼠抗人β-actin单克隆抗体(Sigma-Aldrich LLC.);HRP标记抗兔IgG和抗小鼠IgG(Cell Signaling Technology, Inc.);凋亡检测试剂盒、活性氧检测试剂盒(BD Biosciences);Transwell小室(Corning Incorporated)。
PCR引物由南京锐真生物技术有限公司合成。引物序列:Rrp15 F 5’-CTG GGC AGA TGC TAT GGC TAA A-3’, R 5’-GGA CAA CAT CTG GCT TTA CTC TG-3’; β-actin F 5’-AGC GAG CAT CCC CCA AAG TT-3’, R 5’-GGG CAC GAA GGC TCA TCA TT-3’。
三、方法
1.慢病毒感染:感染前一天在6孔板中接种HuH7细胞,24 h后细胞密度达30%~50%,参照试剂说明书感染慢病毒,24 h后更换新鲜完全培养基继续培养,行后续实验。
2.Real-time PCR:慢病毒感染细胞后第4天,TRIzol试剂提取细胞总RNA,紫外分光光度仪测定RNA浓度和纯度,参照试剂说明书反转录合成cDNA,行real-time PCR扩增,反应体系:95 ℃ 30 s,95 ℃ 15 s,60 ℃ 60 s,40个循环。2-ΔΔCT法分析目的基因mRNA相对表达量。
3.蛋白质印迹法:以RIPA裂解液、PMSF、蛋白酶抑制剂混合物配制完全裂解液,裂解组织或慢病毒感染后第4天的细胞,4 ℃ 12 000×g离心15 min,收集上清液,BCA法测定蛋白浓度,100 ℃ 10 min变性蛋白备用。SDS-PAGE 90 V 30 min,120 V 60 min,PVDF膜湿转200 mA 120 min,5%脱脂牛奶室温封闭2 h,4 ℃孵育一抗(Rrp15 1∶250稀释,β-actin 1∶1 000稀释)过夜,洗膜后室温孵育二抗2 h,洗膜后显影。Image J软件分析条带灰度,计算目的蛋白相对表达量。
4.细胞凋亡和活性氧检测:慢病毒感染细胞后第4天,胰酶消化细胞,完全培养基中止消化后1 500×g离心,弃去上清液,PBS洗涤2次,离心后收集细胞沉淀。参照试剂说明书进行操作,以结合缓冲液稀释Annexin V-FITC和PI(细胞凋亡检测),以无血清培养基稀释DCFH-DA荧光探针(活性氧检测),流式细胞仪分析细胞凋亡比例和活性氧水平。
5.台盼蓝排斥实验:慢病毒感染细胞后第1、2、3、4、5天,胰酶消化细胞,完全培养基中止消化后1 500×g离心,弃去上清液,收集细胞沉淀,重悬,台盼蓝染液室温染色3~5 min,光学显微镜高倍镜下观察、计数活细胞个数(活细胞不着色,死细胞染成蓝色)。
6.平板克隆形成实验:慢病毒感染细胞24 h后,胰酶消化细胞,完全培养基中止消化后1 500×g离心,弃去上清液,收集细胞沉淀,重悬、计数,接种于6孔板,每孔1 000个细胞,37 ℃、5% CO2培养箱中继续培养14 d,每2 d更换一次新鲜完全培养基。14 d后,甲醇固定细胞,结晶紫染色,PBS洗涤,光学显微镜低倍镜下观察、计数大于10个细胞的克隆数。
四、统计学分析

结 果
一、Rrp15在HCC中的表达及其对预后的影响
从GEPIA网站纳入529例病例资料,其中HCC 369例,正常对照者160例;HCC组织中的Rrp15 mRNA表达水平高于正常肝组织,差异有统计学意义(P<0.05;图1A)。蛋白质印迹法检测显示,4例外科手术切除HCC组织中的Rrp15蛋白表达水平高于相应癌旁组织,差异有统计学意义(P=0.001;图1B、1C)。
进一步通过GEPIA网站分析Rrp15 mRNA表达对HCC患者预后的影响,结果显示与Rrp15低表达者相比,Rrp15高表达者总体生存率和无病生存率显著降低(P=0.012,P=0.049;图2A、2B)。
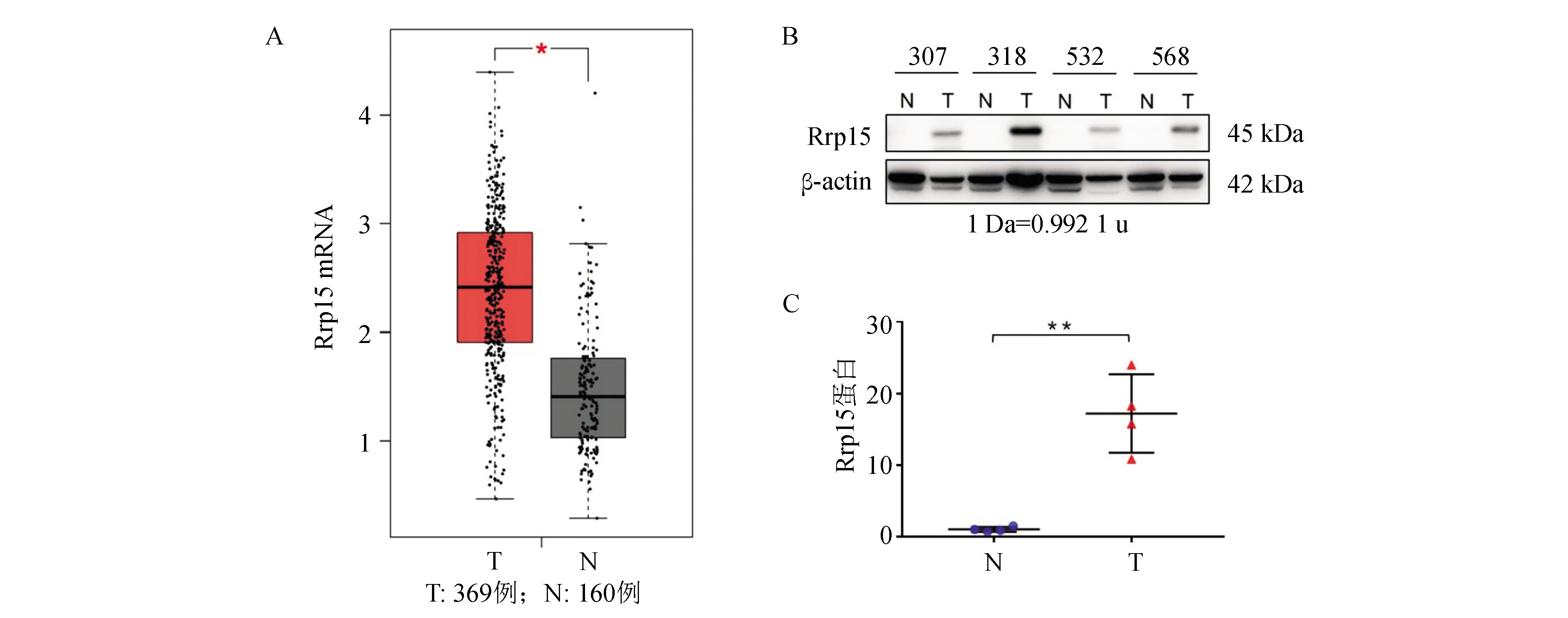
T:HCC组织,N:正常/癌旁组织;两组间比较,*P<0.05,**P<0.01
A:HCC组织和正常肝组织Rrp15 mRNA表达(GEPIA);B:蛋白质印迹法检测4对HCC组织及其相应癌旁组织Rrp15蛋白表达;C:HCC组织及其相应癌旁组织Rrp15蛋白相对表达量
图1 Rrp15在HCC中的表达

红色为Rrp15高表达,蓝色为Rrp15低表达
二、Rrp15表达与HCC患者临床病理特征的关系
剔除信息不完整的病例后,最终从TCGA数据库纳入135例HCC进行统计学分析。根据Rrp15 mRNA在HCC组织中的表达情况,表达水平<1定义为低表达(n=68),表达水平>1定义为高表达(n=67),分析显示Rrp15的差异表达与肿瘤质量相关(P=0.020),与患者性别、年龄、肿瘤远处转移、淋巴结转移、血管侵犯、TNM分期和组织病理学分级均无明显相关性(P均>0.05;表1)。
三、Rrp15基因敲减效率
HuH7细胞感染慢病毒后第4天,以real-time PCR和蛋白质印迹法验证Rrp15基因敲减效率,结果显示与感染阴性对照慢病毒的对照组相比,感染shRNA-Rrp15慢病毒的两组敲减组Rrp15 mRNA表达明显下调,差异均有统计学意义(P1=0.000 1,P2=0.000 1;图3A),敲减效率最高达90%;两组敲减组Rrp15蛋白表达水平亦相应下调(图3B)。
四、敲减Rrp15对HuH7细胞凋亡、活性氧产生和细胞增殖的影响
流式细胞分析显示,敲减Rrp15后,HuH7细胞凋亡比例显著增加(P1=0.000 5,P2=0.000 5;图4A),细胞内活性氧水平显著增高(P1=0.002 5,P2=0.003 0;图4B)。台盼蓝排斥实验结果显示,敲减Rrp15可抑制HuH7细胞增殖,慢病毒感染后第4天(P1=0.005 2,P2=0.000 1)和第5天(P1=0.000 2,P2<0.000 1)抑制效果明显(图4C)。平板克隆形成实验结果提示,敲减Rrp15可抑制肿瘤细胞的长期增殖能力(P1<0.000 1,P2<0.000 1;图4D、4E)。

表1 Rrp15表达与HCC患者临床病理特征的关系n(%)

***敲减组与对照组比较,P<0.001

敲减组与对照组比较,**P<0.01, ***P<0.001, ****P<0.000 1
讨 论
HCC是威胁人类健康的重大疾病,尽管近年来包括分子靶向治疗、免疫检查点抑制剂、肝移植等在内的多种治疗方法都在不断进步[3-5],但患者5年生存率仍然很低[6]。Rrp15是最早在酵母菌中发现的核糖体60S亚基前体的组成部分(Rrp15p)[7]。在人体内,Rrp15则同时为40S亚基和60S亚基前体的组成部分[2]。近年研究表明,Rrp15能促进小鼠胚胎成纤维细胞株NIH3T3增殖,抑制细胞凋亡[8];在人宫颈癌HeLa细胞株中过表达Rrp15基因可致核仁数量增多,核仁相关蛋白表达增高,细胞增殖速率加快,提示Rrp15可能参与促进肿瘤的发生、发展[9]。但迄今未见Rrp15基因在HCC中的表达及其作用的研究报道。
本研究通过检索公共数据库发现HCC组织中的Rrp15 mRNA表达水平显著高于正常肝组织,对4对外科手术切除HCC组织及其相应癌旁组织中Rrp15蛋白表达的分析结果与之相一致;Rrp15高表达者生存期显著缩短。对TCGA数据库中HCC患者临床病理特征的分析显示,Rrp15高表达者肿瘤质量显著大于低表达者。因该数据库未提供肿瘤大小相关信息,故本研究纳入肿瘤质量这一参数进行分析,该参数可间接反映肿瘤大小,肿瘤质量越大、体积越大,增殖能力越强,提示Rrp15在HCC的生长增殖中扮演极其重要的角色。随后通过慢病毒感染成功敲减人肝癌细胞株HuH7中的Rrp15基因表达,观察到细胞凋亡增加,细胞内活性氧水平增高,细胞短期和长期增殖能力均明显受抑,表明敲减Rrp15基因能有效抑制HCC细胞增殖。既往文献报道活性氧可激活MAPK信号通路,诱导细胞凋亡,发挥抑癌作用[10-11]。结合上述研究结果,敲减Rrp15基因极有可能影响HCC的氧化应激状态,促进细胞内活性氧产生,使肿瘤细胞发生凋亡,从而抑制肿瘤细胞增殖。
综上所述,Rrp15在HCC中高表达并与肿瘤的恶性生物学行为和不良预后相关;敲减Rrp15基因能诱导HCC细胞凋亡,显著抑制细胞增殖能力。因此,靶向抑制Rrp15有望成为治疗HCC的新方法。然而,HCC中Rrp15基因高表达以及敲减Rrp15抑制HCC细胞增殖的具体分子机制目前仍不清楚,有待进一步深入研究,为HCC的Rrp15靶向治疗提供更多理论依据。
