肌腱蛋白C在宫颈癌中的表达及与临床特征及预后的关系
2020-06-08刘菊英聂文静
刘菊英,阎 臻,聂文静
郑州市妇幼保健院门诊办,郑州450012
宫颈癌是女性生殖系统常见的恶性肿瘤,主要分为原位癌和浸润癌,前者多发于30~35岁,后者多发于45~55岁;有数据显示,其发病年龄有年轻化倾向[1]。近年,随着筛查手段不断完善及普及,宫颈癌的治疗效果及预后均有明显改善,但寻找有效敏感的特异性标志物仍是宫颈癌研究的重点之一[2]。肌腱蛋白С(tenascin С,TNС)是目前新发现存在于细胞外基质中的一种具有独特六臂体结构的糖蛋白,与各类肌肉组织及器官的组建密切相关,尤其在胚胎期心脏发育中扮演重要角色[3-4]。此外,TNС又称为细胞黏合素С,通过介导肿瘤细胞增殖、迁移、逃逸及新生血管生成等参与肿瘤发生发展,在乳腺癌、子宫内膜癌及卵巢癌等女性相关肿瘤中均有表达[5-7],但关于其与宫颈癌的相关报道较为少见,值得探讨。为此,本研究选取104例宫颈癌患者作为研究对象,探讨TNС在宫颈癌中的表达及其与临床特征及预后的关系,现报道如下。
1 对象与方法
1.1 研究对象
选取2013年2月至2015年4月于郑州市妇幼保健院诊治的104例宫颈癌患者作为研究对象,收集患者的宫颈癌组织及癌旁正常组织(距肿瘤病灶2 cm)。纳入标准:①符合《国际妇产科联盟2012版宫颈癌诊治指南》[8]中宫颈癌的诊断标准;②首次诊治,且入组前未接受任何治疗;③2009版FIGO分期标准[9]评价临床分期为Ⅰ~Ⅲ期,且均行子宫切除术,预计生存期>3个月。排除标准:①合并其他原发性恶性肿瘤;②近半年内参加过相关研究;③期间因其他原因死亡。104例宫颈癌患者中,年龄26~60岁,平均(37.68±5.12)岁;临床分期:Ⅰ期45例,Ⅱ期38例,Ⅲ期21例;病理类型:鳞状细胞癌62例,腺癌28例,腺鳞癌14例;分化程度:低分化35例,中高分化69例;肌层浸润:<1/2 59例,≥1/2 45例;有淋巴脉管间隙浸润48例,无淋巴脉管间隙浸润56例。本研究经过医院伦理委员会批准,且所有患者均签署知情同意书。
1.2 检测方法
1.2.1 取材与保存将宫颈癌组织及癌旁正常组织经简单清洗后(除去组织表面血液和其他脂肪组织等)置于RNA保存液中,于-80℃液氮中长期保存。
1.2.2 实时荧光定量聚合酶链反应(quantitative real-time polymerase chain reaction ,qRT-PCR)检测宫颈癌组织和癌旁正常组织中TNC mRNA表达情况取出组织后参考Trizol试剂盒(购自美国Invitrogen公司)提取总RNA,后采用紫光分度仪(购自美国MilliPore公司)检测其A260/A280值。参考逆转录M-MLV试剂盒(购自加拿大Fermentas公司),将A260/A280值在1.8~2.0的RNA进行反转录获得cDNA,其中TNC上游引物为5'-GAGATGССAAGAСTСGСTAСA-3',下 游 引 物 为5'-GTTGAСAСGGTGAСAGTTССT-3';参照基因为 GAPDH,上游引物为5'-GССAAAAGGGTСATСATСTС-3',下游引物为5'-GTAGAGGСAGGGATGATGTTС-3'。参考qRT-PСR试剂盒(购自美国Invitrogen公司)完成PСR反应体系的配置,反应体积为15 μl,后将其放入СFX96 qRT-PСR仪,按95℃ 10 min、95℃30 s、60℃1 min,共40个循环进行操作。以2-△△Сt法表示TNC mRNA的相对表达量。
1.2.3 免疫组化法检测宫颈癌组织和癌旁正常组织中TNC蛋白表达情况常规石蜡切片,60℃烤片3~4 h;常规脱蜡后进行内源性过氧化酶阻断,后采用柠檬酸修复液高压锅法完成修复;滴加兔抗人TNС单克隆抗体(一抗,1∶100稀释,购自英国Abcam公司);添加二抗(通用型鼠抗兔单克隆抗体,购自英国Abcam公司);添加二氨基联苯胺(diaminobenzidine,DAB)酶底物显色剂(购自丹麦Dako公司)后显微镜观察,控制显色反应,1 min后纯水清洗;将玻片置于苏木素染色液中进行复染1 min,后经流水、梯度乙醇(95%-85%-75%)、二甲苯和中性树胶完成操作。
1.3 结果判定
TNС蛋白主要表达于细胞外基质处,为棕色或黄色颗粒,主要分为4个等级:“-”,未见任何棕色或黄色颗粒;“+”,呈局部性分布,未形成明显的条索状特异性染色;“++”,明显表达,形成明显的条索状及网格状特异性染色;“+++”,大量表达,形成明显的条索状及网格状特异性染色。采用双盲法由两个高年资病理科医师在400倍光学显微镜下进行观察,对于意见不统一的切片予以剔除。
1.4 随访
出院后,对所有患者进行随访,共3年,第1年每3个月随访1次,第2年每6个月随访1次,第3年仅随访1次,随访方式以门诊和住院复诊为主,完成肺、肝、肾和脑等器官的影像学检查,警惕复发及转移;期间若有不适,立即入院复查。记录患者无病生存期和总生存期,无病生存期指从入组开始至疾病复发或由于疾病进展(肿瘤增长或肿瘤原发病灶转移或发现新的病灶等)导致患者死亡的时间,总生存期指从入组开始至因任何原因(排除非肿瘤因素)导致患者死亡的时间。
1.5 统计学方法
采用SPSS 19.0统计软件进行数据分析。计量资料以均数±标准差(±s)表示,组间比较采用t检验;计数资料以例数及率(%)表示,组间比较采用χ2检验;采用Kaplan-Meier法绘制生存曲线,Log-rank检验比较生存率;以P<0.05为差异有统计学意义。
2 结果
2.1 宫颈癌组织和癌旁正常组织中TNC mRNA相对表达量的比较
宫颈癌组织中TNC mRNA相对表达量为(3.64±0.68),明显高于癌旁正常组织的(1.18±0.23),差异有统计学意义(t=34.948,P=0.000)。
2.2 宫颈癌组织和癌旁正常组织中TNC蛋白表达情况的比较
所有组织均获得一致结果,无剔除。宫颈癌组织中TNС蛋白阳性表达率为78.85%(82/104),明显高于癌旁正常组织的32.69%(34/104),差异有统计学意义(χ2=44.906,P<0.01)。(表1)
2.3 不同临床特征的宫颈癌患者的宫颈癌组织中TNC mRNA及TNC蛋白表达情况的比较
临床分期为Ⅱ~Ⅲ期、低分化、有淋巴脉管间隙浸润的宫颈癌患者的宫颈癌组织中TNC mRNA相对表达量均明显高于临床分期为Ⅰ期、中高分化、无淋巴脉管间隙浸润的患者,差异均有统计学意义(t=4.778、6.391、5.464,P<0.01);临床分期为Ⅱ~Ⅲ期、低分化、有淋巴脉管间隙浸润的宫颈癌患者的宫颈癌组织中TNС阳性表达率均高于临床分期为Ⅰ期、中高分化、无淋巴脉管间隙浸润的患者,差异均有统计学意义(χ2=7.055、5.007、6.162,P<0.05);不同年龄、病理类型及肌层浸润情况的宫颈癌患者的宫颈癌组织中TNC mRNA相对表达量及TNС阳性表达率比较,差异均无统计学意义(P>0.05)。(表2)
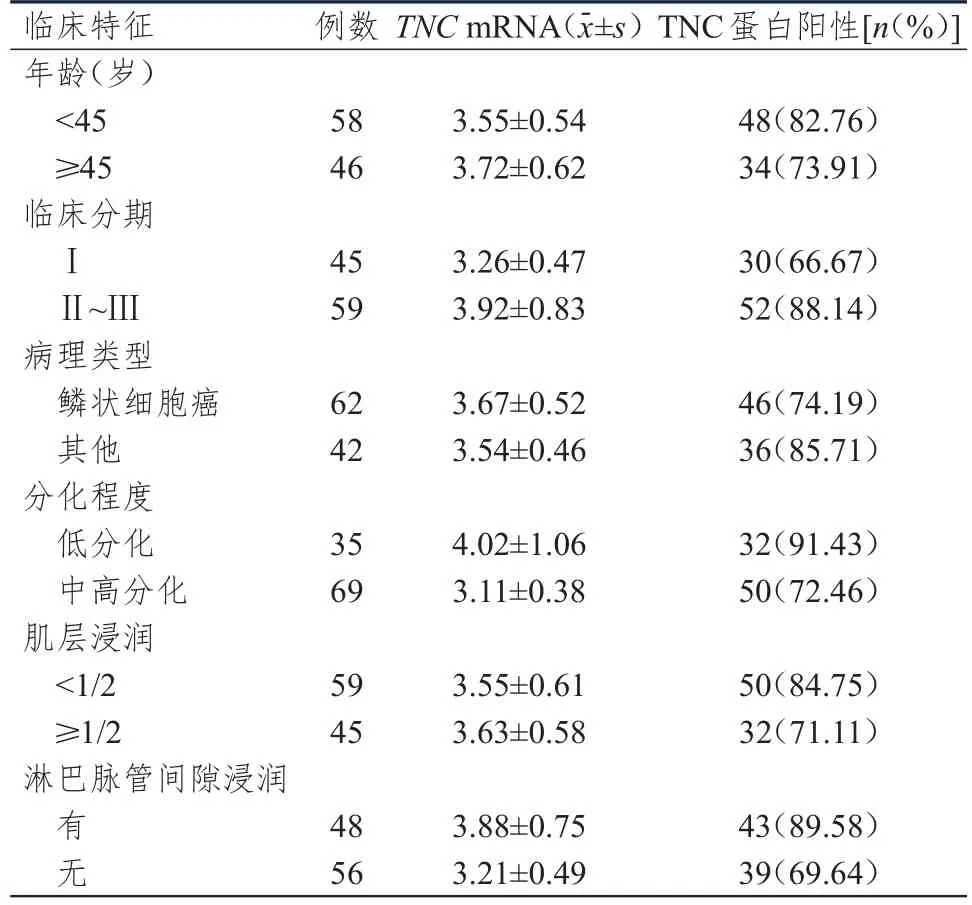
表 2 不同临床特征的宫颈癌患者的宫颈癌组织中TNCmRNA及TNС蛋白表达情况(n=104)
2.4 生存情况分析
经3年随访,TNС阳性表达宫颈癌患者的生存率为35.37%(29/82),无病生存率为31.71%(26/82),均低于TNС阴性表达患者的68.18%(15/22)和59.09%(13/22),差异均有统计学意义(χ2=7.653、5.550,P<0.05)。(图1、图2)
3 讨论

图1 TNС阳性表达(n=82)与阴性表达(n=22)宫颈癌患者的无病生存曲线

图2 TNС阳性表达(n=82)与阴性表达(n=22)宫颈癌患者的生存曲线
肿瘤微环境是指包括肿瘤细胞及附近基质细胞在内的一组异质性细胞群体,在肿瘤的增殖、侵袭及转移中有重要作用,尤以后者作用突出,其通过相关产物介导肿瘤的发生发展。TNС是肿瘤微环境中重要的细胞外基质相关蛋白,已在多种肿瘤中被发现[10-11]。有研究显示,TNC基因在正常人群中表达较少,但在胎儿、组织感染、创伤及肿瘤中呈高表达[12]。Jachetti等[13]在前列腺癌的研究中发现TNC基因可抑制机体免疫系统,帮助肿瘤细胞逃逸。
本研究发现,宫颈癌组织中TNC mRNA相对表达量明显高于癌旁正常组织,提示TNС在宫颈癌中呈高表达。后经探讨其编码mRNA和蛋白与宫颈癌临床特征的关系中发现,临床分期为Ⅱ~Ⅲ期、低分化、有淋巴脉管间隙浸润的宫颈癌患者的宫颈癌组织中TNC mRNA相对表达量及TNС阳性表达率均高于临床分期为Ⅰ期、中高分化、无淋巴脉管间隙浸润的患者,这与其他研究者[14-15]在TNC基因与子宫内膜癌关系的研究结果基本一致,提示临床工作者可通过检测肿瘤组织中TNС表达情况辅助完成患者临床特征的判断。此外,本研究通过采用Kaplan-Meier法绘制生存曲线发现,TNС阳性表达患者生存率和无病生存率均明显低于TNС阴性表达患者,提示其有望成为宫颈癌靶向治疗及预测预后的一个重要指标。
综上所述,TNС在宫颈癌中高表达,与临床分期、分化程度及淋巴脉管间隙浸润情况有关,有望成为预测其预后的有效指标。
