急性缺血性卒中患者阻塞性睡眠呼吸暂停低通气综合征与相关血液生化标志物的临床研究
2020-06-08嵇朋江利敏孙根寇启星屈雪萍孙雅静孟凡超周衡
嵇朋,江利敏,孙根,寇启星,屈雪萍,孙雅静,孟凡超,周衡
阻塞性睡眠呼吸暂停低通气综合征(obstructive sleep apnea hypopnea syndrome,OSAHS)的特征是反复呼吸暂停或过度呼吸不足,从而导致间歇性低氧血症及与低氧有关的脏器损伤[1]。国外研究报道,OSAHS是缺血性卒中的独立危险因素之一,并且显著影响患者的病情进展及预后[2-3]。有研究认为,OSAHS患者多种血清炎性因子水平增高,可能参与动脉粥样硬化的进程,从而影响缺血性卒中的发展和预后[4]。我国目前关于急性缺血性卒中(acute ischemic stroke,AIS)患者OSAHS与炎性因子关系的研究较少。本研究主要通过分析AIS患者OSAHS与hs-CRP、D-二聚体(D-dimer,D-D)、纤维蛋白原降解产物(fibrinogen degradation products,FDP)的关系,旨在进一步明确AIS患者OSAHS与上述血液生化标志物的关系,为临床诊疗提供参考依据。
1 研究对象与方法
1.1 研究对象 前瞻性连续收集2018年1月- 2019年12月郑州市第三人民医院及郑州市第二人民医院神经内科收治的AIS患者,所有患者均符合《中国急性缺血性脑卒中诊治指南2014》诊断标准[5]。入组标准:①头颅MRI检查证实为缺血性卒中,且发病时间<72 h;②年龄18~85岁;③发病2周时接受多导睡眠图(polysomnography,PSG)监测;④同意参加本研究并签署知情同意书。排除标准:①出血性卒中;②任何程度的意识障碍;③基础血氧饱和度<90%;④既往有卒中或其他神经系统疾病病史;⑤严重的心或肺功能衰竭、肾功能不全、甲状腺功能减退或恶性肿瘤;⑥其他疾病引起的真性延髓性麻痹、假性延髓性麻痹或喉肌麻痹;⑦严重的脑血管病或其他任何原因造成咽喉部肌肉障碍、舌瘫舌后坠阻塞呼吸道及吞咽困难(出现以下任何一种情况均被认为有吞咽困难:a.明显无法吞咽固体;b.在服用10 mL水后口腔无法把液体运作成球状;c.反复咳嗽;d.吞咽时没有喉头运动);⑧已进行持续气道正压通气治疗;⑨行PSG监测检查前14 d曾服用可能影响呼吸的药物如镇静安眠药;⑩中枢性或混合性呼吸暂停-呼吸不足综合征;任何原因不能配合(如精神障碍者)或不同意完成PSG监测。本研究已通过郑州市第三人民医院和郑州市第二人民医院医学伦理委员会批准。
根据是否合并OSAHS,将患者分为OSAHS组和非OSAHS组。OSAHS的诊断符合《阻塞性睡眠呼吸暂停低通气综合征诊治指南(2011修订版)》中的诊断标准[6]。根据PSG结果,将OSAHS组患者分为轻度OSAHS组,中度OSAHS组及重度OSAHS组。
1.2 方法
1.2.1 一般资料收集 收集患者的年龄、性别等人口学信息,BMI和高血压病、糖尿病、冠心病等血管危险因素信息。
1.2.2 检测方法及仪器 所有患者于入院第2天清晨采集空腹血,采用胶乳增强免疫比浊法检测hs-CRP水平,凝固法检测D-D及FDP水平。PSG监测使用Alice-5PSG记录仪(美国伟康)。
1.2.3 睡眠监测 卒中发病14 d后,患者在耳鼻喉科进行一夜PSG监测,所有受检者在监测前24 h禁服对睡眠障碍有影响的饮料或药物,日间尽量少饮水,中午不休息。根据美国睡眠医学会(American Academy of Sleep Medicine,AASM)诊断与睡眠相关事件的标准评价PSG得分[7]。轻度是呼吸暂停低通气指数(apnea hypopnea index,AHI)为5~14次/小时,夜间最低动脉血氧饱和度(lowest arterial oxygen saturation,LSaO2)为85%~89%;中度是AHI为15~30次/小时,夜间LSaO2为80%~84%;重度是AHI>30次/小时,夜间LSaO2<80%。
1.3 统计学方法 应用SPSS 22.0软件进行统计学分析,符合正态分布的计量资料用表示,均数间比较采用ANOVA方差分析,两均数间比较采用LSD-t检验;偏态分布的计量资料用中位数及四分位间距表示,组间比较采用秩和检验。计数资料用频数(%)表示,组间比较采用χ2检验。以P<0.05为差异有统计学意义。

表1 OSAHS组与非OSAHS组一般资料比较
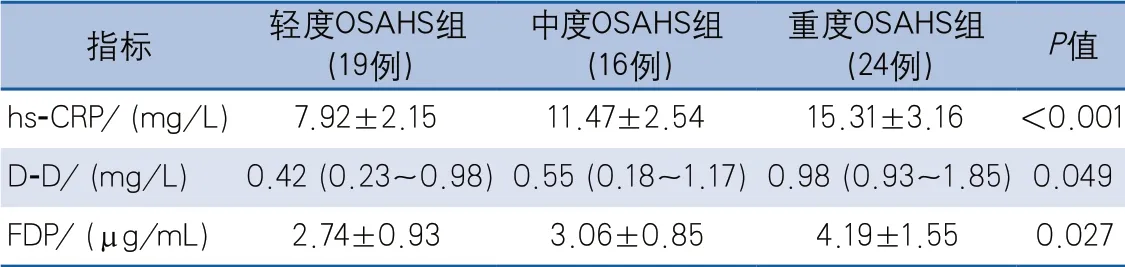
表2 不同严重程度OSAHS患者各项血液生化标志物比较
2 结果
本研究共纳入98例患者,年龄44~79岁,平均年龄57.24±9.63岁,男性55例(56.1%),女性43例(43.9%)。缺血性卒中伴OSAHS组59例,单纯缺血性卒中组39例,两组患者的BMI、hs-CRP、D-D和FDP差异有统计学意义,而性别、年龄、高血压、糖尿病、冠心病、NIHSS评分等差异均无统计学意义(表1)。缺血性卒中伴OSAHS患者中,轻度OSAHS组19例,中度OSAHS组16例,重度OSAHS组24例。3组间hs-CRP、D-D和FDP水平差异有统计学意义(表2)。
进一步两两分析显示,轻度OSAHS组(P<0.001)和中度OSAHS组(P=0.005)hs-CRP水平均低于重度OSAHS组,轻度OSAHS组低于中度OSAHS组(P=0.012)。轻度OSAHS组D-D水平低于重度OSAHS组(P=0.023),轻度OSAHS组FDP水平低于重度OSAHS组(P=0.012)。
3 讨论
OSAHS是一种睡眠相关的呼吸障碍,主要症状为夜间打鼾及呼吸暂停、白日嗜睡等,病因比较复杂,在中国的患病率为3.62%~4.78%,而在AIS患者的患病率则高达70%左右。OSAHS的发病机制主要涉及上呼吸道狭窄和阻塞,伴随着中枢呼吸调节神经通路的破坏[8]。2011年美国心脏学会/美国卒中学会将睡眠呼吸紊乱归类为缺血性卒中的主要危险因素[9]。中华医学会神经病学分会脑血管病学组2015年在中国缺血性卒中二级预防指南中推荐缺血性卒中患者应进行睡眠呼吸监测[10]。
hs-CRP是肝脏受IL-6刺激后产生的一种炎性反应蛋白,该指标的升高提示全身存在炎症反应的可能性较大,故被认为是一种重要的系统性炎症血清生物标志物。OSAHS患者在呼吸暂停期间发作低氧血症,引起交感神经兴奋,诱导全身炎症反应,造成多种炎性因子如hs-CRP在体内释放[11]。然而由于肥胖等混杂效应,有关OSAHS与hs-CRP关系的研究产生了矛盾的结果。一些调查发现OSAHS和hs-CRP水平存在相关性[12-15]。OSAHS患者血CRP水平与AHI严重程度有关[12-13]。一项包括111例健康中年男性的研究表明,在调整内脏肥胖因素后,hs-CRP水平升高仍与OSAHS相关[15]。Guven等[16]通过研究OSAHS患者的生化指标发现,血清hs-CRP水平越高,AHI越高。国外也有研究显示血清hs-CRP、TNF-α、IL-6水平在合并OSAHS的缺血性卒中患者中显著高于正常水平[16-19]。但是,一项对907例成年人进行的睡眠队列研究发现,调整年龄、性别和BMI后,hs-CRP水平与睡眠呼吸障碍之间没有显著相关性[20]。
D-D和FDP是机体纤溶系统的重要指标,其中D-D是纤溶酶水解纤维蛋白产生的一种副产物,是反映人体纤溶系统功能的一种关键指标[21-22]。国外学者们发现D-D、FDP等凝血指标在OSAHS患者中显著升高[23],严重OSAHS组纤维蛋白原较轻中度OSAHS组显著升高[24],提示OSAHS和纤维蛋白原之间存在相关性[25]。OSAHS患者体内高凝状态的病理生理基础可能是OSAHS患者在长期缺氧状态下,内皮更容易受损,脂质更容易沉积在血管内膜下,并导致微血栓形成增加。此外,长期慢性低氧血症可促进骨髓红细胞增加,血液黏度增加和血流量减少,使血小板更容易沉积在受损的血管内膜表面,从而导致血液处于高凝状态[26]。
本研究对比缺血性卒中伴OSAHS组和单纯缺血性卒中组hs-CRP和D-D、FDP指标的差异,发现缺血性卒中伴OSAHS组hs-CRP和D-D、FDP指标水平升高,提示伴有OSAHS的AIS患者体内存在炎症反应及高凝状态。此外,又进一步对比AIS患者不同严重程度OSAHS组患者间hs-CRP和D-D、FDP水平,发现不同严重程度OSAHS的AIS患者,其hs-CRP和D-D、FDP水平也不同。
本研究存在一定的局限性,首先本研究数据来源较局限,仅来自两个研究中心,样本量较小,不能代表所有卒中人群,缺乏一定的代表性,因此需要更大样本多中心研究进一步证实;其次,本研究是横断面研究,OSAHS与相关血液生化标志物之间的因果关系无法明确,因此有必要进行长时间的随访进行纵向研究,给予OSAHS相关治疗措施后,监测上述血液生化标志物的动态变化,可能更能进一步说明两者之间的关系。
【点睛】本研究通过病例对照分析发现,与不伴OSAHS的急性缺血性卒中患者相比,伴有OSAHS的急性缺血性卒中患者血清hs-CRP、D-D、FDP水平更高。
