脑出血与脑小血管病亚型及总负荷的关系研究
2020-06-08张燕富奇志曲丹丹张艳丽
张燕,富奇志,曲丹丹,张艳丽
越来越多的研究认为脑出血(intracerebral hemorrhage,ICH)的严重程度与血肿周围组织的循环基础紧密相关。脑小血管具有物质运输、血流调节、构成血脑屏障及维持脑微环境平衡的功能。目前认为脑小血管病(cerebral small vessel disease,CSVD)是全身性疾病,间接反映机体微循环情况。然而多数研究只分析了CSVD的某一种亚型与ICH的相关性,实际上CSVD的多种亚型往往共存。本文探讨ICH的严重程度与CSVD各亚型及总负荷之间的关系颇具临床价值。
1 研究对象与方法
1.1 研究对象 本研究回顾性收集2013年8月-2017年8月于河南科技大学第一附属医院就诊的发病24 h内住院的脑出血患者。
纳入标准:①符合《中国脑出血诊治指南(2014)》自发性脑出血诊断标准[1];②血肿位于幕上;③出血量<40 mL;④年龄≥18岁;⑤首次CT在发病24 h之内完成,发病后3~5 d、10~14 d复查头颅CT;⑥发病48 h内完成头颅MRI检测(包含T1WI、T2WI、FLAIR、DWI、SWI序列)。
排除标准:①血肿位于幕下;②1周内有颅脑外伤史;③既往头颅手术史、预计24 h内外科治疗;④梗死、溶栓、血管畸形等原因所致继发性脑出血;⑤伴重大并发症或其他严重疾病(如恶性肿瘤、自身免疫性疾病或血液系统疾病等);⑥凝血功能障碍。
1.2 研究方法
1.2.1 资料收集 收集并记录患者的入院资料,包括年龄、性别、个人史(吸烟、饮酒)、入院血压(收缩压、舒张压、平均动脉压)、入院GCS评分、入院NIHSS评分等;实验室检查结果,包括Hcy、尿素、肌酐、TG、TC、LDL-C、HDL-C、空腹血糖等;影像学检查结果,包括入院24 h内、3~5 d、10~14 d头颅CT检查结果及头颅MRI检查结果。
1.2.2 血肿及水肿体积测量 采用多田公式法[2]计算体积(mL):V=(A×B×C)/2。确定血肿/水肿在颅内最大的切面;A代表最大切面的最长径(cm);B代表与A垂直的最长径(cm);C代表血肿/水肿的高,通过层厚与累及切面的层数相乘得到。24 h内、3~5 d、10~14 d血肿体积分别表示为:V血肿24h、V血肿3~5d、V血肿10~14d;水肿体积分别表示为:V水肿24h、V水肿3~5d、V水肿10~14d。影像学资料均由两位经过系统培训的神经科医师评估,存在差异者交由诊断经验丰富的影像科医师再次评估。
1.2.3 脑小血管病的严重程度评估
(1)应用PHILAPS Achiva 3.0T TX多源磁共振成像仪进行头颅MRI扫描(包含T1WI、T2WI、FLAIR、DWI、SWI序列),参照《中国脑小血管病诊治共识(2015)》[3]记录腔隙(lacune,LA)、脑白质高信号(white matter hyperintensity,WMH)、扩大的血管周围间隙(enlarged perivascular space,ePVS)、脑微出血(cerebral microbleed,CMB)的位置及数目。
(2)评估总CSVD负荷:依据MRI表现对总CSVD负荷评分[4-5],记录为“总CSVD评分”。以下情况分别记录为1分:LA≥1个、CMB≥1个、基底节区ePVS≥10个[6]、深部WMH Fazekas评分>1分或脑室旁WMH Fazekas评分>2分[7]。总CSVD评分为4种亚型评分之和。
1.3 统计学方法 应用IBM SPSS 22.0统计软件分析数据。计量资料满足正态分布,用表示;不满足正态分布的数据用中位数(四分位数)表示。计数资料用例数及百分位数表示。应用单因素线性回归分析各因素与血肿体积、水肿体积的关系。在多元线性回归分析中,纳入单因素分析中P<0.05的变量,应用逐步回归法分析4种CSVD亚型与血肿体积、水肿体积的关系。通过Spearman相关及偏相关分析研究总CSVD评分与血肿及水肿体积的关系。P<0.05表示差异具有统计学意义。
2 结果
2.1 一般资料 本研究最终共纳入85例符合入排标准的脑出血患者,年龄29~86岁,平均55.67±12.30岁,其中女性39例(45.88%),脑叶出血33例(38.82%),深部出血52例(61.18%),其他人口学特征、实验室检查及影像学检查见表1。
2.2 不同时期血肿严重程度的影响因素 在单因素线性回归模型中,年龄、平均动脉压、入院GCS评分、入院NIHSS评分与不同时期血肿体积相关,但V血肿24 h与Fazekas评分相关,V血肿3~5 d与ePVS、WMH、Fazekas评分相关,V血肿10~14 d与CMB数目、Fazekas评分相关(表2)。
在校正年龄、平均动脉压、入院GCS评分、入院NIHSS评分后,多元线性回归分析示CMB数目与V血肿24h、V血肿3~5d、V血肿10~14 d均正相关,Fazekas评分与V血肿24h、V血肿3~5d、V血肿10~14 d均负相关。LA、ePVS与不同时期血肿体积均不相关(表3)。
2.3 不同时期水肿严重程度的影响因素 在单因素线性回归模型中,年龄、平均动脉压、入院GCS评分、入院NIHSS评分、同期血肿体积与不同时期水肿体积相关,但V水肿24 h与ePVS相关,V水肿3~5d、V水肿10~14 d均与ePVS、WMH、Fazekas评分相关(表4)。
在校正年龄、平均动脉压、入院GCS评分、入院NIHSS评分、同期血肿体积后,多元线性回归分析示ePVS与V水肿24h、V水肿3~5d、V水肿10~14 d均负相关。LA、CMB、Fazekas评分与不同时期水肿体积均不相关(表5)。
2.4 脑小血管病总负荷与脑血肿及水肿严重程度的关系 Spearman相关分析示,总CSVD评分与V血肿24 h不相关,与V血肿3~5d(r=-0.269,P=0.013)、V血肿10~14d(r=-0.232,P=0.032)负相关。在应用偏相关分析校正年龄、平均动脉压、入院GCS评分、入院NIHSS评分后,总CSVD评分与V血肿24h、V血肿3~5d、V血肿10~14 d均不相关。
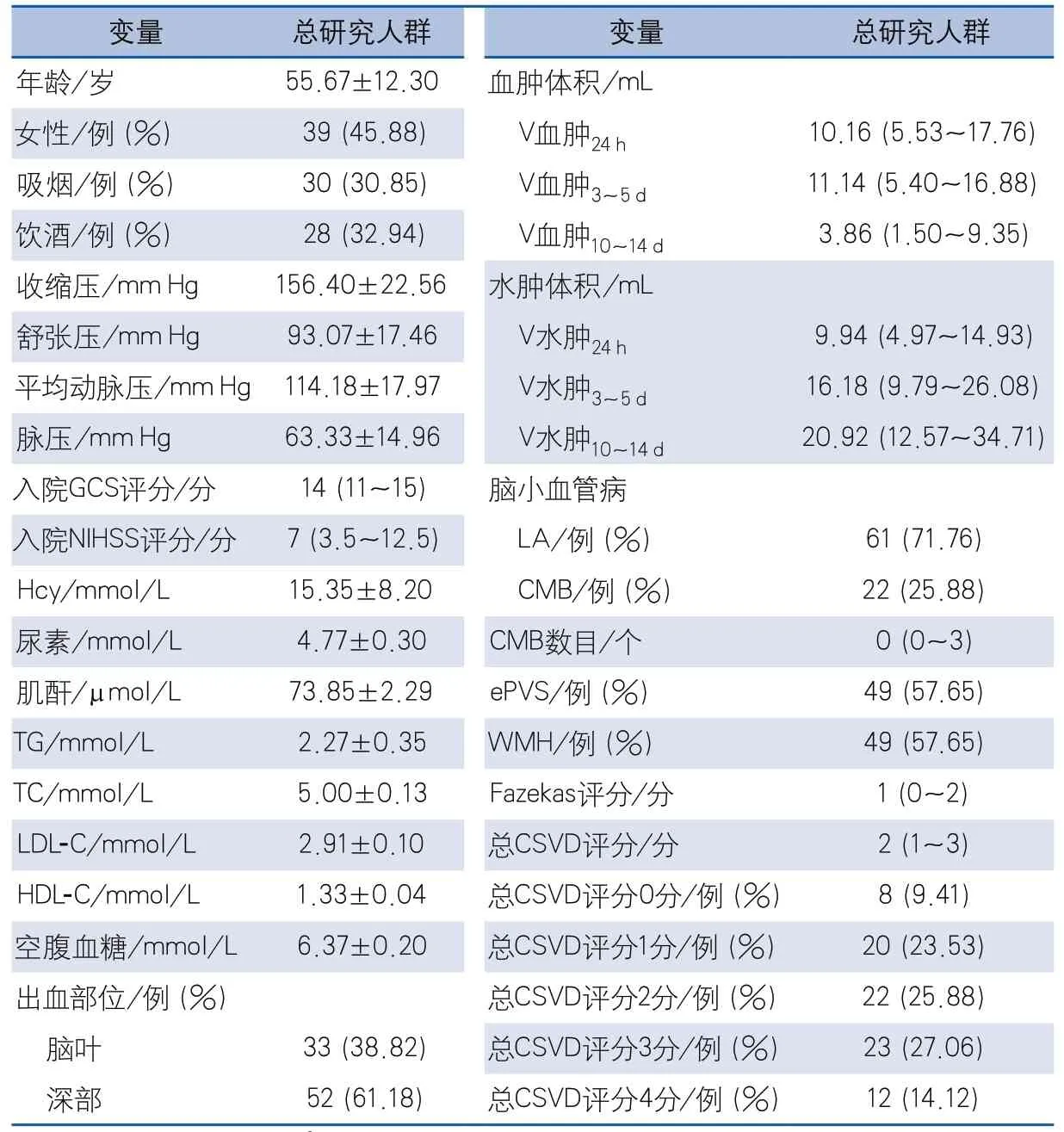
表1 研究人群的资料特征
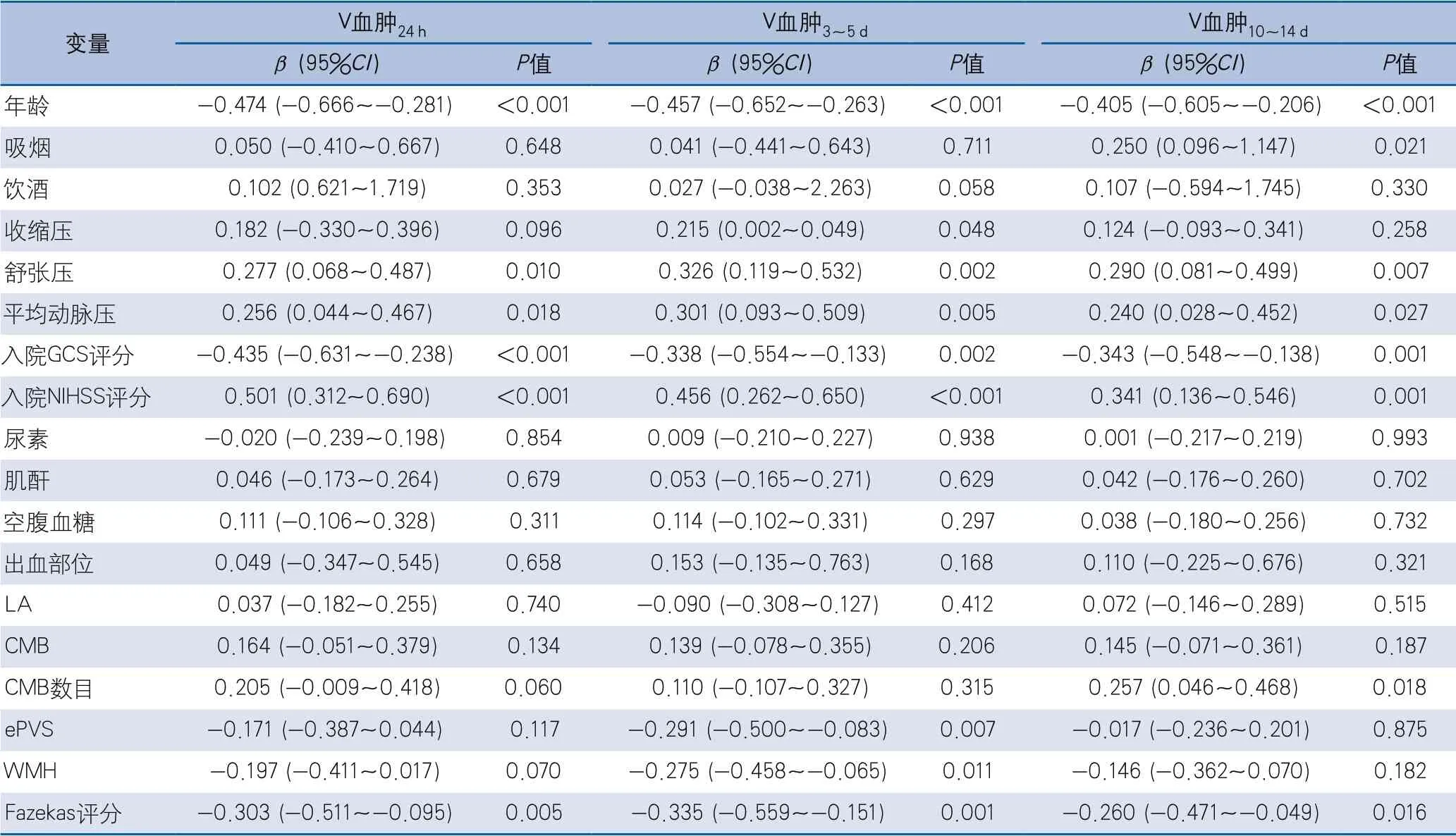
表2 不同时期血肿体积的单因素线性回归分析
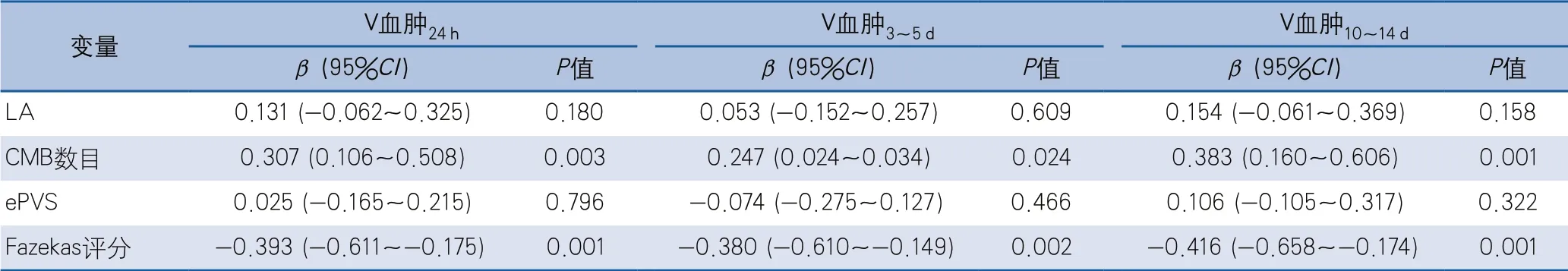
表3 不同时期血肿体积的多元线性回归分析
Spearman相关分析示,总CSVD评分与V水肿24 h不相关,与V水肿3~5d(r=-0.315,P=0.003)、V水肿10~14d(r=-0.242,P=0.026)负相关。在应用偏相关分析校正年龄、平均动脉压、入院GCS评分、入院NIHSS评分、同期血肿体积后,总CSVD评分与V水肿24 h不相关,与V水肿3~5d(r=-0.296,P=0.008)、V水肿10~14 d(r=-0.469,P<0.001)负相关(表6)。
3 讨论
在ICH与CSVD的关系研究中,鲜有研究综合分析总CSVD与ICH的关系,以及各亚型分别在疾病进展中的作用效力。目前多数研究认为脑叶CMB与较大的血肿体积有关,但关于深部CMB与血肿体积的关系研究尚存在争议。Lee等[8]认为伴有CMB的脑叶和壳核出血患者的血肿体积相对较大,但丘脑出血与CMB并不相关,认为CMB可能与血脑屏障损坏程度有关。Yang等[9]认为在脑叶出血患者中,伴CMB者的血肿体积更大,且CMB数目越多血肿体积越大;但对于深部出血患者,不伴CMB时的血肿体积反而更大,且CMB数目越多血肿体积越小。本研究显示在自发性ICH患者中CMB数目越多血肿体积越大,且独立于血压影响而存在。由于本研究MRI检查在ICH发生后进行,是多种因素致脑小血管顺磁性物质漏出表现为CMB
的存在而在ICH后促进血肿体积增加,还是因较大血肿易通过组织间隙向远处扩散而在影像学上表现为CMB,两者的因果关系尚不明确。

表4 不同时期水肿体积的单因素线性回归分析
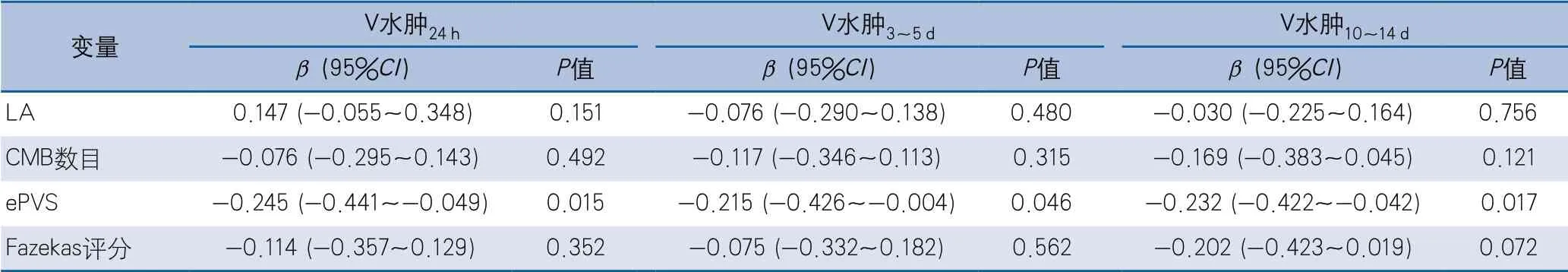
表5 不同时期水肿体积的多元线性回归分析
PVS属于脑组织内的正常解剖结构,通过对组织间液的引流作用维持着脑脊液循环系统的平衡[10]。目前研究认为ePVS的形成机制为:(1)主动扩增:血管透通性增加使组织间液增多,PVS通过自身调节主动增大[11];(2)被动扩增:①组织间液循环受阻:淀粉样蛋白沉积于皮层或脑膜动脉的管壁,导致组织间液流出障碍[12]而使PVS被动增大;②脑萎缩产生拉空现象:病理学研究提示ePVS与脑萎缩有关[13],而临床研究对于ePVS的严重程度与脑萎缩的相关性还存在争议[14-15]。陈思禹等[16]研究发现基底节上2/3区ePVS可能与高血压及血管通透性增加有关;白质区ePVS可能与脑淀粉样血管病变致组织间液引流障碍相关;基底节区下三分之一的ePVS可能与脑萎缩有关。Charidimou等[17]认为在自发性ICH患者中,半卵圆中心ePVS可能与脑淀粉样变性有关,而基底节区ePVS可能与高血压性脑血管病相关。本研究显示,与自发性ICH不伴ePVS者相比,伴ePVS者不同时期的水肿体积均相对较小,但两者血肿体积无差异。考虑其原因可能为:①ICH后多种原因使血管通透性增加,血脑屏障破坏,组织间液反常性增多,脑自动调节功能使PVS主动性扩增,从而促进脑水肿的吸收;②本研究样本量小不足以反映整体趋势。
研究发现WMH区域血管平滑肌细胞增生、血管壁增厚、血管管腔变窄,引起慢性、进行性的局部甚至弥漫性亚临床缺血,使血管自动调节功能受损导致脑血流量下降[18-19]。Lou等[20]对79例ICH患者进行回顾性研究后认为严重WMH与较大的血肿体积相关,且在较小程度上与3 d内血肿增长有关。但Boulouis等[21]对418例自发性ICH患者的研究发现WMH与血肿体积及其增长均不相关。本研究数据显示,WMH的Fazekas评分越低,不同时期的血肿体积越大。推测原因可能为:①脑血管管壁增厚、血管弹性降低,可能与ICH风险增加有关;②WMH区域处于慢性进行性亚临床缺血状态,脑血流灌注降低而引起相对较小的血肿体积;③长期缺血状态使细胞外液中有害产物增多,脑细胞长期处于预刺激状态而对出血后缺血缺氧状态相对耐受;④也可能为研究方法及研究规模差异所致,尚需进行多中心、大样本量研究。
目前认为CSVD是由微循环病理改变所致出血或缺血趋势的临床表现,两者具有相似的病理生理机制:小动脉硬化与栓塞[22]、血流动力学改变[23]、血脑屏障破坏[24]、炎症反应及氧化应激[25]等。CSVD总负荷综合评估脑小血管病的严重程度,可反映脑基础微循环情况。本研究显示总CSVD评分越高,3~5 d、10~14 d水肿体积越小,呈弱相关。因CSVD存在出血倾向及缺血倾向亚型,可能因各亚型的发生机制不同,该求和方式计算的总CSVD评分不能较好地评估脑水肿的严重程度。目前关于CSVD总负荷与ICH的研究较少,尚需更多大样本量研究继续探讨其关系。
本研究的局限性:①颅脑CT及MRI检查均在发病后进行,不能解释水肿与CSVD的因果关系;②未对各CSVD亚型部位以及血肿形态进行分析;③缺乏长期随访资料,以评估CSVD对长期功能预后及死亡率的影响;④为单中心、小样本量研究。
【点睛】多因素分析发现CMB数目越多,WMH的Fazekas评分越低,血肿体积越大。
