普通烟草ALMT 基因家族的鉴定与表达分析
2020-06-06李泽锋徐国云金静静金立锋郑庆霞陈千思刘萍萍周会娜
张 慧,李泽锋,徐国云,金静静,王 晨,翟 妞,金立锋,郑庆霞,陈千思,刘萍萍,周会娜
中国烟草总公司郑州烟草研究院,郑州高新技术产业开发区枫杨街2 号 450001
铝激活苹果酸转运蛋白(Al-activated malate transporter,ALMT)是一类普遍存在于植物中的且植物特有的膜蛋白,在植物有机酸的跨膜转运中起着至关重要的作用。有机酸在植物的初级代谢中具有重要作用,并参与植物对环境的适应性,如气孔运动、铝的耐受性、pH 的调节和胁迫响应等[1-4]。ALMT 作为阴离子通道能够释放苹果酸,在酸性土壤中这类蛋白能够螯合有毒的Al3+,从而保护植物根系的生长和吸收能力[4]。最早在耐铝小麦(ET8)根尖中分离得到了铝诱导表达的一个ALMT1 基因(TaALMT1)[5],是植物中克隆获得的第一个铝激活苹果酸转运基因。ALMT 蛋白大多定位于膜上(如细胞质膜、液泡膜等),其N 端通常包含多个跨膜结构域,参与Al3+激活的苹果酸的运输,C 端则包含一个位于膜外的疏水区,该疏水区是维持运输功能所必需,N 端的跨膜区和C 端的疏水区共同促进铝胁迫下苹果酸的运输[6-7]。
目前研究最多的拟南芥基因组中已鉴定出14个ALMT 蛋白,进化分枝上可分为4 个亚组[8-11]。第一亚组的AtALMT1 参与了Al3+的耐受,其表达受吲哚-3-乙酸、脱落酸、过氧化氢等处理的诱导[9]。第二亚组的AtALMT6 和AtALMT9 定位在保卫细胞的液泡膜上,与液泡中苹果酸的含量相关,同时,AtALMT9 还是个氯离子通道蛋白[9-10]。第三亚组的AtALMT12 定位于保卫细胞的质膜上,与气孔的关闭有关,电生理学研究表明该蛋白是个快速激活的阴离子通道。第四亚组AtALMT 蛋白的功能暂不明确。近年来,又有多个物种的ALMT 基因家族已被鉴定,如白杨基因组中含有22个ALMT基因[11],水稻基因组中含有8 个ALMT 基因,中国白梨基因组中有27 个ALMT 基因[12],苹果基因组中有25 个ALMT 基因[13],大豆基因组中有34 个ALMT 基因[14]等。但目前关于烟草ALMT 基因家族的研究未见报道。苹果酸是烟草的一种重要有机酸,对于烟草生长发育及烟叶产量、品质等都有重要影响[15]。另外,作为一种离子通道蛋白,ALMT 家族个别成员也被发现参与氯离子的吸收转运。为了探索烟草ALMT 家族成员是否参与了烟草氯离子的吸收转运,本试验采用盐处理后检测基因表达量的方法进行了初步筛选,并对烟草ALMT 基因家族进行了研究,旨在进一步了解烟草的重要功能基因并为实现烟草重要性状的分子调控提供参考。
1 材料与方法
1.1 材料和试剂
普通栽培烟草红花大金元(红大)于2017 年种植在国家烟草基因研究中心的植物生长室,培养条件为温度28 ℃、湿度70%~75%、光照16 h、黑暗8 h。采集盛花期烟株的根、茎和叶等,经液氮速冻后置于-80 ℃冰箱保存。氯盐(NaCl)处理的红大烟苗也种植于植物生长室,样品的处理和选取参照文献[16],即:待烟苗长至6 片真叶时,将根部用清水洗净,植株移至1/2 MS 液体培养基中继续培养,1周后向处理组培养液中加入NaCl 溶液至终浓度300 mmol/L,处理前、处理后3 d 及处理后7 d 分别选取根、茎和叶进行取样,与对照样品一起经液氮速冻后置于-80 ℃冰箱保存备用。每个处理设置3个独立重复,每个重复选择3 株长势一致的烟苗。
1.2 方法
1.2.1 烟草ALMT 基因鉴定
从TAIR(https://www.arabidopsis.org/)下载拟南芥ALMT 蛋白序列,从中国烟草基因组数据库4.0中比对搜索普通烟草红大的ALMT蛋白序列,并将其命名为NtALMT。利用ExPASy Proteomics Server(http://expasy.org/)对NtALMT 氨基酸序列进行分子量、等电点的预测分析;利用TMHMN Server v2.0(http://www.cbs.dtu.dk/services/TMHMM/)预 测NtALMT 蛋白的跨膜结构。
1.2.2 烟草ALMT 基因生物信息学分析
利用进化树分析软件MEGA7,采用NJ 法(参数:Poission correction、pairwise deletion 和1 000 次重复bootstrap),对NtALMT 蛋白序列进行进化树分析,分别从TAIR 网站和Rice Genome Annotation Project(http://eice.plantbiology.msu.edu/)网 站 下 载拟南芥ALMT 和水稻ALMT 蛋白序列,并对烟草、拟南芥和水稻的ALMT 蛋白进行进化树分析,所得进化树使用EvolView(http://www.evolgenius.info/evolview/)网站进行优化展示;利用MCScanX[17]对共线性基因进行鉴定;通过GSDS(http://gsds.cbi.pku.edu.cn/)对NtALMT 基因外显子-内含子结构进行可视化展示;利用MEME(http://meme-suite.org/tools/meme)对NtALMT 蛋 白 的 保 守motif 进行 分析,其中motif 的宽度在6~50 个氨基酸之间,且最大motif 数量为10。
1.2.3 烟草总RNA 提取及cDNA 制备
烟草总RNA 提取及cDNA 制备方法采用植物RNA 提取试剂盒(北京天根生物技术有限公司)和Roche 第一链cDNA 合成试剂盒(美国Roche 公司)按照文献[18]中的方法进行。
1.2.4 NtALMT 基因表达分析
根据中国烟草基因组数据库中的转录组数据,剔除在各组织、不同条件下均不表达的基因,其他NtALMT 基因用qPCR 技术分析其在不同组织及盐胁迫下的相对表达量。设计qPCR引物(表1),采用烟草的26S rRNA 基因作为内参,NtALMT 基因表达分析按照参考文献[19]进行,每个样品包括3次生物重复和3 次技术重复。反应体系为:10 μL 2×SYBR I Master,上下游引物各0.5 μL,50 ng 的cDNA,加ddH2O 至20 μL。PCR 反应程序为:94 ℃预变性30 s;94 ℃变性5 s,60 ℃退火20 s,72 ℃延伸20 s,45 个循环。反应结束后,根据循环阈值(CT值),用2-ΔΔCT方法计算NtALMT 基因的相对表达量。

表1 NtALMT 基因的qPCR 引物Tab.1 Primers of NtALMT genes for qPCR
1.2.5 氯离子含量测定
参照文献[18]测定烟草根、茎和叶片氯离子含量(质量分数)。在盐处理前、盐处理第3 天及盐处理第7天,分别对烟草叶片和根部进行取样,样品放置于105 ℃烘箱烘干过夜,使用混合型振荡研磨仪对其研磨至粉末状,称取约0.050 0 g(精确至0.1 mg)粉末,置于10 mL 5%(体积分数)醋酸中,30 ℃振荡萃取30 min,然后用定性滤纸过滤,滤液经稀释后用连续流动分析仪测定氯离子含量。
2 结果与讨论
2.1 NtALMT 基因序列鉴定
利用拟南芥ALMT 蛋白序列在中国烟草基因组数据库4.0 中比对搜索普通烟草红花大金元的ALMT 蛋白序列,得到30 个NtALMT 基因(表2),根据基因ID,依次命名为NtALMT1-NtALMT30。通过对这30 个基因的CDS 长度、基因组序列长度、氨基酸序列长度、等电点、分子量和跨膜结构数量等的分析,结果表明NtALMT 基因长度在2.03~24.95 kb之间,CDS 长度在1.27~2.3 kb 之间,蛋白质等电点在5.4~9.15 之间,蛋白分子量在46.3~84.9 kDa 之间,NtALMT 蛋白都具有4~6 个跨膜结构域。
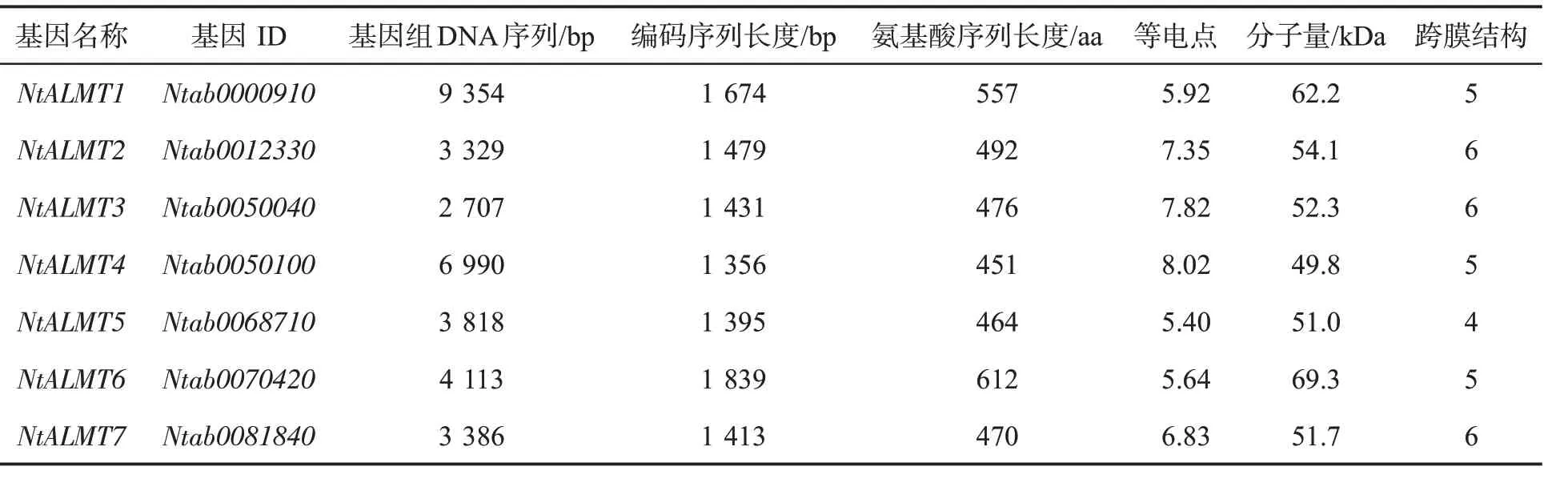
表2 NtALMT 基因序列特征Tab.2 Sequence characteristics of NtALMT genes

表2(续)
2.2 NtALMT 基因的染色体定位及共线性分析
利用Circos 软件对NtALMT 基因进行了染色体定位,见图1。由图1 可见,30 个NtALMT 基因中只有22 个能够定位在各染色体上,其余的8 个基因位于scaffold 上无法精确定位。其中,NtALMT18 和NtALMT26 定 位 在1 号 染 色 体 上,NtALMT12 和NtALMT8 定位在2 号染色体上,NtALMT11 定位在3号染色体上,NtALMT17 定位在4 号染色体上,NtALMT21 定 位 在6 号 染 色 体 上,NtALMT24 和NtALMT25 定 位 在7 号 染 色 体 上,NtALMT19 和NtALMT20 定 位 在8 号 染 色 体 上,NtALMT5 和NtALMT10 定 位 在10 号 染 色 体 上,NtALMT16 和NtALMT23 定位在11 号染色体上,NtALMT13 定位在12 号染色体上,NtALMT1 和NtALMT22 定位在14 号染色体上,NtALMT14 定位在18 号染色体上,NtALMT2 定 位 在19 号 染 色 体 上,NtALMT3 和NtALMT4 定位在21 号染色体上。
串联重复和片段重复是基因家族扩展的两种主要机制[19]。基于位置分布及共线性关系,NtALMT3/4、NtALMT18/26、NtALMT24/25、NtALMT19/20 可能发生了串联复制,而共线性基因对(如:NtALMT6/27、NtALMT12/21等)可能发生了片段复制。
2.3 NtALMT 蛋白的进化分析
首先使用MUSCLE 软件对30 个NtALMT 的序列进行比对,接着用MEGA7 软件中的邻接法生成ALMT 蛋白家族的系统进化树,见图2。由图2 中可见,NtALMT 蛋白家族的30 个成员可以分成5组。为了进一步明确NtALMT 进化分类,通过搜索数据库获得拟南芥ALMT(14 个)和水稻ALMT(8个)蛋白序列,将烟草、拟南芥、水稻ALMT 共52 条蛋白序列构建系统进化树。与拟南芥ALMT 基因类似,30 个NtALMT 蛋白中除了NtALMT26 外其余的29 个NtALMT 蛋白可分为4 个分支(Clade 1、2、3 和5)。值得注意的是大多数NtALMT 都在Clade 1中。不同物种ALMT 蛋白之间的高度保守表明了烟草ALMT 可能与其他物种ALMT 蛋白具有相似的功能。

图1 NtALMT 基因的染色体定位及共线性分析Fig.1 Chromosome location and synteny analysis of NtALMT genes
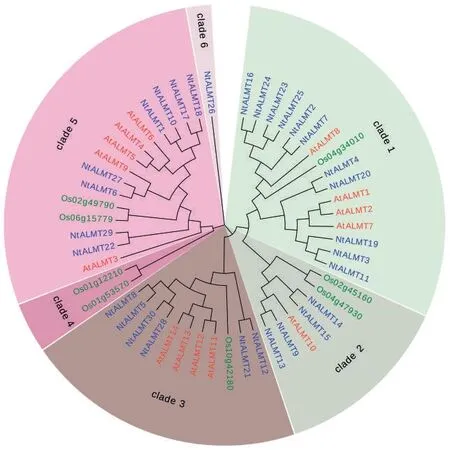
图2 植物ALMT 蛋白家族的进化分析Fig.2 Phylogenetic analysis of ALMT protein family from different plants
2.4 NtALMT 基因结构及保守结构域分析
基因的外显子/内含子结构是描绘一个基因家族的重要特征,在基因家族的进化中起着重要的作用[20]。在30 个NtALMT 基因中大部分基因(21 个)结构在进化过程中高度保守,都含有6 个外显子和5 个内含子,且各外显子的长度也很保守,但内含子长度变化多样。
利用MEME软件对30个NtALMT基因的保守Motif进行了分析,结果如图3所示。共鉴定了10个分布在ALMT 蛋白上的保守Motif,其中,Motif 1、Motif 2、Motif 3在除NtALMT26外的其他基因中都存在。ALMT基因高度保守的WEP 基序(Trp-Glu-Pro)位于Motif 5 中。同时,NtALMT 基因还被Motif 2 中的WAG残基分为N-端和C-端[21]。N-端由Motif 1、3、4、8 和10组成,包含5或6个跨膜结构,是离子运输通道并参与Al3+信号传导,而C-端则包含Motif 2、5、6、7 和9,其作用是调节ALMT 基因对Al3+的响应。

图3 NtALMT 基因结构及保守结构域分析Fig.3 Structures and conserved motifs of NtALMT genes
2.5 NtALMT 基因的表达分析
根据中国烟草基因组数据库中NtALMT转录组数据,30 个NtALMT 基因有11 个在各组织、各时期均无表达,这11 个基因分别是NtALMT1-NtALMT5、NtALMT7-NtALMT8、NtALMT11、NtALMT15、NtALMT23和NtALMT25。利用qPCR 检测其余19 个NtALMT 基因在栽培烟草根、茎和叶中的表达量(以根中基因表达量为1计算),只有14个基因在根茎叶中有表达(图4),其余的5个基因(NtALMT13-NtALMT14、NtALMT16、NtALMT29-NtALMT30)在根茎叶中未检测出表达。从图4 中可以看出,14 个根茎叶中能检测到的NtALMT基因大多数在茎中表达量较高,如NtALMT12、NtALMT19 和NtALMT24 分别在茎中表达量是根中的39 倍、18 倍、12 倍和10 倍。值得注意的是NtALMT28基因在叶片中的表达远远高于根部和茎部。在已经报道的ALMT家族成员中,TaALMT1等基因主要在根部行使功能进而使植物适应铝毒[5],烟草NtALMT 基因大多在茎中表达较高而在根部表达相对较低,这一现象的出现可能跟Al3+的诱导有关,一些基因可能在Al3+离子的诱导下根部表达才会增加更多。
2.6 NtALMT 基因在盐处理条件下的表达分析
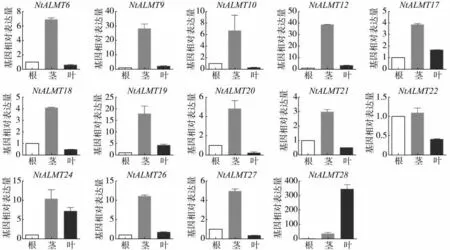
图4 NtALMT 基因在烟草不同组织中的表达分析Fig.4 Expression patterns of NtALMT genes in different tissues of tobacco
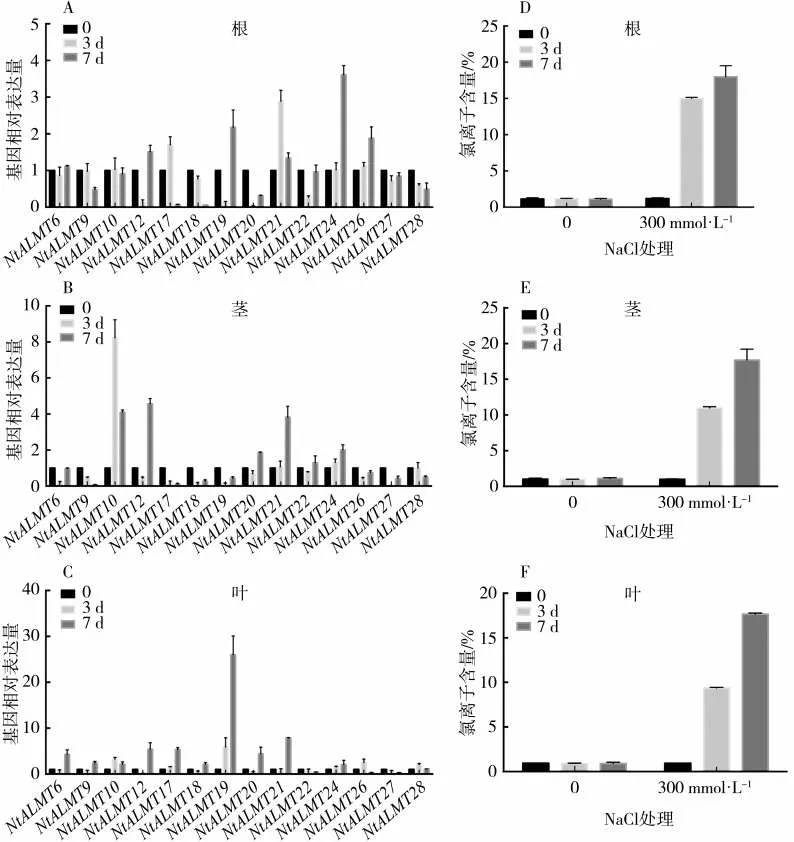
图5 NaCl 处理后NtALMT 基因在根茎叶中表达量的变化Fig.5 Expression levels of NtALMT genes in roots,stalks and leaves after NaCl treatment
利用qPCR 的方法检测上述NtALMT 基因在根、茎和叶中的表达变化情况,结果如图5(A~C)所示。从根部数据来看,盐处理7 d 后根部NtALMT24基因上调了3.6 倍;NtALMT21 基因在盐处理3 d 时表达量上调了2.9 倍,但随着时间推移表达量又有所下降。从茎部数据来看,NtALMT10 基因在盐处理3 d 时表达上调8 倍以上,但到处理7 d 时表达量又下降至对照组的4 倍左右;NtALMT12 和NtALMT21 两个基因在盐处理7 d 时表达量分别上升 了4.5 和3.8 倍;此 外,NtALMT9、NtALMT17、NtALMT18、NtALMT19 和NtALMT27 等5 个基因在盐处理后表达量明显下调。从叶部数据来看,NtALMT19 在盐处理7 d 时表达上调25 倍以上,NtALMT21 基因在盐处理7 d 时表达量上调了近8倍。结合3 个部位的基因表达情况可以看到,氯盐处理后,NtALMT12 基因在根茎叶中都表现出先降低后升高的表达模式,NtALMT21 和NtALMT24 在根茎叶中的表达量均有不同程度的上调,NtALMT27在根、茎和叶中的表达则受到不同程度的抑制。上述表达变化较大的基因中NtALMT10 与AtALMT9 在进化上相对较近、序列相似性较高,而AtALMT9 之前报道是一个氯离子通道,这也预示着NtALMT10可能有类似的功能。总之,这些结果表明,在高氯盐处理后NtALMT 基因在各组织中有不同程度的表达变化,暗示了这些基因可能参与了盐胁迫下氯离子的吸收转运。而具体参与氯离子转运的NtALMT基因及其机制还需进一步的试验验证。
根、茎和叶氯离子含量的测定结果如图5(D~F)所示,根和叶中氯离子含量在盐处理后显著升高。在盐处理3 d 时根部氯离子含量明显高于叶部氯离子含量,当盐处理7 d时根和叶中氯离子含量基本一致,说明此时根部氯离子向上运输达到最大值。从图5C 和图5F 中可以看到AtALMT19 在盐处理后叶片中的表达与氯离子含量变化一致,该基因是否参与烟草氯离子的吸收转运仍有待进一步研究。
3 结论
利用生物信息学方法从普通烟草基因组中鉴定出30 个ALMT 基因家族成员,这些成员的基因结构和蛋白质结构都相对保守,进化上与其他物种ALMT 家族基因类似,可分为5 个亚类。其中14 个NtALMT 基因在烟草根、茎和叶中均有表达,且在茎中的表达量较高,只有NtALMT28 基因在叶片中表达较高。氯盐胁迫下NtALMT10 在茎中、NtALMT19在叶中表达显著增加,暗示了其在盐胁迫及氯离子吸收转运中可能具有重要的作用。
