榆黄蘑菌丝体多糖提取工艺研究
2020-06-06张宝翠朱玉昌王应玲陈莉莉
张宝翠,朱玉昌,2,王应玲,陈莉莉,姜 宁,2*
(1.湖北民族大学 生物科学与技术学院,湖北 恩施 445000;2.生物资源保护与利用湖北省重点实验室(湖北民族大学),湖北 恩施 445000;3.湖北省地质局第二地质大队,湖北 恩施 445000)
榆黄蘑(Pleurotuscitrinopileatus)又称为金顶侧耳、玉皇蘑,属担子菌亚门、层菌纲、伞菌目、侧耳科、侧耳属,是珍贵的药食同源经济菌之一[1].具有多种生理药理活性物质[2-3],其中多糖是主要的活性成分之一[4],具有免疫调节[5]、抗氧化性[6]、抗炎[7]等生物活性.
药食同源真菌人工驯化有着悠久的历史,固体基质人工栽培与液体深层发酵相辅相成.采用深层发酵培养由于占地小、成本低廉、生产周期短且菌龄可保持高度一致,所以采用深层发酵获得药食同源真菌菌丝体,并进一步提取有效活性成分、对活性成分进行深层次研究已成为当今的热点[8-10].无论子实体还是菌丝体,食用菌多糖一般采用水浴醇沉法、超声辅助提取法、微波辅助提取法、蛋白酶辅助提取法等,各种提取方法各有优势.提高多糖得率除优化提取外,还可采用诱导菌丝体生长的方法[11].榆黄蘑多糖的提取工艺研究大多限于子实体,对榆黄蘑菌丝体多糖的提取及功能研究较少.本研究以榆黄蘑菌丝体为研究对象,对菌丝体多糖提取的工艺进行优化,为榆黄蘑的深层次开发利用提供试验依据.
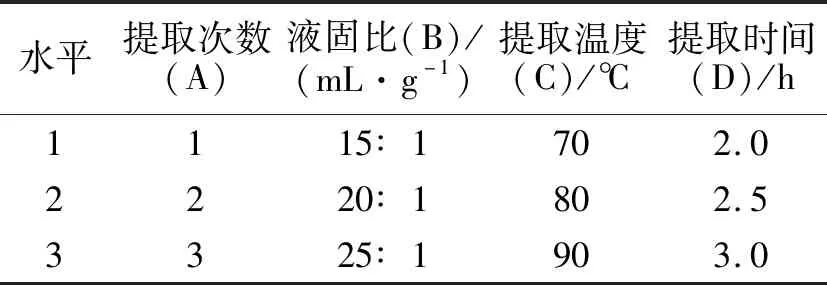
表1 正交试验因素水平表Tab.1 Factors and levels of orthogonal test
1 材料与方法
1.1 材料与试剂
榆黄蘑(Pleurotuscitrinopileatus)菌种购自江苏省江都天达食用菌研究所,由生物资源保护与利用湖北省重点实验室(湖北民族大学)保存.蒽酮、VB1、KH2PO4,国药集团化学试剂有限公司;无水乙醇,武汉市中天化工有限责任公司;其余试剂均为分析纯.
1.2 培养基
菌种活化培养基:马铃薯 20%,葡萄糖2%,磷酸二氢钾0.1%,琼脂2%,pH值自然,100 mL蒸馏水.
种子液培养基:菌种活化培养基不加琼脂,分装于250 mL锥形瓶,装液量为100 mL,无菌封口膜封口,用于制备深层发酵种子液.
深层发酵培养基:1%葡萄糖,3%黄豆粉,3%可溶性淀粉,0.1%磷酸二氢钾,0.01%维生素B1,pH值自然,100 mL蒸馏水.
1.3 仪器与设备
BSD-YX2200智能精密摇床,上海博讯实业有限公司;YGF300/50L发酵罐,上海洋格生物工程设备有限公司;TU-1810型紫外-可见分光光度计,北京普析通用仪器有限责任公司.
1.4 试验方法
1.4.1 种子液及菌丝体的制备 将冻存菌种接入平板活化培养基,28 ℃培养10 d后,无菌条件下,用直径0.5 cm打孔器打孔菌种平板,接入液体种子液培养基中,150 r/min 26 ℃震荡培养5~7 d.再将种子液接种于发酵罐中发酵,温度为26 ℃,接种量为10%,DO 40%~60%,150 r/min培养7 d.将培养好的菌丝体用4层纱布清洗过滤,真空冷冻干燥,粉碎过60目筛,备用.
1.4.2 葡萄糖标准曲线的绘制 采用蒽酮-硫酸比色法[12]测多糖含量.以葡萄糖的质量浓度为横坐标,吸光度为纵坐标,绘制葡萄糖标准曲线.

1.4.4 单因素试验 ①液固比对榆黄蘑菌丝体多糖得率的影响.称取榆黄蘑菌丝体粉末,分别按液固比5∶1、10∶1、15∶1、20∶1、25∶1(mL/g)加入蒸馏水70 ℃浸提2 h,3 500 r/min离心20 min,取上清.按1.4.3操作测多糖含量,计算得率.②提取时间对榆黄蘑菌丝体多糖得率的影响.称取榆黄蘑菌丝体粉末,按液固比15∶1(mL/g)加入蒸馏水,70 ℃分别浸提1.0、1.5、2.0、2.5、3.0 h,3 500 r/min离心20 min,取上清.按1.4.3操作测多糖含量,计算得率.③提取温度对榆黄蘑菌丝体多糖得率的影响.称取榆黄蘑菌丝体粉末,按液固比15∶1(mL/g)加入蒸馏水,分别在40、50、60、70、80、90 ℃浸提2 h,3 500 r/min离心20 min,取上清.按1.4.3操作测多糖含量,计算得率.④提取次数对榆黄蘑菌丝体多糖得率的影响.称取榆黄蘑菌丝体粉末,按液固比15∶1(mL/g)加入蒸馏水70 ℃浸提2 h,3 500 r/min离心20 min,取上清.残渣按上述方法再分别提取1、2、3、4次,合并提取的上清液,按1.4.3操作测多糖含量计算得率.
1.4.5 正交试验及验证 根据单因素试验结果,采用L9(34)正交表进行正交试验,因素水平设计见表1.
根据正交试验结合方差的结果确定提取最优组合,设置3个平行组,测定多糖得率,验证结果可靠性.用SPSS和origin 8.0软件对数据进行处理,数据多重比较采用Tukey法.
2 结果与分析
2.1 葡萄糖标准曲线的绘制
葡萄糖糖标准溶液的质量浓度与吸光度的关系,如图1.葡萄糖在0~80 μg/mL的范围内,R2=0.999 5,回归方程为y=6.908 4x-0.004 3(y为吸光度,x为葡萄糖质量浓度).
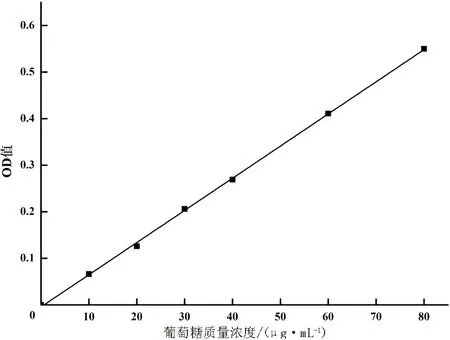
图1 葡萄糖标准曲线Fig.1 Standard curve of Glucose
2.2 单因素试验结果
2.2.1 液固比对榆黄蘑菌丝体多糖得率的影响 液固比对榆黄蘑菌丝体多糖得率有影响(图2),液固比5∶1(g/mL)和10∶1(g/mL)时,多糖得率无显著性差异.但在10∶1(g/mL)升至20∶1(g/mL)时,菌丝体多糖得率不断提高.当液固比大于20∶1(g/mL)后,菌丝体多糖得率开始下降.这是因为随着溶剂用量的增加,多糖有效溶出增大,但当液固比达到一定程度时,多糖已基本溶出,不会继续增大,且随着提取液体积的增大,使提取损耗加大反而使得率有所下降.根据单因素试验结果,选择液固比15∶1、20∶1、25∶1(g/mL)3个水平进行正交试验研究.
2.2.2 提取时间对榆黄蘑菌丝体多糖得率的影响 随着时间的增加,菌丝体粗多糖得率不断升高,在2.5 h后时得率增加不明显,反而有减少趋势,这说明在一定范围内增加浸提时间,多糖的溶出度增大,但是到达一定程度时,物料中多糖与溶剂中多糖含量已达到稳定状态,同时杂质也可能溶出,致使多糖得率下降(图3).因此,选择2.0、2.5、3.0 h三个水平进行正交试验研究.

2.2.3 提取温度对榆黄蘑菌丝体多糖得率的影响 提取温度对榆黄蘑菌丝体多糖得率的影响结果如图4所示,在40~60 ℃时,由于温度较低,分子运动速率缓慢,溶质溶出不充分,多糖得率变化不明显.在60~90 ℃时菌丝体多糖得率不断升高,因为温度的升高,细胞分子运动速率提高,使得多糖扩散、溶出速率提升,因此多糖的得率提高.但当温度超过80 ℃后,多糖得率不再显著增加,这是因为温度过高会使多糖结构遭到破坏.多糖得率在80 ℃与90 ℃条件下无显著性差异,因此,选择70、80、90 ℃三个水平进行正交试验研究.
2.2.4 提取次数对榆黄蘑菌丝体多糖得率的影响 提取次数会影响榆黄蘑菌丝体多糖得率(图5),提取次数的增加会使多糖得率不断升高,但当浸提次数超过4次时,多糖得率反而有所下降.这说明浸提3次时,多糖已能够充分溶出,浸提次数过多,反而使得其他水溶性物质的溶出,也会影响多糖得率.因此,选择前3个水平进行正交试验研究.
2.3 正交试验与验证结果分析
根据正交试验结果(表2)可知,影响榆黄蘑菌丝体多糖提取的主次因素为A>C>D>B,最优组合是A3B3C3D3,即提取3次、液固比25∶1(mL/g)、提取温度90 ℃、提取时间3 h.根据方差分析结果(表3)可知,提取次数与提取温度对多糖得率有极显著的影响(P<0.01),提取时间对多糖得率有显著的影响(P<0.05),液固比对多糖得率无显著影响.根据F值大小得出影响菌丝体多糖主次因素为A>C>D>B,这与极差分析结果相同.由于极差分析,B3与B1相差仅0.56,考虑降低能耗,节约成本,液固比确定为B1,即最优条件为A3B1C3D3.
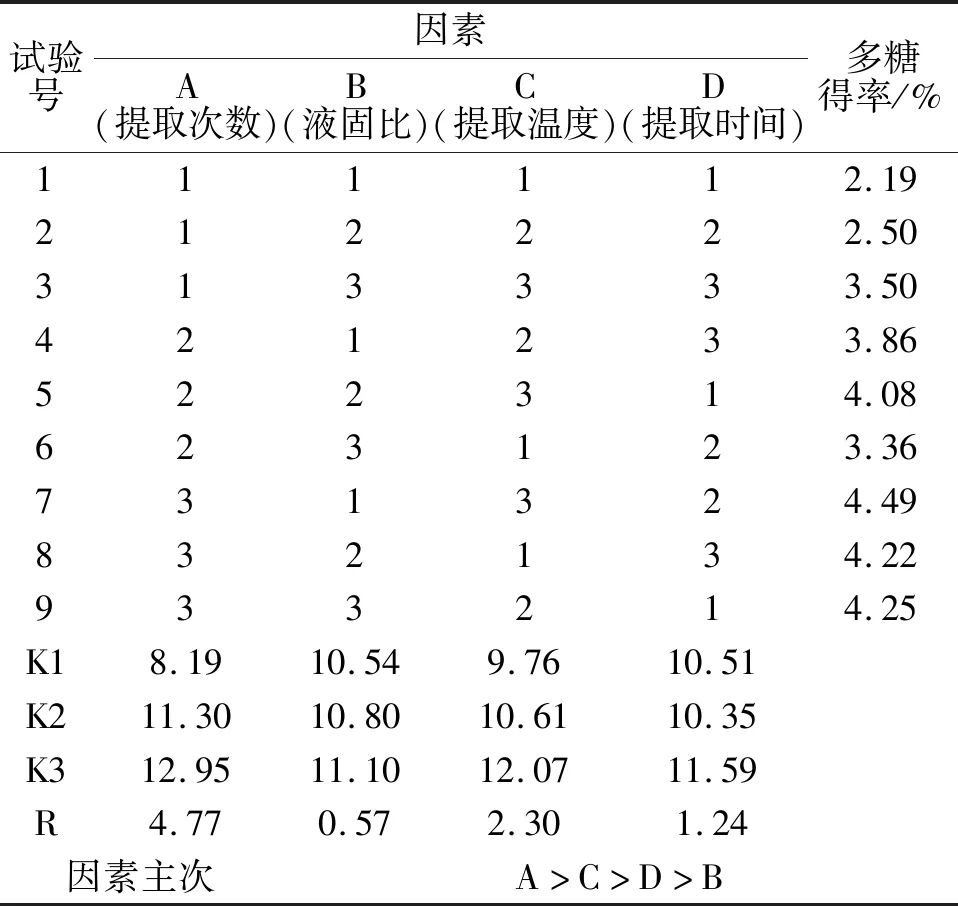
表2 正交试验结果Tab.2 Results of orthogonal test
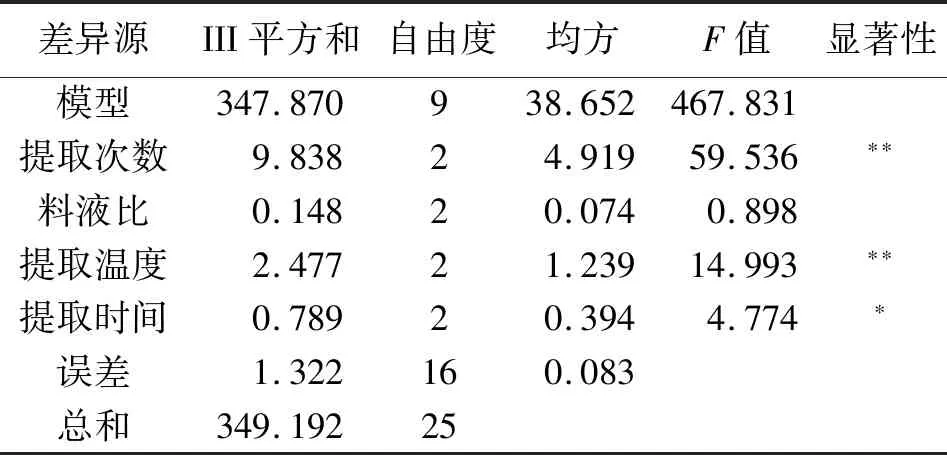
表3 正交试验结果方差分析Tab.3 Analysis of variance of results of orthogonal test
注:*表示P<0.05;**表示P<0.01.
根据最优结果A3B1C3D3,即提取3次、液固比15∶1(mL/g)、提取温度90 ℃、提取时间3 h,对榆黄蘑菌丝体多糖提取进行验证试验,多糖提取得率达4.55%,结果表明该工艺稳定可靠.
3 讨论
水提醇沉法已广泛应用于各类真菌多糖的提取[12-13],衣铭慧等[14]与石堃等[15]均优化了榆黄蘑子实体多糖提取工艺,虽然得率达到8.0%以上,但由于栽培子实体工艺要求高、占地大、周期长等导致生产成本显著高于菌丝体生产,所以多糖的生产成本依然高于本实验.蔡德华等[16]曾采用超声辅助提取法优化了榆黄蘑新鲜菌丝体多糖提取工艺,得到的优化工艺:超声波破壁时间12 min,提取时间4 h,提取温度70 ℃,菌丝密度250 mg/mL(鲜重),得率为2.99%.与上述研究相比,本研究采用的是烘干后的菌丝,在工业化生产上更具有指导意义,虽然提取温度较高,但减少了设备投入,缩短了提取时间,提高了得率.
本研究对榆黄蘑菌丝体多糖的提取工艺进行了研究,优化了水浴提取的工艺条件.确定了榆黄蘑菌丝体多糖的最佳提取工艺,为榆黄蘑的进一步开发利用提供了实验依据.
