miR-485-5p在前列腺癌组织中表达的临床意义及对前列腺癌细胞生物学行为的影响①
2020-06-06胡海峰汪自力王云汉
胡海峰 杨 进 陈 林 汪自力 王云汉
(成都大学附属医院泌尿外科,成都 610081)
前列腺癌(prostate cancer,PC)是临床常见泌尿系统恶性肿瘤,其病死率在各类泌尿系统恶性肿瘤中排第二,给患者的生命安全造成巨大威胁[1]。随着医疗技术的不断发展,目前PC的治疗方案可明显提高患者生存率,但复发率依然很高,且对于晚期PC患者尚缺乏有效治疗手段[2]。因此,寻找更有效的治疗方案提升PC患者生存率已成为医学领域关注的重点。microRNAs(miRNAs)是一种内源性非编码RNA,在转录后可通过调控靶基因的表达,在肿瘤细胞生长发育、增殖分化及肿瘤发生与发展中发挥重要作用[3]。
miR-485-5p是miRNAs家族成员之一,为新发现的抑癌基因在多种肿瘤细胞中低表达,与胃癌、肝癌、乳腺癌等多种恶性肿瘤的发生与发展显著相关,因此miR-485-5p具有成为恶性肿瘤防治新靶点的潜质[4,5]。但是,目前鲜见miR-485-5p在PC组织中表达及其生物学功能的研究。为此,本研究分析PC组织及细胞中miR-485-5p的表达,并通过细胞实验探究miR-485-5p对PC生物学行为的影响,阐述miR-485-5p在PC防治中的应用价值。
1 材料与方法
1.1材料
1.1.1病理组织及细胞系 收集本院病理科2014年4月至2018年5月存档的石蜡包埋PC组织及其匹配癌旁组织(距离手术边缘>2 cm)45例。所有患者均经病理学诊断为PC,术前均未接受任何形式放化疗治疗。人PC细胞系LNCaP、22RV1、PC-3 来源于上海 ATCC 细胞库。
1.1.2实验试剂及仪器 DEME细胞培养基(美国Life Technology公司);胰酶、胎牛血清(美国ScienCell公司);TRIzol 试剂盒(美国 Invitrogen 公司);miR-485-5p类似物(mimic)及阴性对照空载体质粒(上海吉玛生物公司);两步法RNA提取试剂盒(Fermentas公司);恒温细胞培养箱(美国Thermo公司);酶标仪(上海赛默飞世尔公司);离心机(意大利A.L.C 公司)、流式细胞仪(美国FCMXBD公司);光学显微镜(日本Olympus公司)。
1.2方法
1.2.1RT-PCR检测miR-485-5p表达 采用TRIzol 试剂盒提取PC组织、癌旁组织及各PC细胞系中总RNA,逆转录成cDNA。选择待检测基因的合适上下游引物,以cDNA为模板,PCR扩增待检测基因。以GAPDH为内参,扩增结束后绘制溶解曲线,采用2-ΔΔCt计算各组组织及细胞中miR-485-5p相对表达量。
1.2.2细胞转染 将PC细胞系中miR-485-5p表达最低的细胞系(LNCaP)分散于细胞培养基,接种于6孔板,调整细胞密度为2×106个/孔,置于恒温细胞培养箱中孵育。将细胞分为miR-485-5p mimic组(miR组)和阴性对照组(NC组)。转染前24 h接种细胞,将miR-485-5p mimic转染于miR组细胞中,将对照空载质粒转染至NC组细胞,按照转染试剂盒操作步骤进行转染。
1.2.3MTT实验检测细胞增殖 取处于对数生长期的miR组及NC组细胞,制备密度为1×105个/ml的细胞悬液,接种于96孔板,200 μl/孔,每组设置6个复孔,置于恒温细胞培养箱中孵育,分别培养24、48、72 h后,加入15 μl MTT溶液(质量浓度为5 mg/ml),37℃孵育4 h。弃上清,各孔加入100 μl DMSO溶解MTT结晶,轻轻振荡,10 min后酶标仪测OD值(λ=490 nm),并计算细胞增殖率。
1.2.4流式细胞术检测细胞凋亡 细胞转染24、48及72 h后,采用PBS清洗细胞,离心后去上清。按照试剂盒说明书操作:用缓冲液重悬细胞,加入5 μl Annexin V-FITC 染色,并于暗处室温孵育15 min,再加入5 μl PI染色,静置5 min后用流式细胞仪检测其凋亡情况。每组重复3次计算平均值。
1.2.5划痕实验检测细胞迁移 细胞转染24、48及72 h后,收集各组处于对数期生长的LNCaP细胞,置于恒温细胞培养箱(37℃、5%CO2)中孵育,待细胞融合率达到90%时,采用枪头(200 μl)垂直于6孔板底部做横线划痕,倒置荧光显微镜观察划痕区域宽度并拍照。随后继续置于培养箱(37℃、5%CO2)中孵育24 h后于倒置荧光显微镜下观察划痕区域宽度变化并拍照。采用ImageJ软件测量划痕区域宽度,并计算各组细胞相对应的细胞划痕愈合率,每组细胞设置3个复孔,取平均值。
1.2.6Transwell实验检测细胞侵袭 取100 μl稀释完成的基质胶均匀覆盖于Transwell小室底部。细胞转染24、48及72 h后,分别取各组对数期生长的LNCaP细胞,胰酶消化后将细胞浓度调至2×105个/ml。取100 μl细胞悬液加于上室,下室加入等量含血清培养基,培养48 h后取出,按照说明书进行固定、染色,膜的下室面表面细胞为侵袭细胞,显微镜下拍照、计数,共计数5个视野,取平均值。

2 结果
2.1PC组织及细胞中miR-485-5p表达 PC组织中miR-485-5p相对表达量明显低于癌旁组织(Control)(P<0.05,图1)。在3种PC细胞系中,LNCaP细胞中miR-485-5p相对表达量最低,将其作为后续细胞学实验的细胞株。
2.2miR-485-5p表达水平与PC患者病理参数的关系 PC组织中miR-485-5p相对表达量为0.62±0.09,以此为分界点,将45例PC组织分为高表达组(18例)及低表达组(27例)。收集两组患者的各项临床资料,发现PC组织中miR-485-5p低表达与淋巴结转移、高临床病理分级(G3)及高TNM分期(Ⅲ+Ⅳ)相关(P<0.05)。见表1。
2.3转染对LNCaP细胞miR-485-5p相对表达水平及增殖抑制的影响 转染24 h、48 h及72 h后miR组miR-485-5p相对表达量均明显高于NC组(P<0.05,图2A)。随着孵育时间延长,miR组细胞抑制率明显升高(P<0.05),且各时间点miR组细胞抑制率明显高于NC组(P<0.05,图2B)。
2.4转染miR-485-5p对LNCaP细胞凋亡的影响 随着孵育时间延长,miR组细胞凋亡率明显升高(P<0.05),且各时间点miR组细胞凋亡率明显高于NC组(P<0.05,图3)。
2.5转染miR-485-5p对LNCaP细胞迁移的影响 随着孵育时间延长,miR组及NC组细胞划痕愈合率明显升高(P<0.05),且各时间点NC组划痕愈合率明显高于miR组(P<0.05,图4)。
2.6转染miR-485-5p对LNCaP细胞侵袭的影响
表1 miR-485-5p表达与PC患者病理参数的关系
Tab.1 Relationship between miR-485-5p expression and pathological parameters of patients with PC
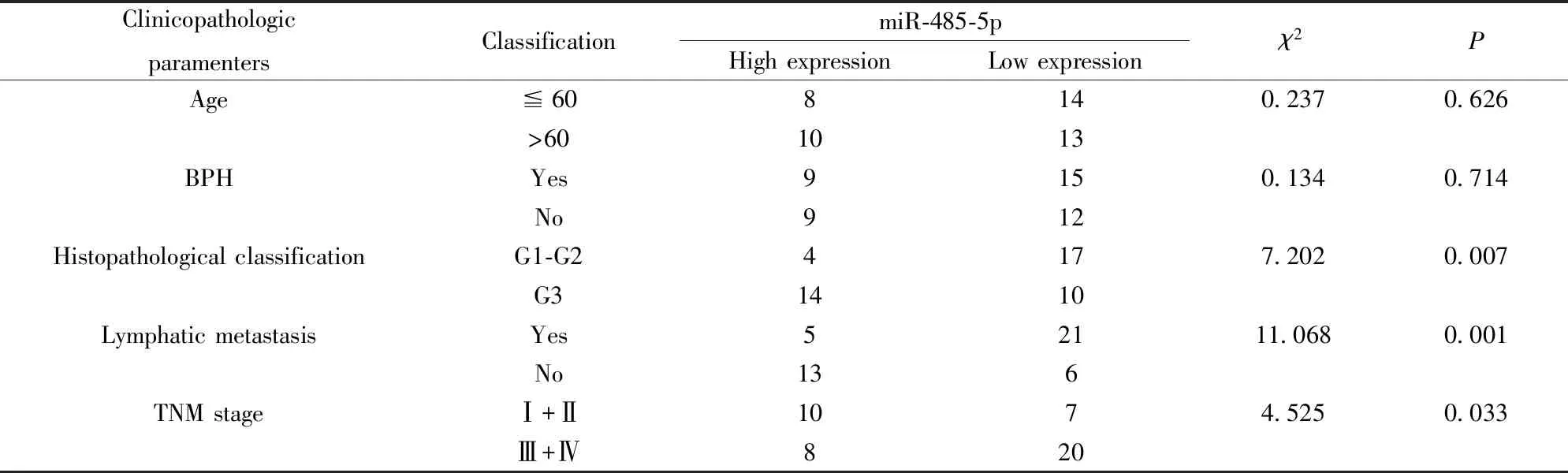
ClinicopathologicparamentersClassificationmiR-485-5pHigh expressionLow expressionχ2PAge≦608140.2370.626>601013BPHYes9150.1340.714No912Histopathological classificationG1-G24177.2020.007G31410Lymphatic metastasisYes52111.0680.001No136TNM stageⅠ+Ⅱ1074.5250.033Ⅲ+Ⅳ820
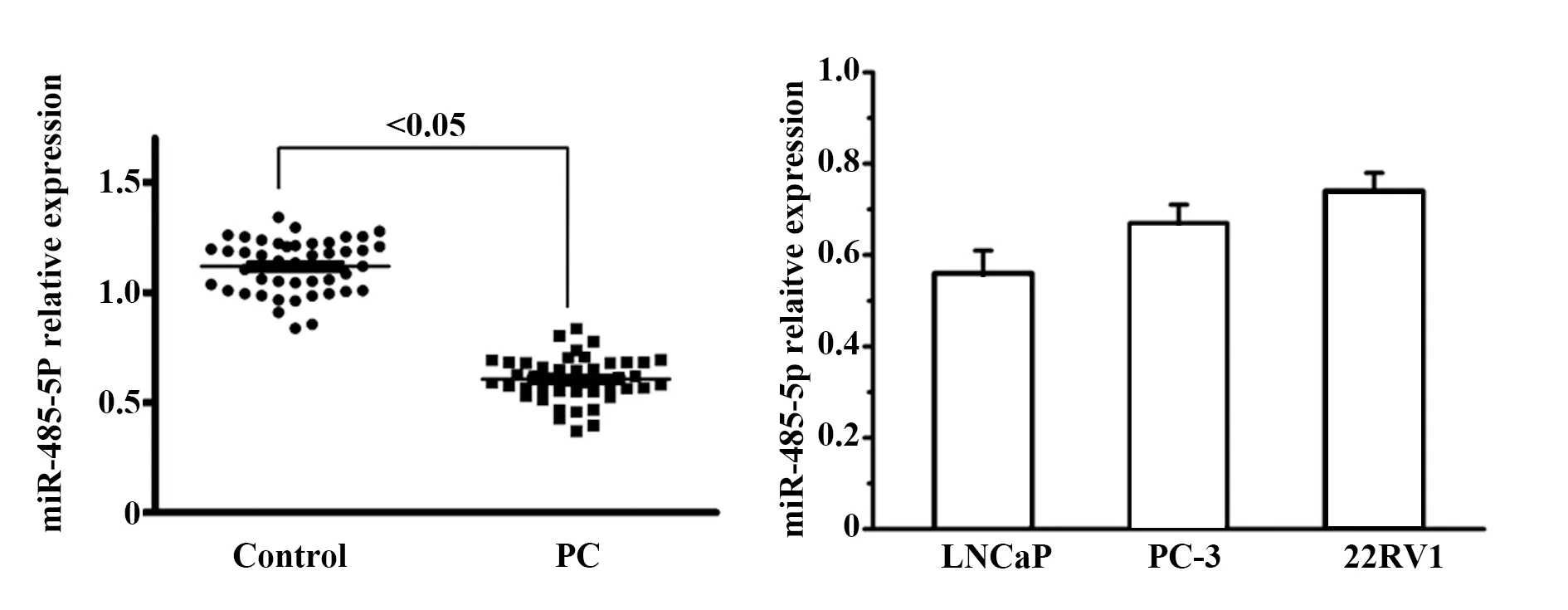
图1 PC组织及细胞中miR-485-5p的表达Fig.1 miR-485-5p expressions in PC tissues and cells
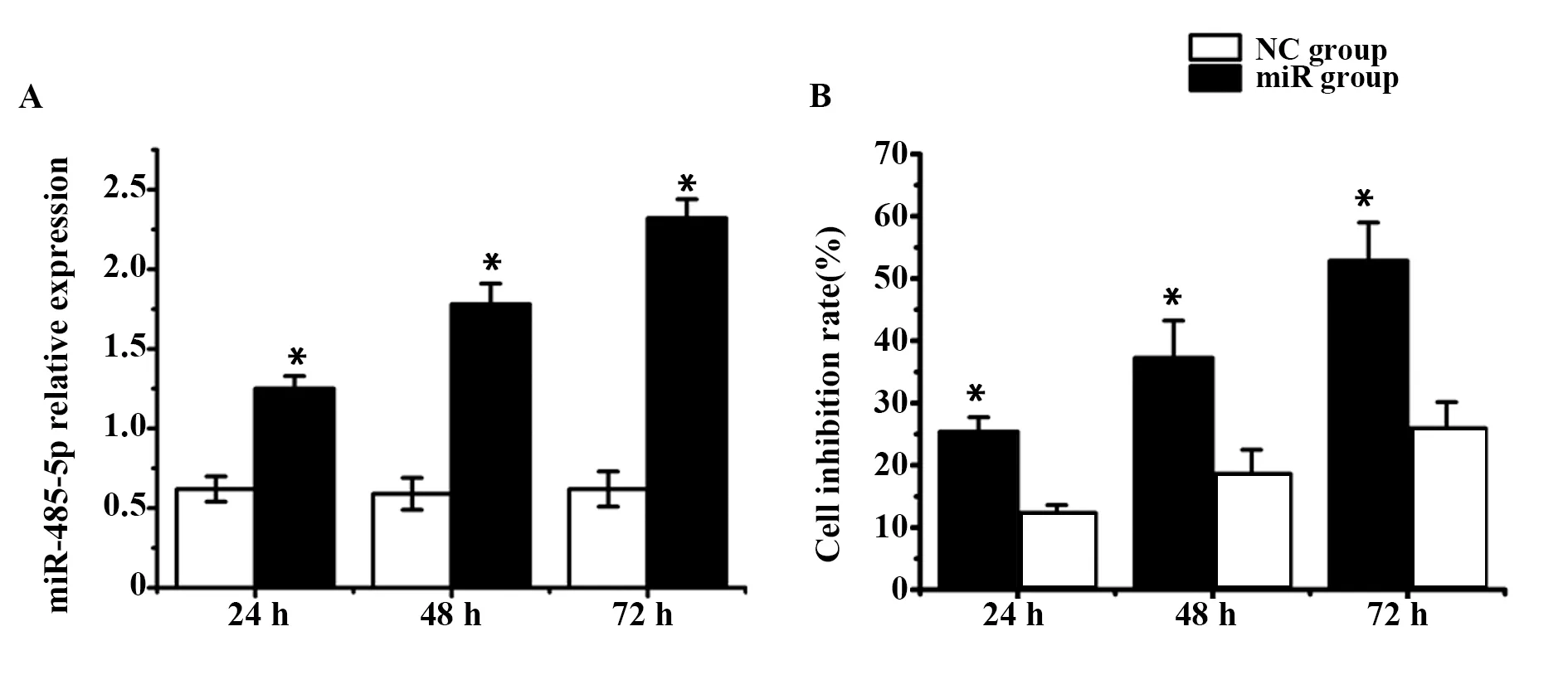
图2 转染不同时间后各组细胞miR-485-5p相对表达量比较及增殖抑制率比较Fig.2 Comparison of relative expression of miR-485-5p and inhibition rates of cells in each group after transfection for different timeNote: Compared with NC group,*.P<0.05.
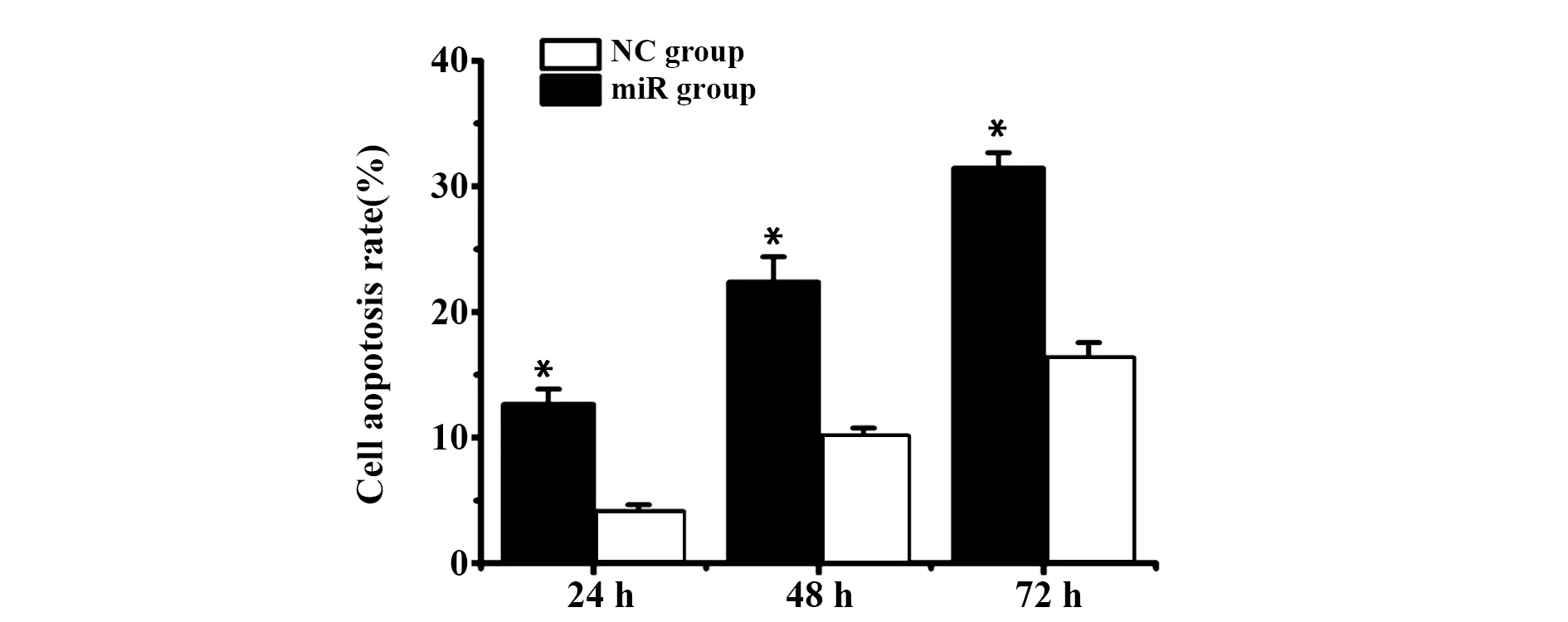
图3 转染不同时间后各组细胞凋亡率比较Fig.3 Comparison of apoptosis rates of cells in each group after transfection for differnt timeNote: Compared with NC group,*.P<0.05.

图4 各组细胞划痕愈合率比较Fig.4 Comparison of cell scratch healing rates in each groupNote: Compared with NC group,*.P<0.05.

图5 各组细胞侵袭细胞数比较Fig.5 Comparison of number of invasive cells in each groupNote: Compared with NC group,*.P<0.05.
随着孵育时间延长,miR组及NC组侵袭细胞数增多(P<0.05),且各时间点NC组侵袭细胞数明显高于miR组(P<0.05,图5)。
3 讨论
PC的发生及发展是十分复杂的生物学过程,有多种基因参与调节。既往研究证实,miRNA可用于PC的诊断与治疗,异常表达miRNA谱可用于预测PC患者术后复发情况,从PC组织中异常表达的miRNA入手可能有助于阐明PC的发病机制,找到新的治疗靶点[6,7]。miR-485-5p是新发现的抑癌基因,可通过调节靶向基因发挥其生物学功能,参与乳腺癌、肝癌、胃癌等多种恶性肿瘤的发生发展[8]。Sun等[9]研究发现,miR-485-5p在肝癌细胞中可通过靶向结合STC2下调其蛋白表达水平,进而发挥抑制肝癌细胞增殖的作用。Wang等[10]通过细胞实验证实,miR-485-5p在乳腺癌细胞中低表达,上调miR-485-5p表达水平可明显抑制乳腺癌细胞的侵袭及迁移。本研究中,相较于癌旁组织,PC组织中miR-485-5p表达量明显降低,提示miR-485-5p与PC的发生发展相关。Yang等[11]也通过对比研究证实PC组织中miR-485-5p表达量明显低于正常前列腺组织,与本研究结果一致。为探究miR-485-5p在PC防治中的价值,本研究进一步分析miR-485-5p与PC患者各项病理参数的关系,结果显示miR-485-5p表达水平与淋巴结转移、临床病理分级及TNM分期相关,存在淋巴结转移、临床病理分级高及TNM分期晚的患者miR-485-5p表达水平明显降低,提示miR-485-5p可能通过参与PC恶变、生长及转移,发挥抑癌作用。
增殖能力增强、凋亡减少及迁移与侵袭能力的提升是肿瘤常见的生物学特性,亦是肿瘤生长、复发及转移的基础[12]。多项研究表明,miRNA在参与肿瘤细胞的发生发展过程时,可调节肿瘤细胞的各项生物学行为,包含增殖、凋亡、侵袭及迁移等[13]。Kang等[14]研究显示,miR-485-5p在胃癌细胞中的表达量明显降低,其可通过负向调控FLOT1抑制胃癌细胞的增殖、侵袭及转移。而Wu等[15]研究证实,miR-485-5p可通过负向调控FZD7进而抑制黑色素瘤的侵袭及增殖,且其过表达后可明显抑制Wnt信号通路,从而发挥抑癌作用。目前,miR-485-5p对PC细胞各类生物学行为的影响尚不明确。本研究所检测的3类PC细胞系中LNCaP细胞miR-485-5p表达量最低,因此本研究选用LNCaP细胞,通过各项生物学细胞实验探究miR-485-5p对PC细胞生物学行为的影响。转染后,miR组细胞miR-485-5p表达量明显高于其他组,说明miR-485-5p转染成功,可用于后续实验。研究发现,转染miR-485-5p可明显抑制LNCaP细胞增殖,并诱导细胞凋亡,说明miR-485-5p在PC患者中的抑癌作用可能是通过抑制癌细胞增殖并诱导凋亡实现的。Yang等[16]研究发现,miR-485-5p可直接与PC细胞中RBM5的3′UTR结合,通过提升RBM5的表达量抑制PC细胞增殖,并促进其凋亡这可能是miR-485-5p抑制PC发展的作用机制。国内外大量研究证实,侵袭及转移是影响肿瘤患者复发及生存期长短最主要的因素,抑制肿瘤细胞的侵袭及迁移是降低复发率、延长生存时间的关键[17-19]。本研究对各PC患者的临床资料分析结果显示,低表达miR-485-5p的患者发生淋巴结转移的几率明显增大,提示miR-485-5p与PC细胞发生转移密切相关,而提升miR-485-5p表达可显著抑制转移的发生。此外,本研究发现细胞转染miR-485-5p后,其细胞侵袭及迁移能力均明显降低,进一步说明miR-485-5p可抑制PC细胞的侵袭及迁移。Yang等[20]研究显示,通过提升PC细胞中miR-485-5p的表达,可明显抑制细胞增殖,并降低其发生转移的概率,与本研究结果一致。研究结果表明miR-485-5p具有抑制PC细胞增殖、侵袭及迁移,并促进凋亡的作用,可抑制肿瘤的发生发展,可能作为一种抑癌基因在PC中发挥重要的生物学作用。
综上所述,PC组织及细胞中miR-485-5p表达水平降低,且与病理分级、TNM分期及淋巴结转移等临床病理参数相关,采用细胞转染技术上调miR-485-5p水平可明显抑制PC细胞增殖、迁移及侵袭,并诱导其凋亡,在PC的防治中具有较大的潜能。但是,研究显示miRNA并不具有蛋白质编码功能,是通过靶向下游基因发挥其生物学功能。因此,本研究中只是初步探讨miR-485-5p在PC中的表达及生物学功能,而其具体的下游靶基因及相应的作用机制将作为后续研究。
