体外发酵荔枝皮多酚对多酚抗氧化能力和肠道菌群的影响
2020-06-06黄小霞李晓乐杨瑞丽
黄小霞 - 李晓乐 - 李 武 杨瑞丽 -
(1. 海南大学食品科学与工程学院,海南 海口 570228;2. 广东省食品质量安全重点实验室,广东 广州 510462;3. 华南农业大学食品学院,广东 广州 510462)
荔枝(LitchichinensisSonn.)为亚热带无患子科荔枝属植物,主产于中国,以海南、广西、广东、福建和台湾等地栽培最多[1]。荔枝的收获时间集中,除鲜食外,通常加工成荔枝干、果醋、罐头、果酒等。在加工过程中,荔枝果皮一般被当作加工废物丢弃。有文献[2]显示,荔枝果皮的重量大约是其鲜果重量的15%,含有丰富的多酚类物质,具有抗氧化、降血脂、改善心脑血管疾病等活性。但研究[3]显示,多酚的生物利用率极低,超过95%的膳食多酚不能被小肠吸收,而通过结肠微生物代谢。
人体肠道内大约存在1014个、1 000多种不同的细菌[4],这些微生物在粪便中的数量高达1011~1012CFU/g[5]。肠道菌群被称作人体的“第二大脑”与宿主共同进化,其群类结构及多样性为宿主提供了多种功能,如消化复杂的膳食残渣、产生营养物质、抵御病原体和调节免疫功能[6]。研究[7]显示,肠道菌群在膳食功能因子的生物可及性和功效发挥过程中起着重要的作用。肠道菌群与膳食功效因子的互作关系受到越来越多研究者的关注[8]。已有研究[9]表明不同的多酚体外发酵对肠道菌群的影响不同,而关于荔枝皮多酚对肠道菌群的影响还未见报道。
试验拟通过离体人肠道菌群代谢荔枝皮多酚,采用高通量测序分析肠道菌群在代谢过程中菌群结构的变化,检测荔枝皮多酚在体外发酵过程多酚含量和抗氧化活性的变化,以期为荔枝果皮多酚的功效作用和开发利用提供科学依据。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
荔枝:淮枝,广东广州某荔枝生产基地;
厌氧培养基:广州健阳生物技术有限公司;
乙醇:分析纯,国药集团化学试剂有限公司;
2,2’-联氮双(3-乙基苯并噻唑啉-6-磺酸)二铵盐(ABTS)、铁离子还原抗氧化剂(FRAP):美国Sigma-Aldrich公司。
1.1.2 主要仪器设备
厌氧培养箱:YQY-1型,上海跃进医疗器械有限公司;
多功能酶标仪:Multiskan Mk3型,美国Thermo Fisher公司;
PCR仪:GeneAmp PCR System 9700型,美国爱普拜斯公司。
1.2 方法
1.2.1 荔枝皮多酚粗提物的制备 新鲜荔枝皮粉碎,按料液比1∶15 (g/mL)与70%乙醇溶液混合,于40 ℃水浴恒温浸提3 h,200目尼龙布过滤,残渣复提1次,抽滤,50 ℃旋转蒸干后冷冻干燥(-80 ℃,0.34 Pa,48 h),得荔枝皮多酚粗提物,经测定其总酚含量为(17.85±1.84) mg GAE/g·FW。
1.2.2 人体粪便采集 选择30名21~25岁的健康成人(男∶女=1∶1),无肠道病史,采样前两周内未使用过任何药物。采集志愿者新鲜粪便,采样瓶1 h内送到实验室,液氮冷冻后置于-80 ℃冰箱中保存。
1.2.3 肠道菌群制备 参照文献[10]并作改进,将采集的粪便解冻,在无菌操作条件下,粪便与生理盐水按1∶4 (g/mL)比例混合均匀,蜗旋2 min,用4层无菌纱布过滤,滤液即为肠道菌液。按1∶9的比例将肠道菌液加入厌氧培养基中,混匀,液体石蜡液封后置于干燥器(含厌氧产气包)中37 ℃培养24 h,得培养液,以3%比例进行二次扩大培养。
1.2.4 荔枝皮多酚体外发酵 参照Rycroft等[11]的体外发酵法并改进,5.4 mL肠道菌悬液加入0.6 mL 0.3 mg/mL荔枝皮多酚,混合均匀后,迅速吸取1.0 mL加入灭菌离心管,37 ℃厌氧培养。监测发酵不同时间点(0,4,8,12,24,48 h)多酚含量、抗氧化值和肠道菌群的变化。
1.2.5 总酚含量的测定 采用Folin-Ciocalteu比色法[12]。
1.2.6 抗氧化活性的测定
(1) FRAP抗氧化能力:参照文献[13],修改如下:150 mL样品与2 850 mL FRAP工作液反应修改为2 800 μL FRAP工作液中加入200 μL稀释至一定浓度的样品。
(2) 清除ABTS+·能力:参照文献[14]。
1.2.7 菌群构成分析 样品中肠道微生物总DNA提取以及高通量测序委托上海派森诺生物科技股份有限公司进行。
(1) 样本总DNA提取:采用肠道微生物DNA试剂盒提取DNA。
(2) 目标片段PCR扩增:对目标片段16S rDNA V4区域进行PCR扩增。以第一个引物中的barcode 作为特异引物扩增得到目标产物。
(3) 扩增产物的纯化与定量:1.2.7(2)中PCR扩增的产物经电泳检测后,切胶回收目标片段,采用荧光定量PCR扩增产物。
(4) 文库构建与测序:使用美国Illumina公司的试剂盒制备测序文库。用MiSeq测序仪和使用MiSeq V3试剂盒对文库中的片段进行2×300 bp的双端测序。
1.3 数据分析
1.3.1 理化指标分析 结果以mean±SD表示(n=4)。采用SPSS 22.0软件,单因素分析方法(ANOVA)进行显著性分析,P<0.05有统计学意义。GraphPad Prism 8.3 软件对数据进行图形化处理。
1.3.2 Illumina MiSeq平台测序数据分析 高通量测序的原始数据进行质控、过滤、去嵌合体,得到的有效数据,进行分类操作单元的划分以及系统发育学分析,菌群结构差异及差异微生物种类采用 QIIME[15]、Usearch[16]分析。
2 结果与分析
2.1 总酚含量的变化
由图1可知,0 h与48 h相比,对照组(灭活肠道菌群)总酚含量无显著性变化,表明在无肠道菌群作用下,荔枝皮多酚相对稳定。荔枝皮多酚在发酵过程中呈显著下降趋势,代谢48 h后其总酚含量和0 h相比降低了20.94%(P<0.05),说明荔枝皮多酚在肠道菌群作用下发生了生物转化。
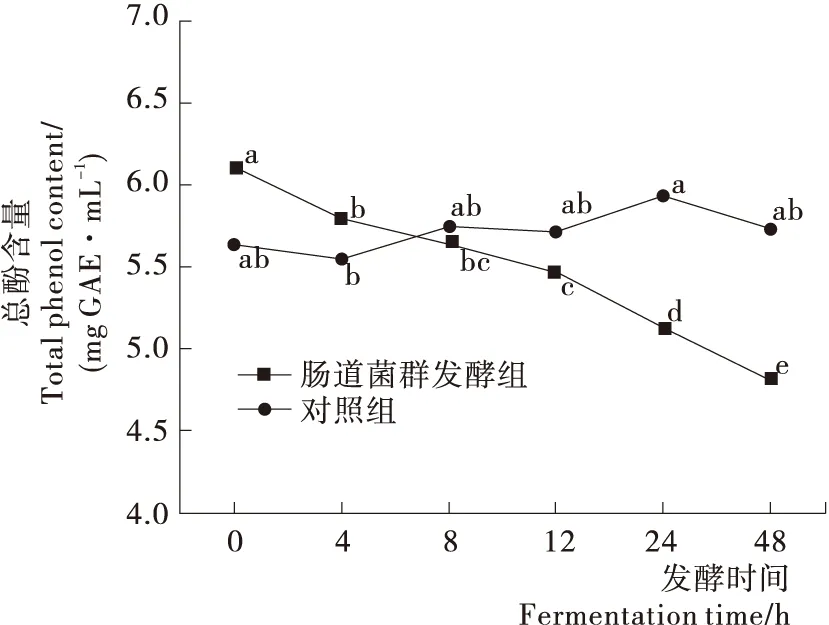
小写字母不同表示组内显著性差异(P<0.05)图1 体外发酵过程中荔枝皮多酚含量的变化Figure 1 Degradation curve of litchi pericarp polyphenolsby intestinal microflora
2.2 抗氧化活性的变化
2.2.1 FRAP抗氧化活性 荔枝皮多酚体外发酵4 h时,其FRAP抗氧化值为0 h的111.59%(P>0.05),之后随发酵时间延长,FRAP抗氧化活性呈降低趋势,发酵24 h和48 h时,FRAP抗氧化值分别为0 h的92.97%和92.19%(P>0.05)。FRAP抗氧化值的变化,可能是由不同发酵时间点微生物转化生成的代谢产物种类和量不同引起的。
2.2.2 ABTS+·抗氧化活性 如图3所示,在0~48 h时ABTS+·抗氧化活性无显著差异。发酵4,8,12,24,48 h时,ABTS+·抗氧化值分别为0 h的102.58%,105.64%,103.96%,98.60%和93.58%(P>0.05)。表明多酚被肠道菌群生物转化成的产物仍然具有良好的抗氧化活性。
2.3 体外发酵荔枝皮多酚对肠道菌群的影响
2.3.1 肠道菌群基本分析 图4为各分类水平的主要类群,从内到外依次为门、纲、目、科。从门的水平上,体外培养肠道菌群样品中主要的类群依次为:厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes),占其总含量的97.47%;从纲的水平上,主要的类群依次为梭菌纲(Clostridia)、变形菌纲(Gammaproteobacteria)、拟杆菌纲(Bacteroidia)、芽孢杆菌纲(Bacilli)、δ-变形菌纲(Deltaproteobacteria),占其总含量的95.65%;从目的水平上,主要的类群依次为梭菌目(Clostridiales)、肠杆菌目(Enterobacteriales)、拟杆菌目(Bacteroidales)、乳杆菌目(Lactobacillales)、假单胞菌目(Pseudomonadales)、脱硫弧菌目(Desulfovibrionales),占其总含量的94.99%;从科的水平上,主要的类群依次为肠杆菌科(Enterobacteriaceae)、拟杆菌科(Bacteroidaceae)、梭菌科(Clostridiaceae)、韦荣氏菌科(Veillonellaceae)、肠球菌科(Enterococcaceae)、消化链球菌科(Peptostreptococcaceae)、链球菌科(Streptococcaceae)、莫拉菌科(Moraxellaceae)、瘤胃球菌科(Ruminococcaceae)、脱硫弧菌科(Desulfovibrionaceae)、假单胞菌科(Pseudomonadaceae)、毛螺菌科(Lachnospiraceae),占其总含量的90.87%。由鉴定结果可知,粪便样品分离制备肠道菌群及体外厌氧发酵方法具有可行性。

小写字母不同表示组内显著性差异(P<0.05)图2 体外发酵荔枝皮多酚FRAP抗氧化活性的变化
Figure 2 Changes of FRAP antioxidant activity of LPP before and after incubation with intestinal microbiota

图3 体外发酵荔枝皮多酚ABTS+·抗氧化活性的变化
Figure 3 Changes of ABTS+· antioxidant activity of LPP before and after incubation with intestinal microbiota

图4 各分类水平的主要类群Figure 4 The main groups at each classification level
2.3.2 对肠道菌群α多样性的影响 如表1所示,24个样品共获得864 040条16S rDNA有效序列量,采用QIIM对有效序列以97%的序列相似度进行归并和OTU的划分。结果显示,随着体外发酵时间的延长,香浓指数有所升高,表明菌群的多样性提高。

表1 发酵荔枝皮多酚过程中肠道菌群信息及α 多样性Table 1 Sample information and α diversity of intestinal microbiota (n =4)
2.3.3 对肠道菌类群的影响 图5为荔枝皮多酚代谢的菌群OUT聚类分析。从图5中可以发现,门、纲、目水平上的微生物类群数目随发酵时间的延长无明显变化,但科、属、种水平上的微生物类群在24~48 h呈增加趋势。根据Li等[17]的报道,荔枝皮多酚及其发酵产生的代谢产物可能促进或抑制某些菌属的生长,从而引起肠道菌类群的变化。

图5 不同发酵时间各分类水平的微生物类群的变化
Figure 5 The changes of microorganism group number in different incubation time
2.3.4 对优势菌属及其相对丰度的影响 荔枝皮代谢过程中优势菌属的热图(图6)分析结果显示,肠道菌群前三优势菌属为肠球菌属(Enterococcus)、拟杆菌属(Bacteroides)和梭菌属(Clostridium)。其中肠球菌属(Enterococcus)的相对含量在整个代谢过程中呈增加趋势,48 h时增加至0 h的1.47倍,而拟杆菌属(Bacteroides)和梭菌属(Clostridium)呈降低趋势。由图7的结果显示,其相对含量在48 h分别降低至0 h的57.16%和20.87%。梭杆菌属(Fusobacterium)和脱硫弧菌(Desulfovibrio)的相对含量较低,但在整个发酵过程中呈增加趋势,在48 h时,其相对丰度分别是0 h的13.58倍和10.35倍(图7)。

蓝色代表相对含量较低,颜色越深,相对丰度越低;红色代表相对含量较高,颜色越深,相对丰度越高。
图6 优势属的相对丰度变化
Figure 6 Relative abundance changes of the main genus

图7 主要差异属的相对丰度变化Figure 7 Relative abundance changes of the major variant genus
与相关报道比,试验肠道微生物的优势菌属与潘亚平等[18]的研究结果相近。拟杆菌属是人和动物体内大量存在的正常菌群,报道[19]显示拟杆菌属在炎症性肠病中具有促炎作用,其降低能减少肠道炎症的发生,试验结果显示,荔枝皮多酚能够降低拟杆菌属肠道中的相对丰度,提示荔枝皮多酚的抗肠道炎症作用可能与其引起拟杆菌的变化有关。梭杆菌属是肠道内主要的产丁酸菌,丁酸是短链脂肪酸的一种,具有为肠上皮细胞提供能量、促进肠黏膜修复,调节肠道免疫等作用[20],其在荔枝皮多酚发酵过程中逐渐富集,表明荔枝皮多酚可能被梭杆菌属酵解生成短链脂肪酸丁酸,进一步发挥维护肠道健康的作用。
2.3.5 优势菌属的相互关系 菌群关联分析结果(图8)显示,发酵荔枝皮的优势菌属存在相互协同或相互竞争的关系。其中,肠球菌属(Enterococcus)、萨特氏菌属(Sutterella)与考拉杆菌属(Phascolarctobacterium)呈显著的正相关,表现为协同关系。脱硫弧菌属(Desulfovibrio)、颤螺旋菌属(Oscillospira)与双歧杆菌属(Bifidobacterium)呈现竞争关系。微生物对多酚结构的敏感性不同,不同的多酚需要不同的菌属单独或协同进行生物转化,从而表现出菌属间竞争或协同关系。这种结果提示,微生物间的相互关系也可能是引起菌群结构变化的原因之一。

计算优势菌属之间的斯皮尔曼等级相关系数,在其中rho>0.6且P<0.01的优势菌属之间构建关联网络。红色线为正相关,黑色线为负相关
图8 优势属的相互关系
Figure 8 The relationship between dominant genus
3 结论
荔枝皮多酚在肠道菌群发酵过程中总酚含量显著下降,抗氧化活性在0~48 h呈现先增加后降低的趋势,可能是因为不同发酵时间转化生成的代谢产物种类和量不同,代谢产物具有一定的抗氧化活性。在48 h发酵过程中,荔枝皮多酚能提高肠道菌群的α多样性。优势菌属的相对丰度随发酵时长变化,其中,梭杆菌属和脱硫弧菌属的相对丰度显著提高,拟杆菌属和梭菌属显著降低,肠球菌属与考拉杆菌属表现为协同关系,脱硫弧菌属与双歧杆菌属表现为竞争关系。荔枝皮多酚对肠道菌群的影响与其他报道的植物多酚相比存在差异,可能与多酚单体的组成不同有密切关系,后续试验将进一步考察多酚单体在发酵过程中的生物转化产物生成和变化。
