基质辅助激光解吸电离飞行时间质谱定性分析啤酒中糖类条件的优化
2020-06-06孟贤仁谢明勇聂少平王君巧
孟贤仁 - 谢明勇 - 聂少平 - 王君巧 -
(南昌大学食品科学与技术国家重点实验室,江西 南昌 330047)
啤酒是以大麦或小麦为主要原料,经制麦、糖化和发酵等工艺酿制成的一种食品。制麦过程中,谷物发芽产生多种酶系(包含淀粉酶系中的α-淀粉酶和β-淀粉酶等),其中淀粉酶在糖化过程中能够有效地将淀粉及非淀粉多糖(主要为β-葡聚糖)转化为葡萄糖、麦芽糖和低聚麦芽糖。发酵过程中,大部分小分子量的糖类会被酵母代谢转化为乙醇和二氧化碳,但麦芽四糖和一些分子量较大的低聚麦芽糖仍保留在最终的产品中[1]。由于啤酒中的糖类模式会潜在影响啤酒最终的感官特性,因此需对啤酒体系中的糖类模式进行监测[2]。
基质辅助激光解吸电离飞行时间质谱(MALDI TOF MS)是表征生物分子的强有力工具,具有高灵敏度、低样品损耗和高通量等优点[3],并且已广泛应用于多肽[4]、蛋白质[5]、脂质[6]、碳水化合物[7]及原花青素[8]的结构表征,但这些研究往往分析的是分离纯化后的化学组分。近年来,基于MALDI TOF MS直接对食品中化学组分的表征成为新的研究热点。Bonatto等[9]采集了多种巧克力的MALDI TOF MS谱图,并提取其中潜在的可可代谢物的质谱峰进行聚类分析,可对含有不同可可含量的多种巧克力进行区分。Qu等[10]研究发现纯蜂蜜和掺假蜂蜜在MALDI TOF MS下的糖类模式具有差异,可利用MALDI TOF MS对蜂蜜中掺入高果糖玉米糖浆和玉米糖浆的掺假行为进行高通量监测。
在MALDI TOF MS分析中,基质的选择及样品的制备至关重要。二羟基苯甲酸(DHB)是一种常用于糖类分析的基质。Park等[11]采用3种DHB同分异构体(2,4-DHB、2,5-DHB和2,6-DHB)作为基质,系统地探讨了不同条件下MALDI TOF MS对4种啤酒中寡糖的表征能力。但是2,5-DHB一般会在靶板圈点的周围形成一层指向中心的针状结晶,而圈点的中心不易形成结晶。这些不均一的结晶,使得需要在靶板上寻找理想的出峰“甜点”,不利于试验的重复性和便捷性。针对2,5-DHB的这一缺点,二元混合基质的设计付诸实现。Karas等[12]将少量(约10%)的2-羟基-5-甲氧基苯甲酸混入2,5-DHB中,得到一种结晶更均一的“super DHB”基质。Hsu等[13]研究发现2,4,6-三羟基苯乙酮(THAP)是一种能够在较宽分子量范围内检测多糖信号的基质,适用于普鲁兰多糖、高分子葡聚糖和多聚唾液酸的分析。目前对啤酒中糖类的分析方法有荧光辅助糖电泳法[14]、高效阴离子交换色谱—脉冲安培检测法[15]和高效液相色谱法[16],但荧光辅助糖电泳法必须对糖衍生化后才能分析,因此操作麻烦。而色谱法大多耗时较长,不够简单快捷。并且上述研究[14-16]大都只分析到聚合度不超过7的寡糖,不能全面反映啤酒中糖类的组成情况。试验拟尝试开发一种基于MALDI TOF MS定性分析啤酒中糖类的方法,以期该方法能够简便快捷地表征啤酒中聚合度>7的糖类。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
青岛啤酒:产于山东省青岛市;
南昌啤酒:产于江西省南昌市;
雪津啤酒:产于福建省莆田市;
乌苏啤酒:产于江苏省常州市;
2,5-DHB:色谱纯,日本TCI公司;
super DHB、THAP:色谱纯,美国Sigma-Aldrich公司;
乙腈:色谱纯,德国Merck公司;
三氟乙酸:色谱纯,阿拉丁试剂有限公司;
氯化钠:分析纯,国药集团化学试剂有限公司。
1.1.2 主要仪器设备
基质辅助激光解吸电离飞行时间质谱:MALDI TOF/TOF 5800型,美国AB SCIEX公司;
分析天平:XS205型,美国Mettler-Toledo公司;
超纯水仪系统:Milli-Q型,美国Millipore公司。
1.2 方法
1.2.1 啤酒的预处理 啤酒稀释前,对啤酒进行超声脱气1 h。脱气后,分别用超纯水将啤酒进行梯度稀释,得到啤酒原液、2倍稀释液、4倍稀释液、10倍稀释液、100倍稀释液和1 000倍稀释液。
1.2.2 基质的制备 将1 mg 2,5-DHB溶解于100 μL 乙腈/水溶液(体积比1∶1,含0.01%三氟乙酸)中,涡旋均匀,得到10 mg/mL 2,5-DHB基质溶液。将1 mg super DHB溶解于100 μL 乙腈/水溶液(体积比1∶1,含0.01%三氟乙酸)中,涡旋均匀,得到10 mg/mL super DHB基质溶液。将1 mg THAP溶解于100 μL 乙腈/水溶液(体积比1∶1,含0.01%三氟乙酸)中,涡旋均匀,得到10 mg/mL THAP基质溶液。
用乙腈/水溶液(体积比1∶1,含0.01%三氟乙酸)溶解氯化钠,配置得到浓度为2 mg/mL的氯化钠溶液。将上述10 mg/mL THAP基质溶液与2 mg/mL氯化钠溶液按体积比2∶1混合后即可得到掺有钠离子的THAP基质溶液。
1.2.3 基质和稀释条件的优化 点样方法采用双层法。将各浓度梯度的啤酒样品分别与基质溶液等体积混合,得到待测样品溶液。取1 μL基质溶液点在靶板上,待完全干燥后,再取1 μL待测样品溶液点在基质形成的结晶上。每个样品做3次平行试验。待样品完全干燥后,上机测试。
1.2.4 仪器的参数 激光源:Nd:YAG激光;采集方法:反射阳离子模式;激光强度:7 000;激光激发次数:500。
2 结果与分析
2.1 2,5-DHB为基质的糖类定性分析
以2,5-DHB为基质,MALDI TOF MS无法检测到青岛啤酒的原液、2倍稀释液和4倍稀释液中的糖类信号。如图1所示,随着对啤酒进一步稀释至10倍,MALDI TOF MS检测到青岛啤酒中一系列聚糖的加合钾离子信号([Hexn+K]+)。相邻聚合度糖类信号的质荷比差值为162(一分子六碳糖与一分子水的相对分子质量差值),反映了这些聚糖都是由六碳糖聚合而成,其中[Hex15+K]+是检测到的质荷比最大的糖类信号。在对啤酒稀释至100倍时,MALDI TOF MS检测到青岛啤酒中一系列聚糖的加合钠离子信号([Hexn+Na]+),其中 [Hex8+Na]+是检测到的质荷比最高的糖类信号。在对啤酒稀释至1 000倍时,未采集到糖类信号。这可能是由于啤酒中的糖类浓度较低,已超出此条件下MALDI TOF MS的检测限。由上述结果可知,当以2,5-DHB为基质,样品稀释10倍时,MALDI TOF MS表征青岛啤酒中的糖类效果较好,能够检测到聚糖的最大聚合度为15。
2.2 Super DHB为基质的糖类定性分析
以super DHB为基质,MALDI TOF MS无法检测到青岛啤酒的原液和2倍稀释液中的糖类信号。如图2所示,在对啤酒稀释至4倍和10倍时,MALDI TOF MS检测到青岛啤酒中一系列聚糖的加合钾离子信号,其中[Hex9+K]+是检测到质荷比最高的糖类信号,并且相同聚合度的[Hexn+K]+信号在4倍稀释条件下的信噪比均高于10倍稀释的信噪比。在对啤酒稀释至100倍时,MALDI TOF MS检测到质荷比最高的糖类信号是[Hex7+Na]+。由上述结果可知,当以super DHB为基质,样品稀释4倍时,MALDI TOF MS表征青岛啤酒中的糖类效果一般,能够检测到聚糖的最大聚合度为9。
2.3 THAP为基质的糖类定性分析
图3为各浓度梯度的青岛啤酒以THAP为基质采集到的MALDI TOF MS谱图。从图3可看出,MALDI TOF MS能够采集到青岛啤酒6个稀释样品中的糖类信号。随着对青岛啤酒从原液逐步稀释到10倍稀释液,可检测到啤酒中糖类聚合度增加,并且相同聚合度的[Hexn+K]+信噪比也均增加。如[Hex9+K]+信号在啤酒原液、2倍稀释液、4倍稀释液和10倍稀释液中的信噪比分别为20.00,38.53,86.79,298.58。在对啤酒稀释至10倍时,MALDI TOF MS能够成功检测到聚合度为18的糖信号([Hex18+K]+)。在对啤酒稀释至100倍和1 000倍时,所能检测到最大质荷比的信号分别为[Hex13+Na]+和[Hex9+Na]+。这可能是啤酒中聚合度>4的聚糖中,聚合度高的糖类含量低于聚合度低的糖类含量[2]。随着对啤酒的稀释,啤酒中聚合度高的糖类浓度先降至检测限以下,故而在高稀释倍数下,较难检测到啤酒中的聚合度较高的糖类。由上述结果可知,当以THAP 为基质,样品稀释10倍时,MALDI TOF MS表征青岛啤酒中的糖类效果良好。
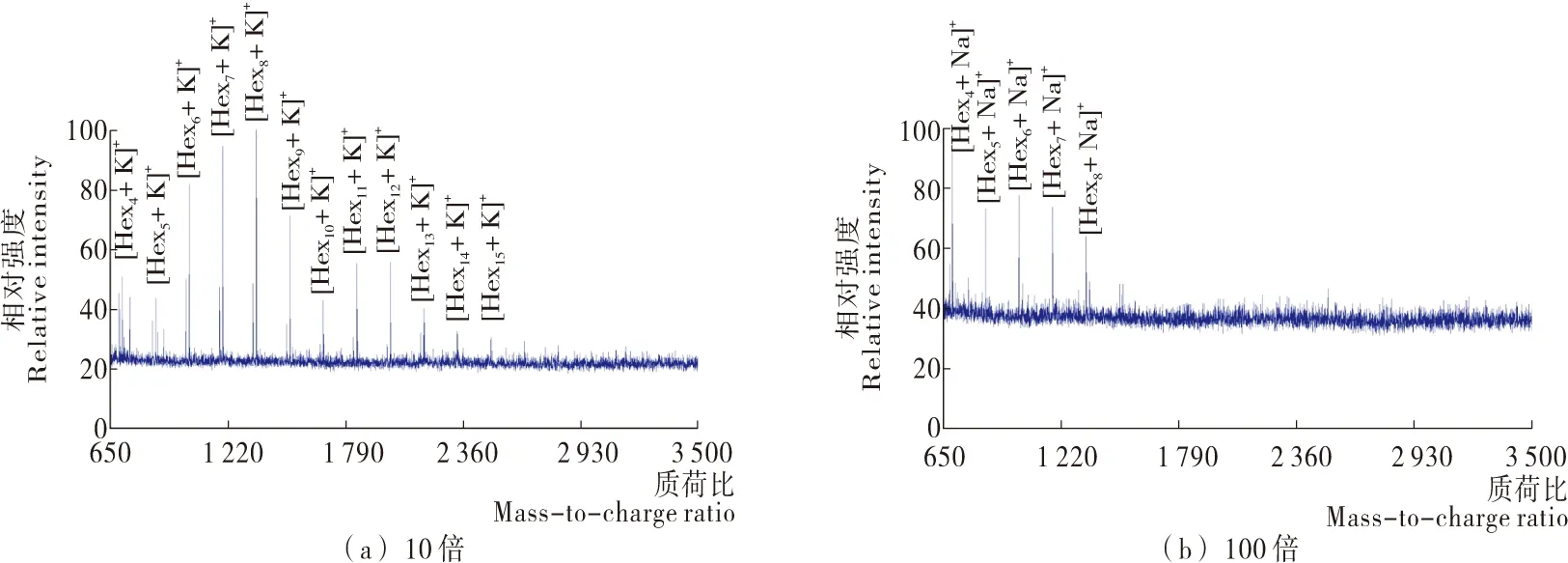
图1 以2,5-DHB为基质采集到的青岛啤酒的10倍和100倍稀释液的MALDI TOF MS谱图Figure 1 MALDI TOF mass spectra of 10-fold and 100-fold dilutions of Tsingtao beer with 2,5-DHB as matrix
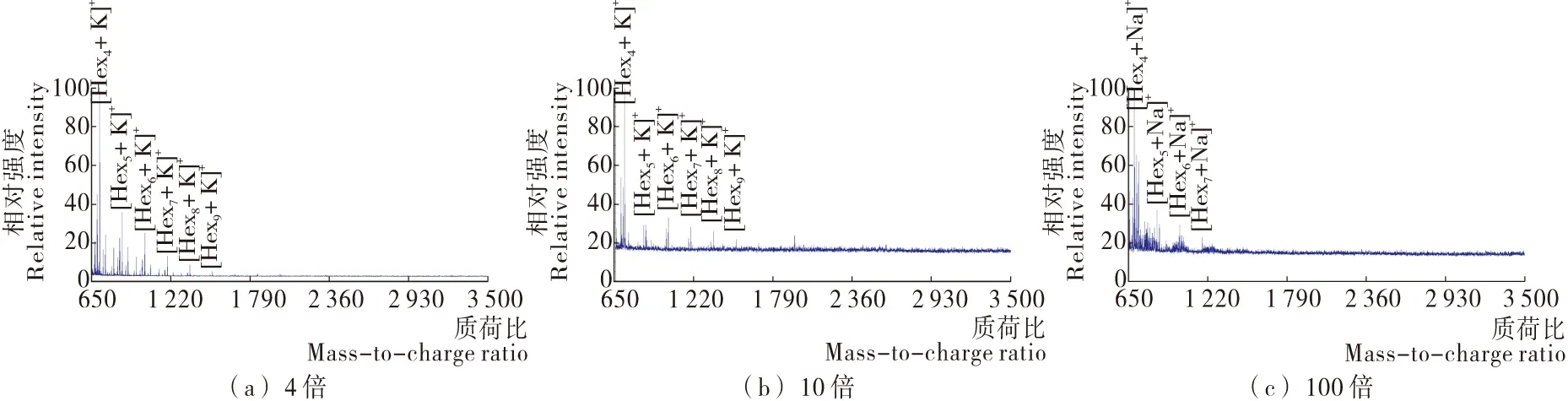
图2 以super DHB为基质采集到的不同浓度梯度下青岛啤酒的MALDI TOF MS谱图Figure 2 MALDI TOF mass spectra of different concentrations of Tsingtao beer with super DHB as matrix
值得注意是,MALDI TOF MS采集到啤酒原液、2倍稀释液、4倍稀释液和10倍稀释液中的糖类信号主要为加合钾离子信号。随着对啤酒的稀释倍数加大,啤酒的100倍稀释液和1 000倍稀释液中的糖类信号主要为加合钠离子信号。其中可能的原因是在啤酒的稀释倍数较低时,金属离子的离子强度主导了糖类的金属离子加合状态[11]。啤酒中钾离子的离子强度高于钠离子的离子强度,啤酒中的糖类倾向于与离子强度大的钾离子加合,故而MALDI TOF MS采集到啤酒原液、2倍稀释液、4倍稀释液和10倍稀释液中的糖类信号主要为加合钾离子信号。在稀释倍数较高时,糖类与金属离子的亲和性差异主导了糖类的金属离子加合状态。Mauri等[2]研究发现糖类对钠离子的亲和性高于钾离子的亲和性。故而试验中MALDI TOF MS采集到啤酒100倍稀释液和1 000倍稀释液中的糖类信号主要为加合钠离子信号。为验证在啤酒的稀释倍数较低时是金属离子的离子强度主导了糖类的金属离子加合状态,向THAP基质溶液中加入氯化钠溶液并与啤酒样品混合后测试。结果显示,MALDI TOF MS采集到青岛啤酒原液、2倍稀释液、4倍稀释液和10倍稀释液(图4)中的糖类信号转变为主要是加合钠离子信号,确证了上述假设。
2.4 THAP应用于其他啤酒中糖类的定性分析
通过比较上述3种基质对啤酒中糖类的激光解吸电离能力,THAP是一种能够支持MALDI TOF MS在6个浓度梯度范围内对啤酒都采集到糖类信号的基质,是电离效率最高的基质。同时,比较3种基质在各自较优条件下采集的谱图,以THAP为基质采集到的谱图中所能检测到糖类的聚合度最大且具有较高的信噪比。THAP作为基质的另一优点是其形成的结晶较DHB和super DHB形成的更均一,无需在靶板上寻找理想的出峰“甜点”,有利于试验的重复性和便捷性。
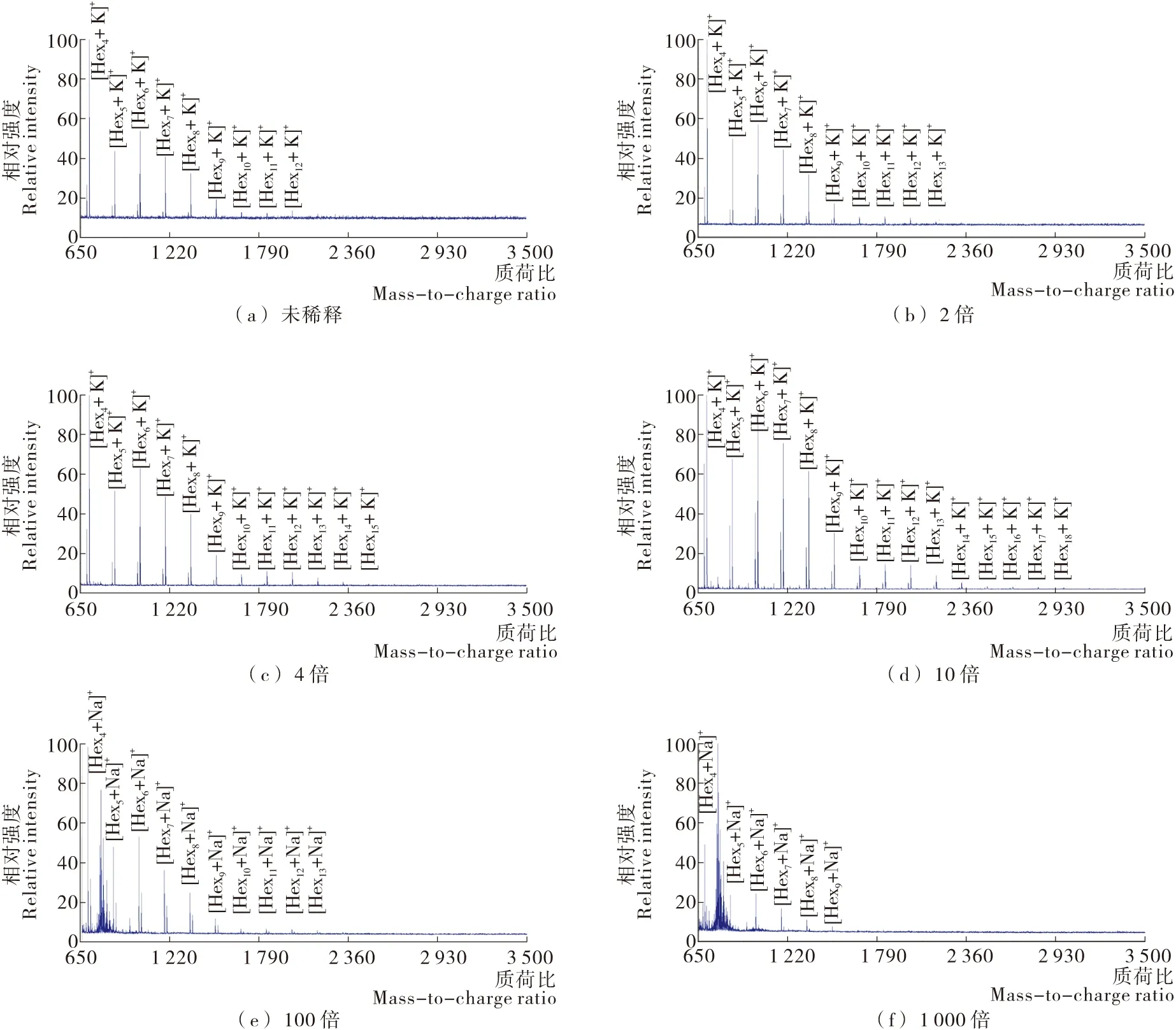
图3 以THAP为基质采集到的不同浓度梯度下青岛啤酒的MALDI TOF MS谱图Figure 3 MALDI TOF mass spectra of different concentrations of Tsingtao beer with THAP as matrix

图4 以掺有钠离子的THAP为基质采集到的青岛啤酒的10倍稀释液的MALDI TOF MS谱图
Figure 4 MALDI TOF mass spectra of 10-fold dilution of Tsingtao beer with THAP containing Na+as matrix
此外,在以THAP为基质,样品稀释10倍的条件下,试验还研究了另外3种市面上常见啤酒(南昌啤酒、雪津啤酒和乌苏啤酒)的聚糖信号,结果如图5所示,MALDI TOF MS检测到南昌啤酒和雪津啤酒中聚合度最高为18的聚糖信号([Hex18+K]+),且该信号的信噪比>10.00,分别为10.27和15.56;乌苏啤酒检测到聚糖的最大聚合度为19([Hex19+K]+),信噪比为11.64。以上结果证实以THAP为基质,啤酒样品稀释10倍的条件是MALDI TOF MS定性分析啤酒中糖类的较优条件。
3 结论
试验以2,5-DHB、super DHB和THAP为基质,对啤酒样品设置6个稀释倍数,优化了MALDI TOF MS对啤酒中糖类分析的试验条件。结果表明,THAP应用于MALDI TOF MS对啤酒中糖类表征的能力优于另外两种基质,在啤酒稀释倍数为10倍时检测到的聚合度能够达到18。此条件下的MALDI TOF MS具有检测到的糖类分子量范围宽和信噪比高的优点。

图5 3种市面常见啤酒(南昌啤酒、雪津啤酒和乌苏啤酒)的MALDI TOF MS谱图
Figure 5 MALDI TOF mass spectra of three kinds of commercially available beers (Nanchang, Sedrin and Wusu beers)
