过表达乙酰-CoA相关基因提高出芽短梗霉liamocins合成能力
2020-06-06郑鹏张孟娟黄思瑶康新玥陈叶福
郑鹏,张孟娟,黄思瑶,康新玥,陈叶福*
1(天津科技大学 生物工程学院,天津,300457) 2(工业发酵微生物教育部重点实验室(天津科技大学),天津,300457)
出芽短梗霉为类酵母真菌,由于产生黑色素所以被称为黑酵母[1],具有相当重要的生物技术意义、良好的抗环境压力能力,越来越受到医学方面的关注。出芽短梗霉因生长环境的不同而具有5种形态:酵母状细胞、芽孢子、肿胀孢子、菌丝状细胞和厚垣孢子[2]。出芽短梗霉因可以生产多种胞外酶[3-4]、单细胞蛋白、铁载体[5]、短梗霉素、普鲁兰糖[6]、聚苹果酸[7]和重油[8]等多种产物而闻名,并且能应用于生物防治[9]。其中普鲁兰糖是由其合成的一种胞外多糖,它由麦芽三糖以α-(1→6)糖苷键反复连接而成,特殊的化学结构赋予普鲁兰糖优良的性质,它黏度大、水溶性极强,在化工、食品、医药等行业应用广泛,可作为增稠剂,也能用于生产可被微生物降解的薄膜,还可作为低卡路里食品直接食用[10]。
Liamocins的生产首先由RUINEN等[11]报道,通过20号和272号出芽短梗霉生产。liamocins这个词是PRICE等[12]在确定了这个新化合物家族的详细结构后首次使用的。liamocins由一个部分乙酰化的多元醇头基团和1~5个3,5-二羟基癸酸酯基尾组成,在第1个3,5-二羟基癸酸中有可能会有3-O-乙酰化的现象。而多元醇头基团的结构和培养基中所用糖的种类无关,主要与菌种[13]和培养基中多元醇种类相关[14]。
Liamocins具有多种商业应用价值,它是比水密度大的油,所以之前一直被称为重油,颜色多为浅黄、深绿、深棕色;表面张力介于27~31.5 mN/m[8],可作为商业用表面活性剂使用。多篇报道显示,liamocins对某些癌细胞具有抗增殖作用[15-16];具有较强的选择性抗菌能力,对链球菌属有特异性,为出芽短梗霉的一个普遍特性[17];此外,即使受到加热影响仍能保持抗菌活性[13]。
Liamocins的完全合成途径至今尚不清楚。在同位素标记的[U-13C]葡萄糖上培养AureobasidiumpullulansNRRL 50380,使用MALDI-TOFMS分析liamocins,在甘露醇部分发现了13C标记,但是在3,5-二羟基癸酸部分并没有发现[12]。这一信息表明,liamocins的生物合成是相当复杂的。TANG等[18]通过在A.melanogenum9-1中过表达高产聚苹果酸菌株Aureobasidiumsp. P6的PYC1基因,通过提高柠檬酸的产量来提高liamocins的产量,并推测柠檬酸和乙酰-CoA为liamocins的重要前体物质。值得注意的是,在过表达PYC1的同时,ACL和ME基因的转录水平都有不同程度的提高。
本实验以出芽短梗霉P30为研究对象,通过代谢工程改造出芽短梗霉,过表达乙酰-CoA合酶、ATP-依赖性柠檬酸裂解酶、苹果酸酶和丙酮酸羧化酶基因,使胞质乙酰-CoA含量提高,从而来达到高产liamocins的目的。
1 材料和方法
1.1 材料
1.1.1 菌株、质粒和引物
AureobasidiumpullulansP30(后文简称P30)由本实验室保藏于-80 ℃冰箱,质粒pUC-AHPT和pUC-GB由本实验室构建保藏,实验所用引物由苏州金唯智生物科技有限公司合成,如表1所示。

表1 本研究所用引物Table 1 Primers used in this study
1.1.2 培养基
YEPD培养基(g/L):酵母浸粉10.0,葡萄糖20.0,蛋白胨20.0,固体YEPD培养基加入2.0 g/L的琼脂粉。HCS培养基(g/L):葡萄糖10.0,酵母浸粉3.0,牛肉膏1.0,蛋白胨10.0,麦芽浸粉3.0,HCl调至pH 5.7,固体HCS培养基加入2.0 g/L琼脂粉。HCS双层培养基:上层为固体HCS培养基,下层固体HCS培养基添加潮霉素B溶液,使终质量浓度为150.0 mg/L。种子培养基(g/L):木糖20.0,酵母浸粉1.0,K2HPO44.0,(NH4)2SO40.8,MgSO40.2,NaCl 4.0,用HCl调pH至6.0。发酵培养基(g/L):木糖50.0,酵母浸粉2.0,KNO30.8,NaCl 2.0,K2HPO45.0,MgSO40.3,用HCl调pH至5.5。
1.1.3 酶和试剂
DNA marker、TaqDNA聚合酶、dNTP、Primer Star GXL聚合酶、RNA提取试剂盒和反转录试剂盒,TaKaRa中国大连公司;胶回收试剂盒、片段回收试剂盒和质粒提取试剂盒,OMEGE公司;潮霉素B,上海索宝生物科技有限公司。
1.2 仪器与设备
电穿孔仪,美国BTX公司;凝胶成像仪,美国SYN gENE公司;分光光度计,天津普瑞斯公司。
1.3 实验方法
1.3.1 重组菌株的构建
重组菌株的构建采用GUO等[19]的同源重组依赖性DNA装配方法。因普鲁兰糖和liamocins均含有大量碳元素,可能存在碳流竞争的关系,所以以编码普鲁兰糖合成酶基因(PUL1)为整合位点,使碳流更多地流向liamocins的合成。因此,在PUL1位点整合过表达ACS1、ACL、ME、PYC1基因。
1.3.2 培养方法
菌株活化:从甘油管中取10 μL菌液接入装有5 mL YEPD试管中,28 ℃,200 r/min,培养24 h。
种子培养:从活化的菌液中,取1 mL菌液接入到50 mL/250 mL锥形瓶种子培养基中,28 ℃,200 r/min,培养24 h。
发酵培养:将培养好的种子液3 mL接入到50 mL/250 mL锥形瓶发酵培养基中,28 ℃,240 r/min,培养7 d。
1.3.3 重组菌株生长性能测定
从甘油管中取10 μL P30接种于YEPD液体培养基进行活化,于28 ℃,200 r/min的摇床中培养24 h。取已灭菌的装液量为50 mL YEPD液体培养基的250 mL三角瓶,加入50 μL活化的菌液,于28 ℃,200 r/min的摇床中培养。每隔4 h取0.5 mL菌悬液,在12 000 r/min的转速下离心1 min,弃上清液,再用蒸馏水洗涤2次菌体,最后加入2 mL蒸馏水混匀。以蒸馏水为对照,用紫外分光光度计测定OD600值。以时间为横坐标,OD值为纵坐标,绘制出生长曲线。
1.3.4 发酵产物的分析方法
生物量、木糖和胞外普鲁兰糖的测定:根据杨金龙等[20]的方法进行测定。发酵液中liamocins含量测定:根据GUO[19]的方法测定。
1.3.5 mRNA水平的测定
本实验中所有P30总RNA的提取和反转录所用的试剂盒均由TaKaRa公司提供,操作方法严格按照试剂盒说明书进行。mRNA的水平采用Bio-Rad QX200微滴式数字PCR系统的染料法进行测定。
2 结果和分析
2.1 重组菌株的构建
将上同源臂、下同源臂、潮霉素B抗性、磷酸甘油酸激酶(phosphoglycerate kinase, PGK)启动子、3-磷酸甘油醛脱氢酶(glyceraldehyde-3-phosphate dehydrogenase, GAP)终止子和目的基因按照1.3.1方法,转入P30中,得到疑似转化子,并进行PCR验证,得到对应重组菌株。PCR验证结果如图1所示。M泳道为DNA marker,1和3泳道为阴性对照,2,4泳道为以重组菌株基因组为模板所得验证片段,片段大小均符合预期。说明分别过表达ACS1,ACL,ME,PYC1所得到的重组菌株PEACS1、PEACL、PEME、PEPYC1构建成功。对构建成功的过表达菌株进行保藏以便后续研究。
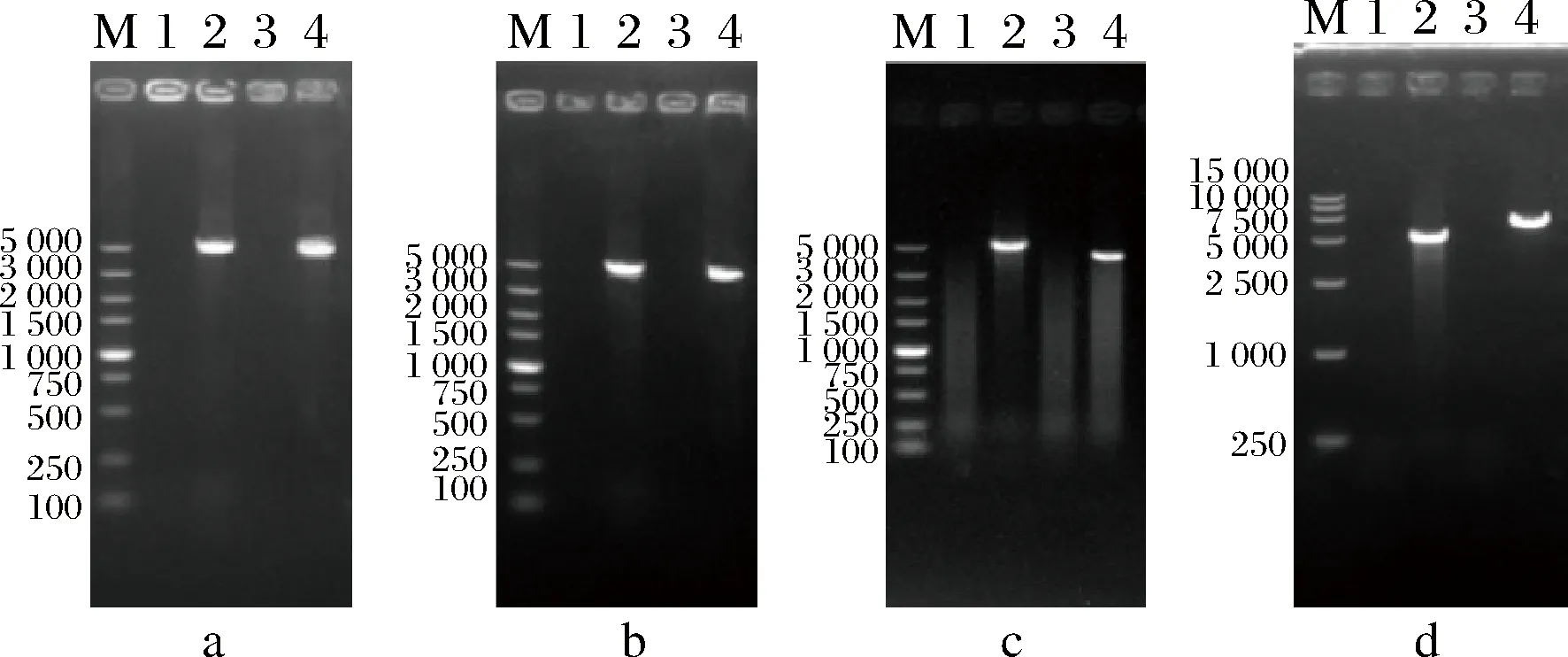
M-DNA marker;1,3泳道-阴性对照;2,4泳道-以重组菌株基因组为模板所得验证片段图1 过表达ACS1、ACL、ME、PYC1菌株PCR验证结果Fig.1 The PCR results of strain overexpression geneACS1, ACL, ME and PYC1
2.2 生长性能测定
将4株改造菌与出发菌株P30分别按照1.3.3方法进行培养,测定生长曲线,如图2所示。4株重组菌生长趋势与出发菌基本一致,说明过表达ACS1、ACL、ME和PYC1基因对菌株的生长性能无明显影响。
图2 重组菌株生长曲线Fig.2 Growth curve of recombinant strains
2.3 木糖利用能力测定
在发酵培养基中对重组菌株和出发菌株发酵,每24 h测定发酵液中木糖剩余量和生物量,如图3所示。图3-a中重组菌株木糖消耗曲线同出发菌株P30基本一致,发酵7 d后发酵液中无木糖残留,说明重组菌的木糖利用能力没有受影响。图3-b中重组菌株总体增长趋势与出发菌株P30较为一致,但在发酵培养基中培养结束后,PEACL的生物量比出发菌低了19.83%,而在测定生长曲线时,显示PEACL的生长未受到影响。或许是因为大量的底物转化为乙酰-CoA从而增强了liamocins合成的同时,导致菌体生长所需营养供应减弱。
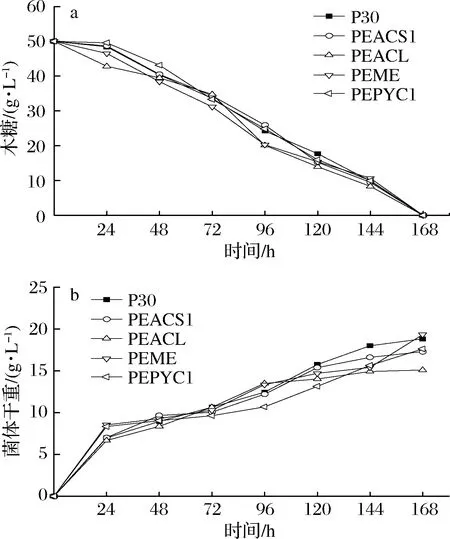
a-木糖;b-菌体干重图3 重组菌株的木糖利用能力Fig.3 Xylose utilization ability of recombinant strains
2.4 重组菌株发酵性能的探究
将重组菌株与原始菌株P30在发酵培养基中发酵,待发酵结束后测定菌体干重、普鲁兰糖和liamocins产量,如图4所示。

a-干重;b-普鲁兰糖;c-liamocins图4 重组菌株发酵性能Fig.4 Fermentation performance of recombinant strains
重组菌株的普鲁兰糖产量均低于P30,PEACS1、PEACL、PEME、PEPYC1的普鲁兰糖产量分别降低了12.29%、11.90%、9.37%、13.37%。liamocins的产量较出发株均有所提升,PEACS1、PEACL、PEME、PEPYC1的产量分别比P30高了8.19%、93.74%、13.49%、17.12%。普鲁兰糖的产量略有降低,可能因为一部分碳代谢流向了liamocins的合成。PYC1催化丙酮酸到草酰乙酸的转化,然后在苹果酸脱氢酶的催化下将产生的草酰乙酸还原为苹果酸。当一分子苹果酸通过线粒体柠檬酸转运蛋白(citrate transporter, CTP)进入线粒体,同时一分子柠檬酸通过CTP转移到细胞质中。线粒体中的苹果酸被转化为草酰乙酸,其通过三羧酸循环进一步与乙酰-CoA缩合,产生柠檬酸。细胞质中的柠檬酸在ACL的催化下,随后转化为乙酰-CoA和草酰乙酸。TANG等[18]在高产liamocins菌株A.melanogenum9-1中异源表达高产聚苹果酸菌株Aureobasidiumsp. P6的PYC1基因,能明显提高liamocins产量,但本实验过表达P30的PYC1后,liamocins产量没有达到预期效果,还需要进一步研究,找出原因。产油酵母可以积累超过其生物量20%的油脂[21],而其中关键酶为ACL,可催化柠檬酸转化为乙酰-CoA和草酰乙酸,前者为脂肪酸和liamocins合成的重要前体。本研究也说明过表达ACL可以大幅度提升liamocins的合成。在过表达ACL后,虽然liamocins的产量提升非常明显,但是生物量和普鲁兰糖的量却有了较为明显的降低,或许是由于该基因的过表达,扰动了菌体本身的代谢流,使底物更多流向liamocins合成。ME的过表达并没有使liamocins的产量明显提升,或许是因为大量的苹果酸转化为丙酮酸,柠檬酸和苹果酸线粒体穿梭中的苹果酸供应不足,从线粒体内转运到细胞质中的乙酰-CoA合成的前体物质柠檬酸减少。ACS可催化乙酸生成乙酰-CoA,而本实验过表达ACS1后liamocins产量提升幅度并不是很大,或许是因为出芽短梗霉中ACS并不是合成乙酰-CoA的关键酶。周丹凤[22]采用菌株ZUST-GS,利用75.17 g/L的木糖发酵,得到8.41 g/L的liamocins,转化率为0.11 g/g。LEATHERS等[23]使用菌株A.pullulansNRRL 50384利用120 g/L的蔗糖发酵,得到22 g/L的liamocins,转化率为0.18 g/g。TANG等[18]使用菌株A.melanogenumM39,利用140 g/L的葡萄糖发酵,得到35.3 g/L的liamocins,转化率为0.25 g/g。以上分别为出芽短梗霉以木糖、蔗糖、葡萄糖为主要碳源发酵产liamocins的最大产量及liamocins转化率。PEACL利用50 g/L木糖发酵,得到19.44 g/L的liamocins,转化率为0.38 g/g。虽然NRRL 50384和M39的liamocins产量高于PEACL,但转化率均较低,PEACL的liamocins的产量和转化率均优于ZUST-GS。
2.5 过表达基因转录水平测定
分别提取出发菌株和重组菌株的RNA,并选取3-磷酸-甘油醛脱氢酶基因(glyceraldehyde-3-phosphate dehydrogenase, GAPDH)作为内参进行微滴式数字PCR反应。分别对每株重组菌株对应基因的转录水平进行定量分析,如图5所示。重组菌株的相应基因的转录水平都有所升高,进一步验证了所有过表达菌株均构建成功,但结果显示,各个基因的转录水平提高程度不尽相同。过表达ACS1、ACL、ME、PYC1基因菌株的转录水平分别提高了8.16、0.94、14.78和12.17倍。值得注意的是,虽然PEACL对应基因的转录水平提高较低,但从发酵结果来看,其liamocins产量的提升幅度非常高,远大于过表达其他基因的菌株,这表明出发株P30的liamocins合成或许受到ACL的转录水平限制,而ACL为P30合成liamocins的关键酶。

图5 重组菌株对应基因相对转录水平Fig.5 Relative transcription level of the corresponding gene of the recombinant strain
3 结论
本研究分别过表达乙酰-CoA合成相关基因ACS1、ACL、ME、PYC1,成功构建了重组菌株PEACS1、PEACL、PEME和PEPYC1。结果发现,重组菌株的liamocins产量都有不同程度的提高,效果最明显的是过表达ACL,虽然该基因过表达后其转录水平提升幅度不大,但liamocins产量提高了93.74%,这说明过表达该基因能明显地促进liamocins合成,并且该基因为P30合成liamocins的关键基因,其合成liamocins的能力或许受ACL转录水平的限制。以上结果说明,强化乙酰-CoA合成可以提高liamocins产量,而其中的ACL基因对出芽短梗霉liamocins的合成至关重要。
