骨髓间充质干细胞对IL-1β诱导的软骨细胞损伤的抑制作用及其机制
2020-06-06王世龙汤超亮陈文钧复旦大学附属华山医院骨科上海200040
蒋 励,许 耀,王世龙,汤超亮,陈文钧(复旦大学附属华山医院骨科,上海 200040)
骨关节炎(osteoarthritis,OA)是一种以关节软骨退变和关节腔炎症为主要病理变化的慢性关节退变疾病,会使患者活动受限,并带来沉重的经济负担[1-3]。目前OA的治疗方法主要包括减少负重、服用非甾体抗炎镇痛药物等,但减少负重并不适合所有病人,因此寻找一种更为有效的治疗方法迫在眉睫[4]。间充质干细胞(mesenchymal stem cells,MSCs)作为组织工程学的研究热点,为OA的治疗提供了新的思路。MSCs具有易获取、培养简单、增殖速度快及免疫耐受等特点,因此已逐渐用于多种疾病的治疗当中。研究也已经证实MSCs能够定向分为软骨细胞,而且对损伤软骨具有修复作用[5,6],但具体作用机制尚不明确。本研究将以白介素1-β(IL-1β)诱导软骨细胞模拟体外OA模型,探讨MSCs对OA的治疗作用机制。
1 材料与方法
1.1 实验动物
4周龄雄性SPF级别的SD大鼠10只,体质量约100 g,购于上海斯莱克实验动物有限公司,合格证号SCXK(沪2012-0002),大鼠在(25±2)℃环境下于鼠笼中自由活动并饮食。
1.2 主要试剂及仪器
Ⅱ型胶原酶购自美国Gibco公司;CCK-8试剂盒购于南京凯基生物技术有限公司;重组人白介素-1β(IL-1β)、兔抗B细胞淋巴瘤/白血病-2(Bcl-2)抗体、Bcl-2相关的X蛋白(Bax)、细胞外基质金属蛋白酶-1(MMP-1)、MMP-13、核因子-κB(NF-κB)、p-NF-κB、核因子-κB抑制蛋白(IκBα)、p-IκBα及GAPDH多克隆抗体购于美国Abcam公司;辣根过氧化物酶标记山羊抗兔IgG(H+L)购于碧云天生物技术有限公司。Epics-XLⅡ流式细胞仪为美国Beckman Coulter公司产品;MK3酶标仪购自美国thermo公司;ChemiDocTM XRS凝胶成像系统购自美国伯乐公司。
1.3 大鼠软骨细胞的制备
将大鼠脱颈处死,无菌分离大鼠膝关节,剥离软骨面的结缔组织,取透明软骨,用PBS洗涤,将组织剪为1 mm3的小块。0.25%胰蛋白酶37 ℃预消化30 min,弃清液,加0.2%Ⅱ型胶原酶37 ℃消化4 h,200目滤网过滤,2 000 r/min离心10 min,收集细胞[7,8]。用含有10%胎牛血清的DMEM-F12培养基重悬细胞,37 ℃、5% CO2培养8-10 d,当软骨细胞密度达到80%-90%时,传代,取第3代软骨细胞进行试验。
1.4 大鼠BMSCs的分离、培养、纯化及鉴定
将大鼠脱颈处死,用75%酒精消毒,PBS冲洗干净,取大鼠右侧胫骨及股骨,去除骨端,暴露骨髓腔,用DMEM/F12培养基充分冲洗骨髓腔并收集骨髓,1 500 r/min离心10 min,收集细胞并重悬。于含有15%胎牛血清的DMEM/F12培养基中培养,每隔3 d换液,去除未贴壁细胞,在细胞融合程度80%时,以1∶3传代,第3代细胞用于后续实验。光镜观察细胞生长形态,用流式细胞术检测BMSCs表面标志物,当细胞表面标志物CD90阳性率高于95%,CD34及CD45阳性率均低于5%时,即获得纯度高、均一性较好的BMSCs,用于后续实验[9,10]。
1.5 细胞分组
将软骨细胞分为正常对照组(无任何干预)、IL-1β组(10 ng/ml IL-1β)和BMSCs组(软骨细胞与BMSCs细胞共培养的同时加10 ng/ml IL-1β)。
1.6 CCK-8法检测细胞活力
将软骨细胞接种于96孔板,待细胞贴壁后,按1.5分组处理细胞,培养48 h,加入CCK-8试剂孵育4 h,于酶标仪560 nm处测定细胞吸光值(OD值)。
1.7 RT-PCR法检测细胞中Aggrecan及ColⅡ mRNA表达
按照Trizol试剂盒说明书提取细胞中总RNA,并测定RNA浓度及纯度,当RNA纯度(OD260 nm/OD280 nm)为1.8时,用反转录试剂盒将RNA逆转录成cDNA,基于SYBR Green Ⅰ荧光分析的real time PCR检测,预变性95 ℃,15 min;变性95 ℃,20 s;退火60 ℃,34 s;40个循环。用2-ΔΔCt法统计Aggrecan及ColⅡ mRNA的表达量,以GAPDH为内参。引物见表1。

表1 引物序列
1.8 Western blot检测蛋白表达量
收集细胞并裂解,获得细胞总蛋白。BCA试剂盒检测蛋白浓度,取30 ng蛋白样品,12% SDS-PAGE分离蛋白,转聚偏二氟乙烯膜40 min。2%的BSA室温下孵育1 h,加一抗(兔抗Bcl-2、Bax,MMP-1,MMP-13,NF-κB,p-NF-κB,IκBα,p-IκBα及GAPDH多克隆抗体,稀释度均为1∶1 000)4 ℃过夜孵育,室温孵育二抗[辣根过氧化物酶标记山羊抗兔IgG(H+L),稀释度为1∶500],根据化学发光免疫试剂盒说明书在凝胶成像系统中曝光蛋白条带,分析条带灰度值。
1.9 统计学分析
2 结果
2.1 BMSCs对IL-1β诱导的软骨细胞活力的影响
与正常对照组比较,IL-1β组细胞活力降低(P<0.01);与IL-1β组比较,BMSCs组活力提高(P<0.01,见表2)。
2.2 BMSCs对IL-1β诱导的软骨细胞中Aggrecan及ColⅡ mRNA表达量的影响
与正常对照组比较,IL-1β组Aggreca mRNA表达量均显著降低(P<0.01);与IL-1β组比较,BMSCs组Aggrecan及ColⅡmRNA表达量均显著提高(P<0.01,见表2)。

表2 BMSCs对IL-1β诱导的软骨细胞活力及Aggrecan、ColⅡ mRNA表达量的影响Table 2 Effect of BMSCs on the viability and the expression of Aggrecan, ColⅡ mRNA in chondrocytes induced by IL-1β
与正常对照组比较,**P<0.01;与IL-1β组比较,##P<0.01
2.3 BMSCs对IL-1β诱导的软骨细胞中Bcl-2、Bax、MMP-1和MMP-13蛋白表达量的影响
与正常对照组比较,IL-1β组Bcl-2表达量下调(P<0.01),Bax、MMP-1、MMP-13蛋白表达量均显著上调(P<0.01);与IL-1β组比较,BMSCs组Bcl-2表达量上调(P<0.01),Bax、MMP-1、MMP-13蛋白表达量均显著下调(P<0.01,见图1、表3)。
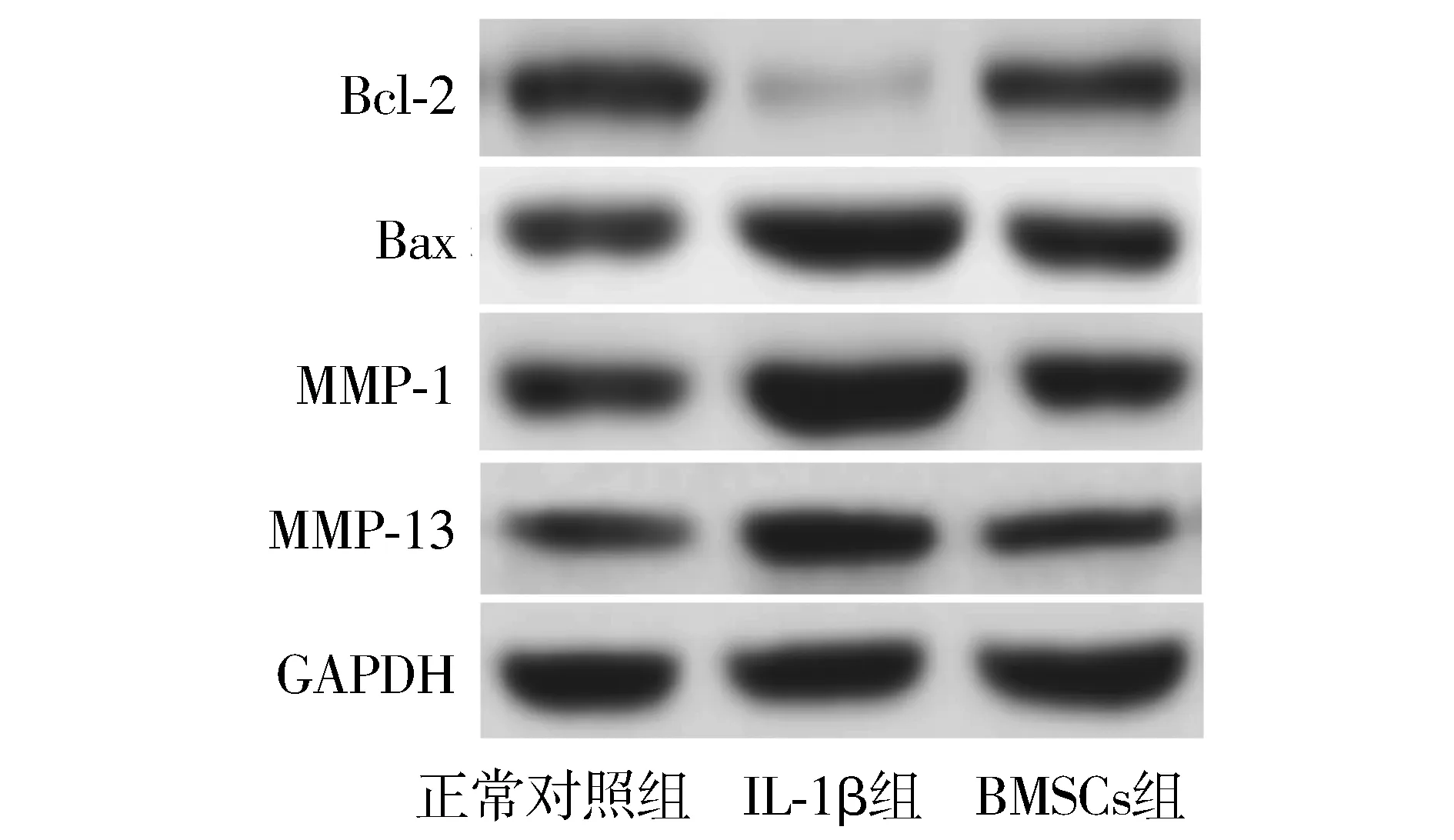
图1 Western blot检测BMSCs对IL-1β诱导的软骨细胞中Bcl-2、Bax、MMP-1和MMP-13蛋白表达量的影响Figure 1 Effect of BMSCs on the expression of Bcl-2, Bax, MMP-1 and MMP-13 in chondrocytes induced by IL-1β by Western blot

表3 BMSCs对IL-1β诱导的软骨细胞中Bcl-2、Bax、MMP-1和MMP-13蛋白表达量的影响Table 3 Effect of BMSCs on the expression of Bcl-2, Bax, MMP-1 and MMP-13 in chondrocytes induced by IL-1β
与正常对照组比较,**P<0.01;与IL-1β组比较,##P<0.01
2.4 BMSCs对IL-1β诱导的软骨细胞中p-NF-κB、p-IκBα蛋白表达量的影响
与正常对照组比较,IL-1β组p-NF-κB、p-IκBα蛋白表达量均显著上调(P<0.01);与IL-1β组比较,BMSCs组p-NF-κB、p-IκBα蛋白表达量均显著下调(P<0.01,见图2、表4)。

图2 Western blot检测BMSCs对IL-1β诱导的软骨细胞中p-NF-κB、p-IκBα蛋白表达量的影响Figure 2 Effect of BMSCs on the expression of p-NF-κB and p-IκBα in chondrocytes induced by IL-1β by Western blot

表4 BMSCs对IL-1β诱导的软骨细胞中p-NF-κB、p-IκBα蛋白表达量的影响Table 4 Effect of BMSCs on the expression of p-NF-κB and p-IκBα in chondrocytes induced by IL-1β
与正常对照组比较,**P<0.01;与IL-1β组比较,##P<0.01
3 讨论
BMSCs是一种从包括骨髓、脂肪、滑膜、肌肉等组织中分离培养获得的干细胞,培养方法简单、易于分离、纯化,而且有多种分化潜能,在不同的诱导条件下可定向分化未软骨细胞、神经细胞、成骨细胞等,为组织的修复和再生提供新的治疗方法。目前研究发现,BMSCs与软骨细胞共培养,能显著地促进细胞的增殖与分化,但其作用机制尚不明确。
软骨细胞增殖和细胞外基质的合成是生理条件下关节软骨的基本特征。蛋白聚糖(aggrecan)和Ⅱ型胶原蛋白(ColⅡ)是细胞外基质的基本成分,二者的表达水平能很好地体现软骨细胞外基质的合成情况[11],12]。基质金属蛋白酶(MMPs)是降解细胞外基质成分的主要水解酶,在骨骼发育、骨重建过程中起重要作用。MMP-1和MMP-13能够水解软骨组织中的Ⅱ型胶原蛋白、蛋白多糖,能水解Ⅳ、Ⅸ胶原蛋白,因此在OA的发生发展过程中扮演重要角色。
本研究采用IL-1β诱导软骨细胞模拟体外OA模型,使用BMSCs与软骨细胞共培养,探讨BMSCs对IL-1β诱导的软骨细胞损伤的影响,结果表明BMSCs能显著地提高软骨细胞活力,上调aggrecan、ColⅡ mRNA表达,并下调MMP-1、MMP-13表达,提示BMSCs通过促进软骨细胞外基质合成和抑制细胞外基质降解,缓解IL-1β诱导的软骨细胞损伤。
NF-κB是一种广泛存在于真核细胞中的与炎症反应密切相关的核转录因子,含p50、p52、p65、RelB及c-Rel等5个亚基,其中p50/60常被称为NF-κB。NF-κB在静息状态下,与上游IκB蛋白形成三聚体,在TNF-α、IL-1β及IL-6等炎症因子刺激下,IκB蛋白从三聚体解离,使p50及p65暴露,其中p65由细胞浆进入细胞核,与DNA增强子特异性位点结合,进而调控靶基因转录,影响细胞的增殖、凋亡和炎症反应等生物学行为。Bcl-2家族是最常见的细胞凋亡调控家族,其中Bcl-2是研究最为广泛的抗凋亡蛋白,能够与促凋亡蛋白Bax形成异二聚体,阻断凋亡信号传递给Caspase家族,促进细胞存活与生长。Bax能自身形成二聚体,传递凋亡信号,诱导细胞凋亡。研究显示,NF-κB信号通路在OA发生发展过程中被高度激活,且阻断NF-κB信号通路已成为OA治疗的手段之一[13-15]。本研究探讨BMSCs对IL-1β诱导的软骨细胞中NF-κB信号通路相关蛋白的表达的影响,结果表明BMSCs能显著地上调Bcl-2表达,下调p-NF-κB、p-IκBα、Bax表达,从而抑制IL-1β诱导的软骨细胞炎症反应及细胞凋亡。
综上所述,BMSCs能显著地提高IL-1β诱导的软骨细胞活力,促进细胞外基质成分的合成,抑制其降解,与上调aggrecan、ColⅡ mRNA表达,下调MMP-1、MMP-13表达有关。而且BMSCs也能显著地抑制IL-1β诱导的软骨细胞炎症反应及细胞凋亡,与上调Bcl-2表达和下调p-NF-κB、p-IκBα、Bax表达有关。
