KIF23在结直肠癌中的表达及其临床意义*
2020-06-05
结直肠癌是一种常见的恶性肿瘤,在全球其发病率及死亡率均位居第3位[1]。近几十年中,中国结直肠癌的治疗已经取得了实质性进展,但是结直肠癌相关的死亡率并未显著改善[2-4]。因此,探索具有诊断价值的肿瘤标记物对于结直肠癌患者的早期诊断和预后至关重要。
驱动蛋白家族(KIFs)是一类微管依赖的运动蛋白,主要负责微管稳定、解聚、细胞内转运和细胞分裂[5]。自1985年首次证实以来,驱动蛋白家族成员陆续被发现,包括14个超家族(超过40个成员)[6]。越来越多的证据表明,驱动蛋白在多种癌症的发生和发展中发挥重要作用[7-8]。KIF23是驱动蛋白家族中的一员,其在细胞运动过程中骨架的改变和细胞分裂过程中纺锤体的形成均有重要作用[9-10]。KIF23在多种癌症中过表达,但目前尚缺乏KIF23在结直肠癌中的研究报道。
本研究通过分析TCGA 数据库中KIF23在结直肠癌组织中的表达,应用免疫组织化学法对116例结直肠癌患者中KIF23的表达进行检测,探讨其表达与临床病理特征及预后的关系。
1 材料与方法
1.1 病例资料
回顾性分析2010年2月至2013年2月期间于河南大学淮河医院行手术治疗的116例结直肠癌患者组织标本及临床病理资料。纳入标准:1)有完整临床资料;2)术后病理确诊为结直肠癌患者;3)术前未行放疗、化疗及内分泌等治疗;4)已签署知情同意书。排除标准:1)复发性结直肠癌患者;2)合并其他肿瘤病史。其中男性67例,女性49例。肿瘤分化程度:高分化3例,中分化86例,低分化27例。肿瘤位置:升结肠26例,横结肠7例,降结肠4例,乙状结肠23例,直肠56例。根据美国癌症联合委员会(AJCC)第8版确定肿瘤TNM分期。
1.2 方法
1.2.1 随访 通过门诊或住院就诊、电话、微信等方式随访,确诊时间为起点,所有患者进行5年随访,期间若有肿瘤复发、转移或死亡则终止随访。
1.2.2 生物学分析 本研究从TCGA数据库(https://cancergenome.nih.gov/)下载所有可用的结直肠癌KIF23 mRNA数据表达谱,包括380例癌组织和51例癌旁正常组织,使用Excel 2019和GraphPad 6.0 软件对数据进行Log2转换和分析。
1.2.3 免疫组织化学法检测 结直肠癌组织中KIF23 蛋白表达的检测严格按照SP 免疫组织化学试剂盒说明书进行操作。将石蜡包埋的组织标本行连续切片,厚度约4 μm,切片行二甲苯常规脱蜡,梯度乙醇脱水。切片置于柠檬酸抗原修复缓冲液的修复盒中于微波炉内进行抗原修复,中火8 min至沸,停火8 min 保温再转中低火7 min,3%双氧水溶液室温避光孵育25 min,血清封闭30 min 后,加入KIF23 抗体(克隆号:Q02241,1:100,美国Cusabio 公司)4℃过夜。第2天PBS 冲洗3次后加入相应种属二抗,室温孵育50 min,DAB显色剂显色,苏木素复染,返蓝,脱水,透明,中性树脂封片。
1.2.4 结果判定 病理结果由本院两名资深病理科主任医师分别阅片完成。切片中出现黄色或褐色颗粒状物质为阳性,染色强度标准评分:0分,不着色;1分,淡黄色(弱阳性);2分,棕黄色(中阳性);3分,棕褐色(强阳性)。肿瘤细胞比例:0分:无阳性结果;1分:<25%的阳性结果;2分:25%~50%的阳性结果;3分:50%~75%的阳性结果;4分:≥75%的阳性结果。将阳性结果的百分比和染色强度的得分相乘即为最终染色指数(SI):0~1分为阴性表达,2~3分为低表达,≥4分为高表达。
1.3 统计学分析
采用SPSS 19.0软件进行统计学分析。采用χ2检验分析KIF23表达与患者病理参数及预后相关性;生存曲线采用Kaplan-Meier 法绘制,Log-Rank 检验进行单因素分析,Cox比例风险回归模型进行多因素分析。以P<0.05为差异具有统计学意义。
2 结果
2.1 结直肠癌与癌旁正常组织中KIF23 mRNA表达水平
在TCGA数据库中,对结直肠癌与癌旁正常组织中KIF23的mRNA表达水平进行统计分析。结果显示,在配对组织(P<0.001,图1A)及非配对组织(P<0.001,图1B)中,KIF23在结直肠癌组织中的表达水平显著高于癌旁正常组织。
2.2 KIF23在结直肠癌组织中的蛋白表达水平
采用免疫组织化学法分析KIF23在结直肠癌组织中的蛋白表达水平。KIF23 蛋白的表达主要定位于细胞质(图2),结直肠癌组织中KIF23 阳性表达呈棕色或棕褐色。结果显示,KIF23在结直肠癌组织中的阳性表达率为61.2%(71/116),阴性或低表达率为38.8%(45/116)。

图1 TCGA数据库中KIF23在结直肠癌组织及癌旁正常组织中表达差异
2.3 结直肠癌中KIF23的表达与临床病理特征的关系
如表1所示,结直肠癌中KIF23的表达与T、N、M及TNM分期密切相关(P<0.05),与性别、年龄、肿瘤大小、分化程度和肿瘤位置无相关性(P>0.05)。
2.4 KIF23表达水平与结直肠癌患者预后的相关性
Kaplan-Meier 生存分析表明,KIF23 高表达的结直肠癌患者的总生存期和无复发生存期相比低表达患者明显缩短,差异具有统计学意义(P<0.001,图3)。Cox回归分析结果显示KIF23表达可作为影响结直肠癌患者预后的独立危险因素(P<0.05,表2,3)。

图2 KIF23在结直肠癌组织中蛋白的表达情况

表1 KIF23表达与116例结直肠癌患者临床病理特征之间的关系

表1 KIF23表达与116例结直肠癌患者临床病理特征之间的关系(续表1)
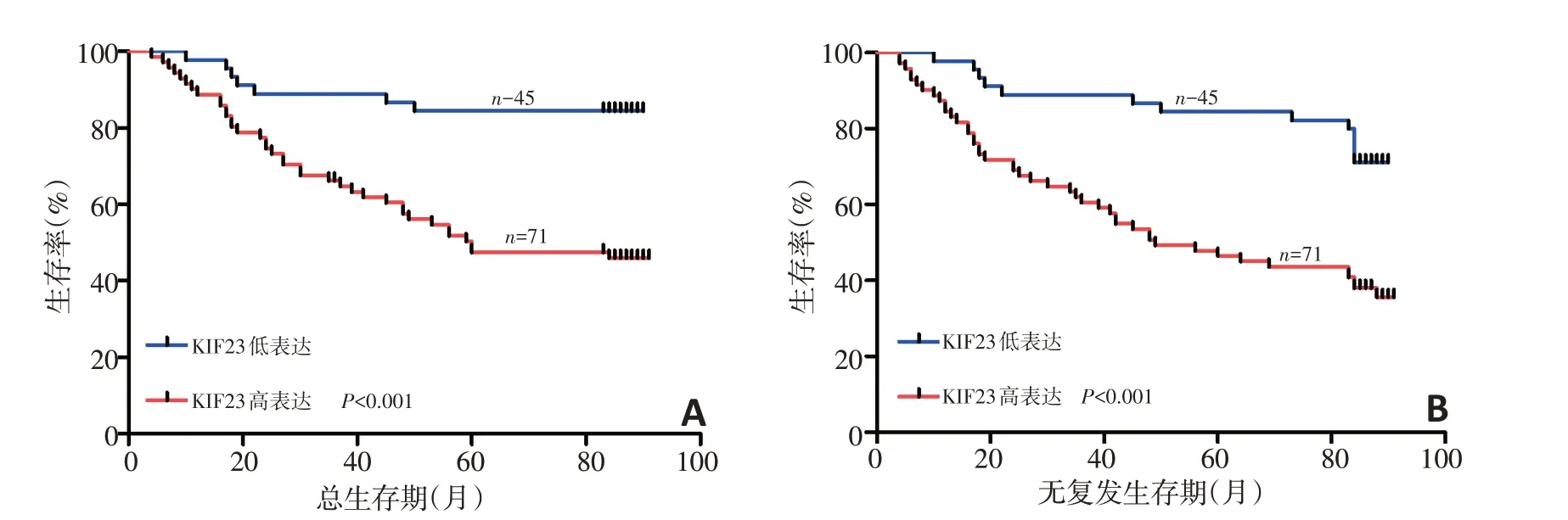
图3 Kaplan-Meier分析KIF23表达对患者预后的影响

表2 单因素及Cox多因素分析各因素对结直肠癌患者总生存期的影响
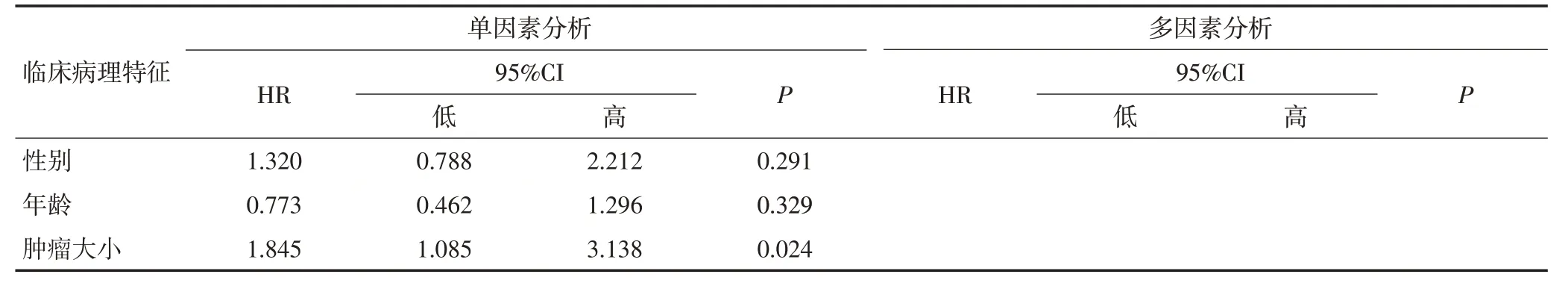
表3 单因素及Cox多因素分析各因素对结直肠癌患者无复发生存期的影响

表3 单因素及Cox多因素分析各因素对结直肠癌患者无复发生存期的影响(续表3)
3 讨论
作为驱动蛋白家族的一员,KIF23 发挥“分子马达”的作用[11]。KIF23 通过参与微管的聚合动力学,在细胞周期内催化MT细胞骨架的快速空间重塑,是细胞内转运和有丝分裂的关键调节剂[12-13]。在有丝分裂过程中,KIF23 参与了中间体的形成,并通过招募参与细胞分裂的调节因子进一步影响胞质分裂过程[14]。KIF23的过度表达可能会导致一系列问题,其中包括纺锤体的分离增加、过早的姐妹染色单体分离,以及最终单极或双极纺锤体的形成[15]。有丝分裂过程中姐妹染色体分离发生异常,导致染色体非整倍性和基因组的不稳定,最终可能诱发肿瘤[16]。
近年来研究发现,KIF23在多种恶性肿瘤中表达上调,且与肿瘤转移和不良预后相关,参与肿瘤的恶性进展过程。KIF23过表达与ER阳性乳腺癌患者预后显著相关,敲除KIF23可抑制他莫昔芬敏感和耐药乳腺癌细胞的增殖并诱导凋亡[17]。有研究显示,KIF23在肝细胞肝癌中表达上调,且与患者不良预后相关[18]。在非小细胞肺癌中KIF23 高表达,沉默KIF23表达可抑制肿瘤细胞增殖并诱导细胞凋亡,从而改善患者预后[19]。本研究证实KIF23在结直肠癌组织中高表达,并且高表达KIF23 患者预后较差,与上述结论一致。通过分析KIF23表达与临床病理特征的相关性,得出KIF23表达水平与T、N、M及TNM分期密切相关,提示其与结直肠癌的发生、发展有关。进一步通过Cox回归分析说明KIF23表达是影响结直肠癌患者总生存期及无复发生存期的独立危险因素。提示KIF23可能作为预测结直肠癌患者发生发展及预后的分子标记物。
既往研究表明,KIF23与影响肿瘤细胞分裂、染色体分离、增殖和转移的多种癌基因的表达相关[18]。有研究发现沉默KIF23在体内和体外均抑制了神经胶质瘤细胞的增殖,并且在转录水平上受TCF-4调控[20]。TCF-4是经典Wnt/β-catenin/TCF 通路的核心组成部分[21],其与细胞核中的β-catenin相互作用形成复合物,从而调节多个基因的转录,影响细胞的增殖、分化、存活和凋亡。有研究表明,通过shRNA沉默KIF23调控细胞有丝分裂过程可抑制肿瘤细胞的增殖,从而影响胃癌的发生发展[22]。Li等[23]研究发现,卵巢癌细胞中过表达的KIF23可促进肿瘤细胞增殖和迁移以及细胞周期进展。但是KIF23在肿瘤中作用的分子机制尚未明确,有待进一步研究。
综上所述,KIF23高表达预示结直肠癌患者的不良预后,并参与结直肠癌的发生发展过程。因此,监测KIF23表达可能为结直肠癌的临床诊疗及预后评估提供重要的参考价值。
