HER2分子影像探针99m Tc-HP7的放射性标记与肿瘤SPECT/CT显像
2020-06-05宋宏杰周治国王明伟
宋宏杰 ,张 健 ,石 琴 ,周治国,王明伟
1.复旦大学附属肿瘤医院核医学科,复旦大学上海医学院肿瘤学系,上海 200032;2.复旦大学生物医学影像研究中心,上海 200032;
3.上海分子影像探针工程技术研究中心,上海 200032;
4.上海师范大学化学与材料科学学院,上海 200234
人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)在多种癌症中过表达,包括乳腺癌、卵巢癌、胃癌、结直肠癌等[1],使得相关肿瘤具有恶性程度高、侵袭力强、易转移、预后差等特点。目前,HER2是重要的肿瘤分子靶点,而且HER2靶向抗体药物已被纳入关键的临床治疗方案,因此,肿瘤诊断和靶向治疗均需要有效的HER2表达检测方法。
目前,临床检测HER2的常用方法是免疫组织化学(immunohistochemistry,IHC)和荧光原位杂交(fluorescence in situ hybridization,FISH)。然而,两者均有一定局限性,包括由于活检取样导致的创伤性和取样误差,不能多次、动态取样检查,通常只能在原发灶取样而不能在其他转移灶取样,无法进行全身评价[2],因而缺乏整体、动态等系统性观察能力。研究[1]表明,肿瘤HER2表达具有明显的异质性,即HER2表达在原发病灶的不同区域内、原发肿瘤和转移肿瘤之间、不同转移灶之间及不同患者之间等都可能是不同的和变化的。分子影像检查可以实时、全面、无创、实时定量地检测HER2表达,为克服上述问题提供了有效的解决途径,特别是高灵敏度的、基于放射性核素的核医学分子影像检查[3]。
核素标记HER2抗体是目前主要的HER2靶向分子影像探针。然而,抗体相对分子质量大(约150×103),血液清除速度慢,成像时间长(通常为注射后3~5 d),给使用带来不便。多肽则易于制备和储存,性质稳定,而且相对分子质量小,血液清除快,具有开发为分子影像探针的理想性质[4]。因此,核素标记HER2靶向性多肽是HER2分子影像探针的重要发展方向,具有注射后及时成像的特点,临床应用潜力很大。
基于组合多肽文库技术的研究[5]发现,一种序列模型为LTVXPWX的7肽可与HER2阳性乳腺癌细胞发生明显的结合和内吞作用[6],特别是其中LTVSPWY序列的亲和力最强[7]。本研究选取该七肽为HER2靶向配体,经过螯合剂HYNIC修饰,实现核素99mTc标记,获得HER2分子影像探针99mTc-HYNIC-LTVSPWY(99mTc-HP7),并开展其不同HER2表达水平的肿瘤单光子发射型计算机断层显像/计算机断层扫描(single-photon emission computed tomography/computed tomography,SPECT/CT)显像及其肿瘤摄取与HER2表达相关性的研究。
1 材料和方法
1.1 试剂与器材
委托上海科肽生物科技有限公司合成HYNIC-LTVSPWY(HP7)衍生物;无水氯化亚锡和三(羟甲基)甲基甘氨酸(Tricine)购自北京百灵威科技有限公司;乙二胺二乙酸(EDDA)来源于东京化成工业株式会社;高锝酸钠(Na99mTcO4)购自上海原子科兴药业有限公司。所有化学试剂均为分析纯,没有进一步纯化直接使用。
采用美国Agilent Technologies公司的1260 Infinity高效液相色谱仪(high performance liquid chromatography,HPLC),拉脱维亚Biosan公司的TS-100恒温振荡器,美国Waters公司Seppak®Plus C18柱;美国CRPINTEC公司CRC-25R活度计,德国Merck公司TLC Silica gel 60 F254铝基硅胶板,德国Raytest公司miniGita Star放射性薄层色谱扫描仪(radioactive thin layer chromatography,Radio-TLC),美国Bioscan公司Nano SPECT/CT PLUS小动物SPECT/CT。
1.2 HP7的准备与分析
HPLC分析条件:分析柱为ZORBAX 300SBC18柱(5 μm,250 mm × 4.6 mm),流动相由溶液A[0.1%三氟乙酸(trifluoroacetic acid,TFA)的水溶液]和溶液B(0.1% TFA的乙腈溶液)组成,浓度梯度为0 min(80%A,20%B)、25 min(15%A,85%B)、30 min(0%A,100%B)、35 min(0%A,100%B),流速为1.0 mL/min,进样量为20 μL,紫外检测波长为214 nm。
1.3 99mTc-HP7放射性标记
为了标记99mTc-HP7,取含有20 μg HP7的Eppendorf试管,加入500 μL EDDA(20 mg/mL,溶于0.1 mol/L NaOH溶液)和500 μL Tricine(40 mg/mL,溶于0.2 mol/L磷酸盐缓冲溶液,pH=6.0),混匀;再加入Na99mTcO4溶液(约5 mCi,1 Ci=3.7×1010Bq),混匀;再加入5 μL SnCl2(1.0 mg/mL,溶于0.1 mol/L HCl溶液),混匀,于100 ℃下加热反应15 min。
如果反应不完全时,采用Sep-Pak C18柱分离纯化。将反应液加入预处理的C18柱,先用5~10 mL水淋洗,再用1~2 mL乙醇淋洗,加热挥发出去乙醇,加入1~3 mL 0.9%的NaCl溶液溶解,获得99mTc-HP7注射液。
利用Radio-TLC分析99mTc-HP7的标记率和放射化学纯度。将反应液点样于硅胶板,分别以丙酮、0.1 mol/L柠檬酸盐缓冲液(pH=5.0)和甲醇/乙酸铵(体积比为1∶1)作为展开剂。
1.4 体外稳定性实验
取100 μL99mTc-HP7溶液分别加入至等体积的0.9% NaCl溶液和马血清中,于37 ℃分别温育1、3、6、18及24 h。在每个时间点,将溶液点样在硅胶板上,以0.1 mol/L柠檬酸盐缓冲液(pH=5.0)为展开剂,进行Radio-TLC分析,测定各个时间点的放化纯度。
1.5 SPECT/CT显像
根据参考文献[8],选择HER2表达水平不同的人胃癌NCI-N87、卵巢癌SKOV-3和结肠癌HT-29细胞系均来自中国科学院典型培养物保藏委员会细胞库/中国科学院上海生命科学研究院细胞资源中心,分别用包含10%胎牛血清(fetal bovine serum,FBS)、100 μg/mL青霉素、100 μg/mL链霉素的RPMI-1640培养基、McCOY’s 5A培养基和McCOY’s 5A培养基培养。将细胞培养瓶置于37 ℃、CO2体积分数为5%的培养箱中,每过48 h细胞传代1次,处于对数生长期的细胞用于实验。
5周龄BLAB/c裸小鼠购自上海斯莱克实验动物有限公司,将处理好的NCI-N87、SKOV-3和HT-29细胞分散在PBS溶液中,取0.1 mL细胞悬液(1×107个细胞) 注射于裸小鼠右前肢皮下。肿瘤生长至长径0.5~1.0 cm,用于SPECT/CT成像实验。
采用快速截留超绿-超红方法(以下用FIE表示),即EGR2中的3G和2.4R的值若大于255,则看作255,计算得到的ExG - ExR2值只能够保留大于0的像素[7]。
各取3只NCI-N87、SKOV-3和HT-29模型鼠,将0.9~1.1 mCi99mTc-HP7溶液经尾静脉注射到荷瘤鼠体内,分别于注射后0.5、1.0和3.0 h进行SPECT/CT显像。分析肿瘤(T)及对侧肌肉(M)的放射性摄取%ID/g值,并计算T/M比值。
1.6 蛋白质印迹法(Western blot)和免疫组织化学实验
分别选择并处死3只NCI-N87、SKOV-3和HT-29模型荷瘤鼠,剥离获取肿瘤组织,用于Western blot实验的瘤块冻存于-80 ℃,用于免疫组织化学分析的瘤块置于4%多聚甲醛固定。所有瘤块委托上海晶莱生物技术有限公司处理,最终获得Western blot条带图及免疫组织化学图像(×200)。利用Image J软件分析Western blot条带图的灰度值,采用Image Pro Plus软件分析免疫组织化学图像中HER2阳性率(average optical density,AOD)=阳性区域光密度值(integral optical density,IOD)/视野面积(mm2)。
1.7 统计学处理
2 结 果
2.1 HP7的纯度
HPLC分析结果显示,HP7的纯度大于95%(图1),冷冻干燥后易于保存,有利于后续的放射性核素99mTc标记实验。
2.2 99mTc-HP7的标记率和放射化学纯度
99mTc-HP7标记反应液在不同展开体系中的Radio-TLC谱图见图2。丙酮为展开剂时,只有未标记的游离99mTcO4移到前沿,99mTc胶体、99mTc-HP7肽和99mTc-共配体复合物三者均处于原点。0.1 mol/L柠檬酸盐缓冲液(pH=5.0)为展开剂时,游离99mTcO4和99mTc-共配体复合物二者移到前沿,99mTc-胶体和99mTc-HP7仍然处于原点。甲醇/乙酸铵(体积比为1∶1)为展开剂,99mTcO4、99mTc-共配体复合物和99mTc-HP三者一起移到前沿,只有99mTc-胶体处于原点[9]。根据3种展开体系Radio-TLC谱图主峰的百分比,可以计算出99mTc-HP7肽的标记率大于95%。说明99mTc-HP7肽的标记率高,不需要进一步分离纯化,所得99mTc-HP7溶液的放射化学纯度大于95%,能够满足后续的体内显像实验。
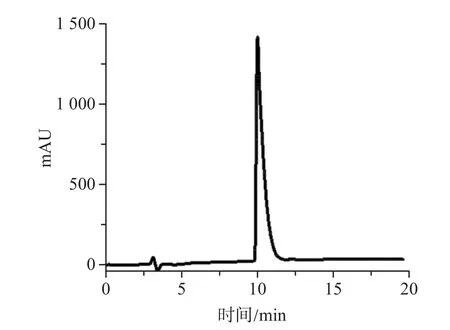
图1 HP7的HPLC分析谱图
2.3 99mTc-HP7的体外稳定性
图3是99mTc-HP7在24 h内的体外稳定性曲线,反映不同时间点99mTc-HP7的放射化学纯度的变化。99mTc-HP7在0.9%的NaCl溶液和马血清两种体系中的稳定性在6 h以内都保持在95%以上,在24 h内大于85%以上。因此,99mTc-HP7具有良好的体外稳定性,可用于体内显像实验。
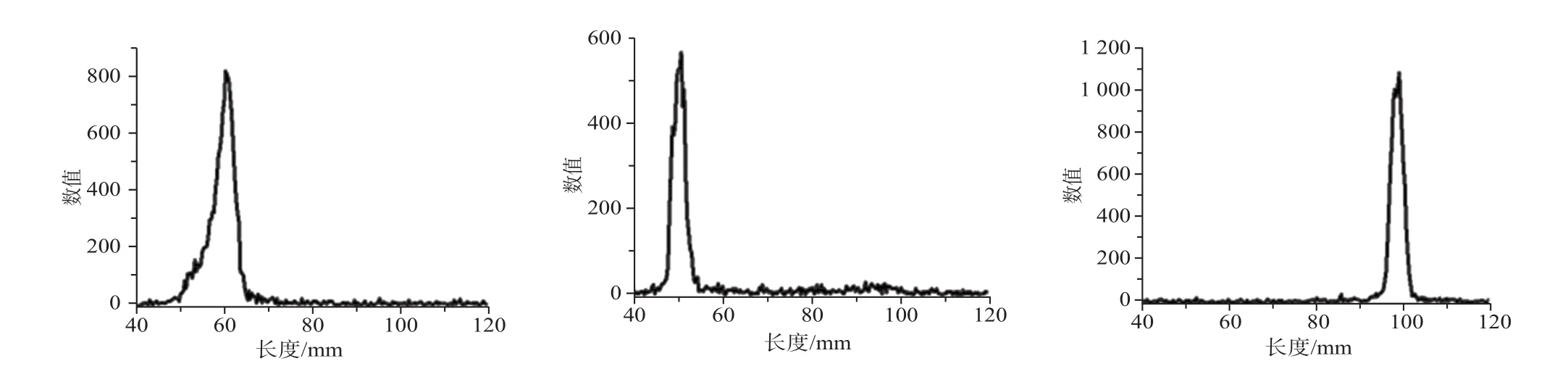
图2 99mTc-HP7标记溶液的Radio-TLC谱图
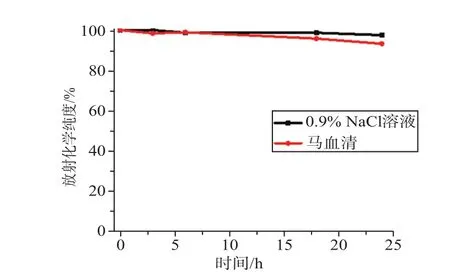
图3 99mTc-HP7的体外稳定性
2.4 肿瘤模型99mTc-HP7 SPECT/CT显像
图4是注射后不同时间3种肿瘤模型NCI-N87(A)、SKOV-3(B)和HT-29(C)的99mTc-HP7 SPECT/CT图像。99mTc-HP7在NCI-N87、SKOV-3和HT-29肿瘤内显像信号依次降低。定量分析发现,对于NCI-N87和SKOV-3模型,注射后1 h99mTc-HP7的肿瘤摄取较高(大于1.0%ID/g),3 h时明显降低,同时全身血液清除基本完全,因此3 h时靶本比最高,表现出较好的肿瘤靶向性和较高的图像对比度。对于HT-29模型,99mTc-HP7的肿瘤摄取较低(小于1.0%ID/g),并随着时间快速减少,其靶本比较低,肿瘤显像不明显。
2.5 肿瘤组织HER2表达的Western blot和免疫组织化学检测
从Western blot条带图(图5)可知,反映NCI-N87(左)、SKOV-3(中)和HT-29(右)肿瘤组织HER2表达的条带灰度依次降低,其半定量分析得到3种肿瘤组织对应的条带相对灰度值分别为1.27、0.44和0.13。该实验结果表明,NCI-N87、SKOV-3和HT-29肿瘤组织的HER2表达水平明显不同,呈现高、中、低依次降低的趋势。

图4 肿瘤模型99mTc-HP7 SPECT/CT图像及其定量分析
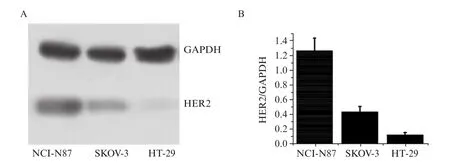
图5 肿瘤组织HER2表达的Western blot条带图(A)及定量灰度值分析(B)
免疫组织化学染色结果(图6)清楚地显示NCI-N87、SKOV-3和HT-29这3种肿瘤组织的不同程度的HER2表达,对应的定量AOD值依次降低,这与Western blot结果一致。同时,H-E染色结果显示,肿瘤组织形态正常,无明显坏死现象。
由于99mTc-H P 7是H E R 2靶向探针,NCI-N87、SKOV-3和HT-29肿瘤组织的HER2表达水平是其肿瘤摄取的关键因素,因此我们研究了99mTc-HP7的肿瘤摄取与HER2表达水平的相关性。相关性分析所示,两者之间呈现明显的正相关性(r=1.000),且差异有统计学意义(P<0.05,图7)。
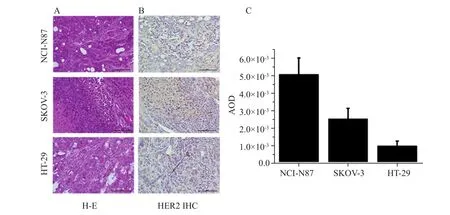
图6 肿瘤组织的H-E染色(A)与HER2免疫组织化学染色(B)及其定量AOD值分析(C)
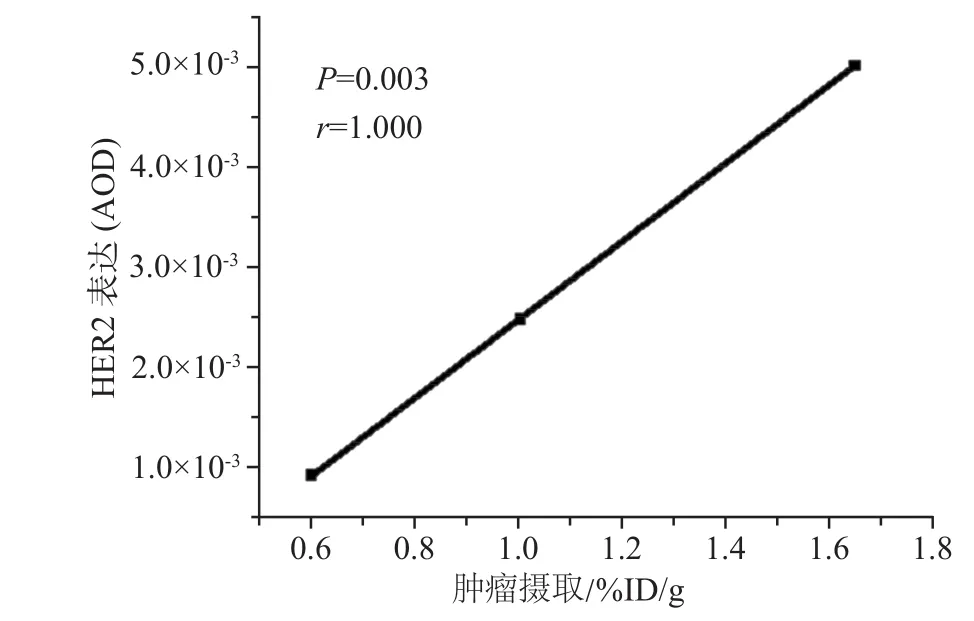
图7 肿瘤摄取与HER2表达水平的相关性分析
3 讨 论
研究[10]发现,HER2在乳腺癌等多种常见肿瘤中高表达,这类肿瘤具有恶性程度高、进展快、易出现早期复发转移和患者生存率低的特点。近年来,靶向HER2单克隆抗体已经成功地应用于临床治疗[11],比如曲妥珠单抗,可显著提高HER2阳性肿瘤患者的生存率。因此,有效检测HER2表达状态和动态变化对于精准肿瘤诊断、靶向治疗患者选择和疗效评价具有非常重要的意义。
为了开展HER2靶向分子影像,本研究利用放射性核素99mTc标记HER2靶向多肽HP7,开发了HER2阳性肿瘤SPECT/CT分子影像探针99mTc-HP7。它具有多个方面的优势:①99mTc是临床肿瘤核医学显像诊断使用最多的核素,来源于发生器,方便易得,已发展了多样化的标记方法;② SPECT/CT是较为普及的临床核医学显像诊断仪器,费用较低,较为普惠,有利于应用推广;③ 与核素标记单克隆抗体类分子影像探针的相对分子质量大、血液清除慢、最佳显像时间较长、生产难度大且成本高等不足相比,核素标记多肽类探针具有相对分子质量小、血液清除快、注射后及时显像、易于生产且成本低等优势。
本研究采用基于螯合剂的方法实现了99mTc-HP7的放射性标记制备。目前,99mTc标记方法主要包括直接标记法[12]和间接标记法[13]。对于直接标记,99mTc通过生物分子中的多个供体基团(-COOH、-NH2-,-OH等)直接与其连接,存在稳定性较差的问题[12]。对于间接标记,99mTc通过双功能螯合剂连接与多肽等形成较为稳定的结合,同时具有方法简便、反应条件温和、标记率高等特点。因此,本研究使用间接方法从而避免99mTc标记对肽和靶分子生物活性的影响。需要指出的是,HYNIC作为螯合剂时,需要引入其他共配体参与螯合以形成稳定的络合物。文献[14-16]报道,选用Tricine和EDDA作为共配体,有利于提高标记率和稳定性,这也成为本研究制备99mTc-HP7的方法基础。
根据荷瘤鼠全身SPECT/CT显像,本研究发现,99mTc-HP7的体内生物分布以肾脏和肠道分布代谢为特征。99mTc-HP7在肾脏和膀胱的放射性显像信号很高,这与它的相对分子质量小有关,符合多肽在体内主要通过肾脏代谢的一般特点。99mTc-HP7在胆囊和肠道的分布较高,这与HP7序列富含脂肪烃基和芳香基而亲脂性较高的性质吻合,也与类似文献报道[17]一致。
为了验证基于99mTc-HP7标记的SPECT/CT显像肿瘤HER2表达的可行性,本项研究开展了3种HER2表达不同的肿瘤(胃癌NCI-N87、卵巢癌SKOV-3和结肠癌HT-29)显像。实验结果表明,这3种显像信号依次降低,其中HER2表达较高的NCI-N87和SKOV-3肿瘤显像清楚,而HER2表达低的HT-29肿瘤显像不明显。Western blot和免疫组织化学实验均证实了3种肿瘤组织HER2表达呈高、中、低的水平,说明HER2介导99mTc-HP7特异性摄取,同时也解释了实验肿瘤摄取99mTc-HP7肽探针高低的原因,与类似探针的报道[18]一致。进一步的相关性分析发现,99mTc-HP7肿瘤摄取与HER2表达水平呈现良好的正相关关系。
综上所述,本研究开发了HER2阳性肿瘤SPECT/CT分子影像探针99mTc-HP7,其制备方法简便,标记效率高,肿瘤靶向性良好,且与肿瘤HER2表达水平有关,能够实现在体内HER2表达水平显像。总之,99mTc-HP7表现出较为理想的探针性质及显像效果,具有作为HER2分子影像探针的潜力。
