单纯性乳腺导管内癌的超声声像图特征及病理学特征分析研究
2020-06-05
南京医科大学第一附属医院超声诊断科,江苏 南京 210029
乳腺导管内原位癌(ductal carcinoma in situ,DCIS),是乳腺肿瘤细胞发生于导管内,但尚未侵袭至基底膜的一种癌变,典型的病理学特征为上皮细胞的轻度至重度不典型增生,有发展为浸润性导管癌的趋势[1]。随着影像学诊断技术的不断发展以及女性对自身健康状况的日益重视,DCIS的检出率日益提高,约占乳腺癌整体的20%[2]。DCIS属于非浸润性乳腺癌,很少有淋巴结的转移,通过及时有效的手术治疗,DCIS患者的预后非常好,10年内患者累积死亡率为1.4%~2.8%[3]。钼靶因其对钙化的高度敏感性,既往一直是诊断DCIS的主要影像学方法,中国女性的乳腺腺体大多为致密型,对于致密型腺体钼靶的灵敏度低于高频超声[4-6]。本研究通过分析144例单纯性DCIS的超声表现及病理学特征,评估超声对DCIS的早期诊断价值,旨在为临床诊断DCIS提供更多依据。
1 资料和方法
1.1 对象
选取2016年10月—2019年4月南京医科大学第一附属医院经手术后病理学检查证实为单纯性DCIS的144例患者。纳入标准:① 均在南京医科大学第一附属医院进行手术且术后病理学检查证实为单纯性DCIS;② 术前行常规彩色多普勒超声检查,有完整的影像学资料;③ 有完整的临床资料。
1.2 仪器与方法
1.2.1 仪器
超声检查仪主要采用意大利Esaote公司的MyLab Twice彩色超声多普勒诊断仪,探头采用4~13 MHz线阵探头。
1.2.2 扫查方法
由拥有丰富工作经验的超声科医师对患者进行扫查,检查时患者平躺手上举,充分暴露双乳及腋窝,以乳头为中心对乳房的4个象限沿逆时针或顺时针方向进行扫查,同时对双侧腋窝Ⅰ区、Ⅱ区、Ⅲ区及内乳区淋巴结进行扫查。根据超声乳腺影像报告和数据系统(Breast Imaging Reponing and Database System,BI-RADS)对病灶的形态、大小、边缘、方位、内部回声、后方回声、有无钙化、导管是否扩张、血流及周围组织进行观察。
1.3 病理学诊断
DCIS病理组织学分级主要参照浸润性乳腺癌,根据细胞核分裂相分为低级别、中级别及高级别。免疫组化标志物主要包括雌激素受体(estrogen receptor,ER)、孕激素受体(progestogen receptor,PR)、人类表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)及Ki-67标记指数4种[7]。根据这4种生物标志物将乳腺癌分为4种分子亚型:Luminal A型、Luminal B型、HER2阳性型及三阴性型。
1.4 图像分析
对144例乳腺单纯性DCIS的超声声像图进行回顾性分析,分析病灶的形态特征、有无钙化、导管是否扩张、血流信号等特点,对其图像进行分类分析。根据超声图像上是否表现钙化分为钙化组和非钙化组;根据病灶是否有明显占位感,肿块是否有明确边界分为肿块型和非肿块型。本研究将非肿块型细分为腺体紊乱型、导管扩张型(单纯性导管扩张和导管扩张伴低回声)、单纯钙化型及超声无表现型。
1.5 统计学处理
采用SPSS 21.0软件,计数资料以百分位数表示,采用χ2检验,P<0.05为差异有统计学意义。
2 结 果
2.1 DCIS的超声声像图特征
本研究144例患者中,有2例漏诊,超声检出率为98.6%。肿块型95例(66.0%),超声诊断准确率为83.2%(79/95);非肿块型49例(34.0%),超声诊断准确率为61.2%(30/49),其中腺体紊乱型占21例,超声诊断准确率为76.2%(16/21),导管扩张型占14例,超声诊断准确率为21.4%(3/14),导管扩张型中单纯性导管扩张及导管扩张伴低回声型均为7例,超声诊断准确率分别为0.0%(0/7)及42.9%(3/7),单纯钙化型占12例,超声诊断准确率为83.3%(10/12),超声无表现型占2例,超声诊断准确率为0.0%(0/2)。超声图像上表现出钙化的患者占75例(52.1%),超声诊断准确率为86.7%(65/75),超声图像上未表现出钙化的患者占69例(47.9%),超声诊断准确率为62.3%(43/69),钙化组的超声诊断准确率高于无钙化组且差异有统计学意义(χ²=11.362,P=0.001)。超声图像上血流分级为0级、Ⅰ级的患者占45例(31.3%),超声诊断准确率为48.9%(22/45),血流分级为Ⅱ级、Ⅲ级的患者占99例(68.8%),超声诊断准确率为86.9%(86/99),血流丰富的DCIS的诊断准确率高于血流不丰富的DCIS且差异有统计学意义(χ²=23.801,P=0.000)。
肿块型(Ⅰ):超声表现多为低回声肿块,形态不规则,边缘不光整或模糊,肿块内可见多个点状强回声,后方回声多无改变,肿块内血流信号丰富(图1)。腺体紊乱型(Ⅱ):超声表现多为腺体紊乱增厚,无明显肿块边界,腺体内回声不均匀,可见细密点状钙化,病灶内血流信号丰富(图2)。单纯导管扩张型(Ⅲ):超声表现多为单纯的导管扩张,扩张导管内未探及明显低回声充填(图3)。导管扩张伴低回声型(Ⅳ):超声表现多为扩张导管内可见低回声,管腔内透声差,可见点状钙化(图4)。单纯钙化型(Ⅴ):超声表现多为沿导管分布的密集点状钙化,无肿块感,病灶内血流信号丰富(图5)。Ⅵ型超声无表现型:此型超声声像图上无特异性表现,往往容易漏诊。
2.2 DCIS的病理学特征
本研究144例患者的病理组织学分级中,低、中级别占71例(49.3%),高级别占73例(50.7%);分子分型中Luminal A型占50例(34.7%),Luminal B型占63例(43.8%),HER2阳性型占29例(20.1%),三阴性型占2例(1.4%)。钙化组与无钙化组的病理组织学分级、分子分型差异均有统计学意义(表1~2)。
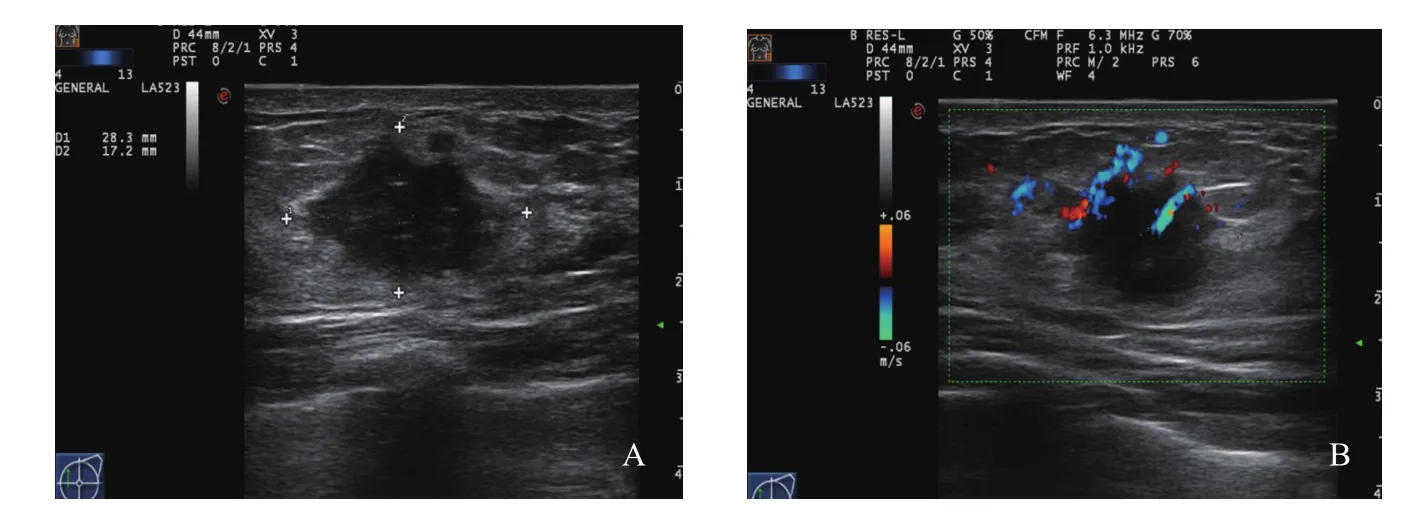
图1 肿块型DCIS超声声像图
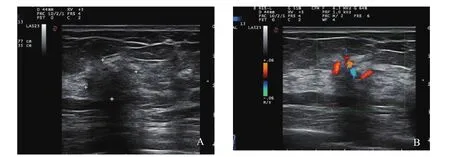
图2 腺体紊乱型DCIS超声声像图
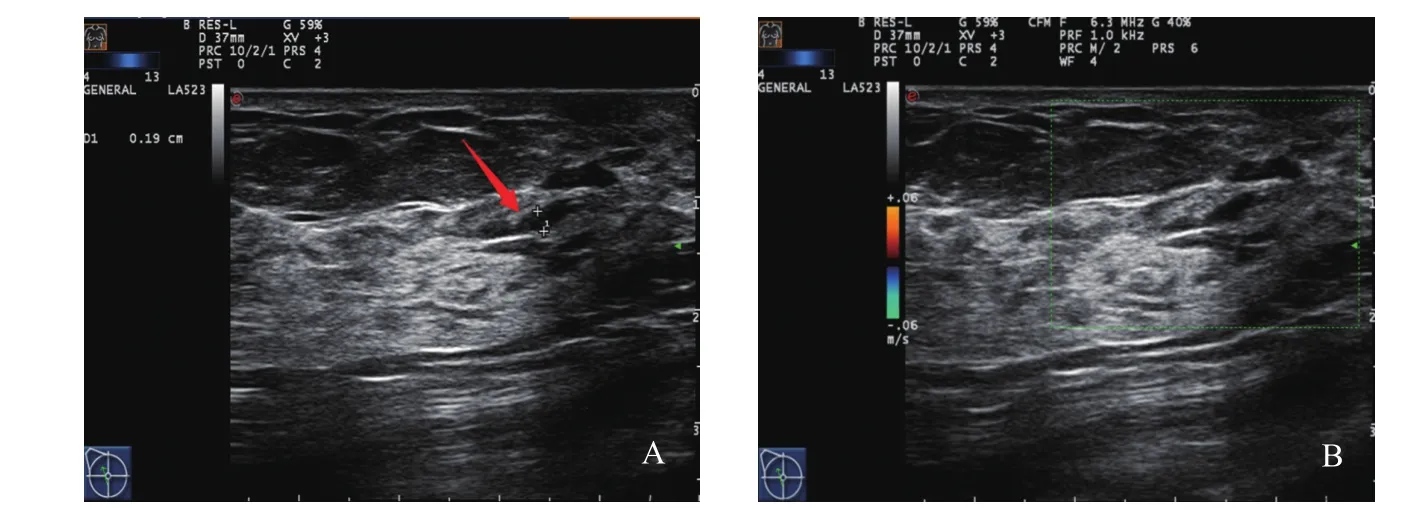
图3 单纯导管扩张型DCIS的超声声像图
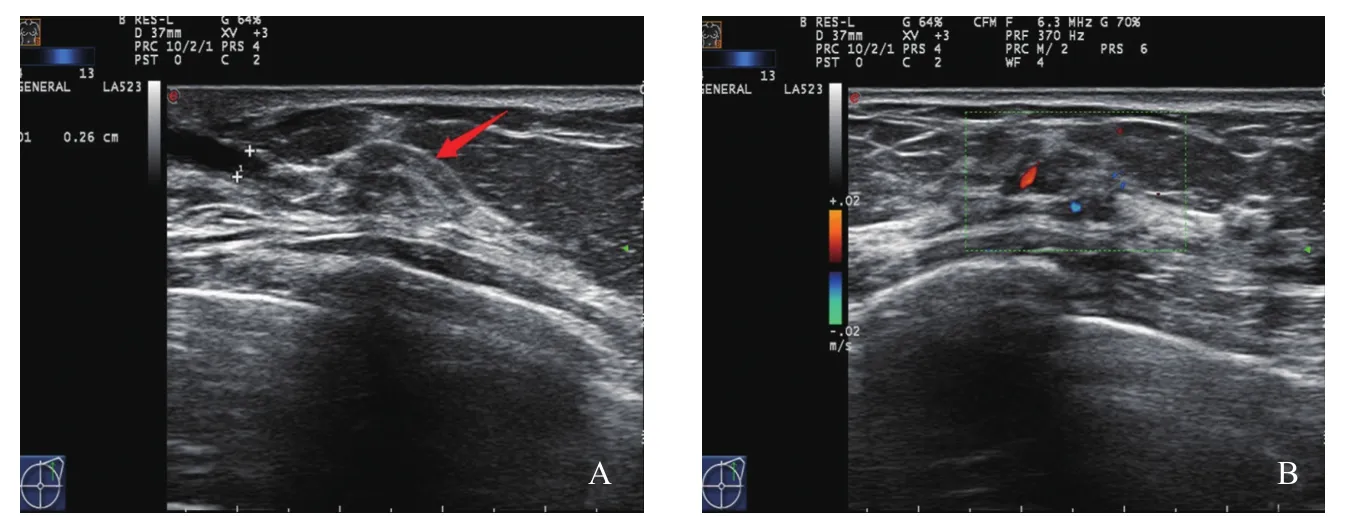
图4 导管扩张伴低回声型DCIS超声声像图
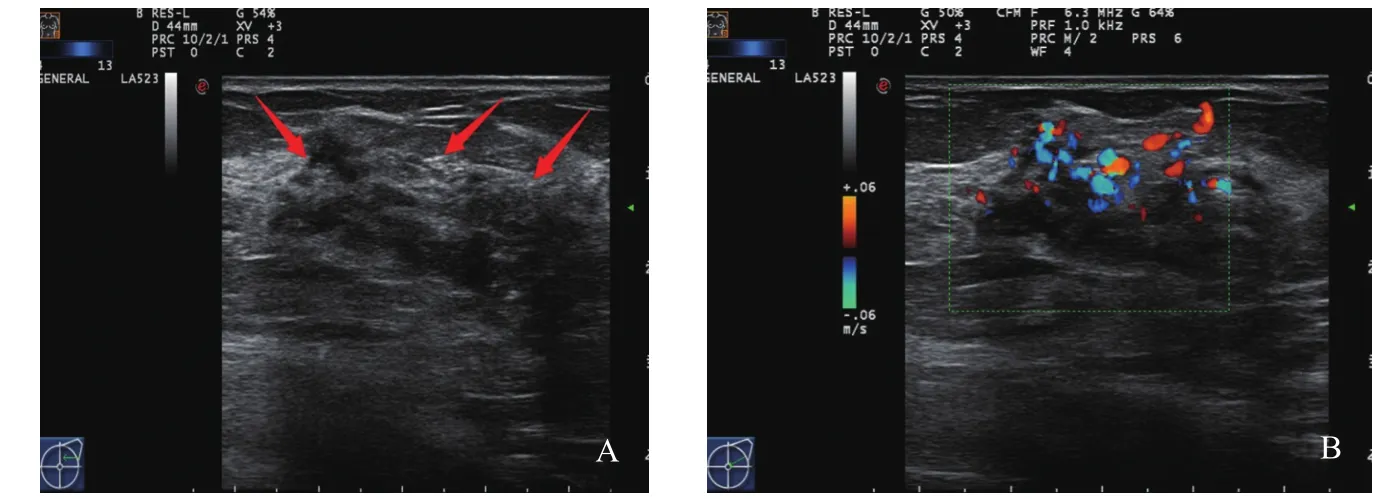
图5 单纯钙化型DCIS超声声像图

表1 钙化组与无钙化组DCIS患者的病理学分子分型及组织分级情况[n(%)]

表2 肿块组与非肿块组DCIS患者的病理分子分型及组织分级情况[n(%)]
3 讨 论
乳腺DCIS是起源于导管上皮细胞,尚未浸润间质的一种病变,有文献[8]报道,DCIS有演变为浸润性癌的风险,DCIS患者罹患乳腺浸润性癌的概率是正常人的5倍以上,大大降低了患者的生存率。因此,乳腺DCIS的早期诊断与治疗至关重要,它能显著降低患者的死亡率。目前诊断DCIS常用的影像学方法主要为超声、钼靶X线检查以及磁共振成像(magnetic resonance imaging,MRI)。钼靶X线检查因对钙化具有高度敏感性,一直都是诊断DCIS的主要影像学方法,但对无钙化的致密型乳腺成像效果不理想,容易出现漏诊。中国女性乳腺腺体与欧美女性不同,以致密型腺体为主,钼靶X线检查往往不能显示病灶,而超声检查由于其对软组织的高度敏感性,能在致密型腺体中较好地显示病灶,成为中国女性筛查诊断乳腺疾病的首要影像学手段[9]。
乳腺DCIS由于其独特的病理学与组织学特点,其超声表现也复杂多变,一直是超声诊断的一个难点。国内学者对DCIS超声表现的研究从未停止[10-11],总结其特征性表现,大多将DCIS分为肿块型与非肿块型。本研究在此基础上[10-11]将其细分为6类:肿块型、腺体紊乱型、单纯导管扩张型、导管扩张伴低回声型、单纯钙化型及超声无表现型。其中肿块型95例(65.97%),超声诊断准确率为83.15%(79/95),为DCIS最常见的超声表现,同时也是超声检出率最高的一种类型,多表现为低回声肿块,形态不规则,平行于皮肤,纵横比<1,边缘尚光整或呈微分叶状,肿块内可伴和(或)不伴微小钙化,后方回声无改变,病灶内血流丰富,阻力系数>0.7。DCIS由于是乳腺导管上皮细胞的过度增生,肿瘤细胞通常会沿导管方向蔓延,而浸润性癌肿瘤细胞则会突破基底膜,向周边间质侵袭,因此DCIS的纵横比小于1,边缘也较浸润性癌光整,此外DCIS后方回声无改变也是其与浸润性癌的区别之一[12]。本组肿块型DCIS中,有1例超声诊断BI-RADS分级为3级,钼靶漏诊,术前误诊为纤维腺瘤,因MRI发现异常强化而确诊,因此在诊断DCIS过程中,需结合其他影像学检查,以减少漏诊误诊。
微钙化是DCIS的主要特征,也是超声诊断DCIS的一个重要依据。钙化是由于肿瘤细胞快速生长,缺氧坏死从而形成钙盐沉积。李伟伟等[13]对677例DCIS的超声和钼靶图像研究发现,超声和钼靶对钙化的检出率分别为68.0%和79.3%。本组研究中超声图像上表现出钙化的患者占75例(52.08%),超声诊断准确率为86.67%(65/75),高于无钙化组且差异有统计学意义。本研究还发现,超声对肿块内伴钙化的DCIS灵敏度较高,对于紊乱腺体中的微小钙化以及扩张导管旁的细小钙化不易诊断,乳腺X线摄影则对这种类型有较高的检出率。
导管扩张型的DCIS一直是超声诊断上的难点,容易误诊或漏诊。导管扩张型的DCIS在超声图像上通常表现为单纯性导管扩张和导管扩张伴低回声结节,临床症状大多以乳头溢液为主,超声经常将此类型的DCIS误诊为导管内乳头状瘤。有研究[14]发现,导管型乳腺癌超声典型特征常表现为导管扩张伴管壁僵硬,周边可见沿导管分布的点状强回声,且病灶内血流较丰富。本组研究中导管扩张型DCIS共14例,超声诊断准确率仅为21.4%(3/14),其中单纯性导管扩张及导管扩张伴低回声型均为7例,超声诊断准确率分别为0.00%(0/7)及42.86%(3/7),超声对该类型的DCIS诊断效果不理想。其中3例因其在超声图像上表现出导管扩张伴低回声充填,管腔内局部透声欠佳,可见点状钙化而未被误诊为导管内乳头状瘤。李青国等[15]研究发现,乳管镜是诊断以乳头溢液为主要表现的导管内肿瘤的最佳诊断方法,其对导管扩张型的DCIS诊断符合率约为40%。而常规超声对导管扩张型的DCIS不敏感,需结合乳管镜检查,以减少漏诊及误诊。
在病理组织学上,高级别、粉刺型的组织类型恶性程度更高,术后复发的风险也较高[16]。根据第12届St. Gallen国际乳腺癌会议共识,可将乳腺癌分为4种分子类型:Luminal A型、Luminal B型、HER2阳性型以及三阴性型[7]。患者预后情况以Luminal A型最佳,Luminal B型次之,HER2阳性型和三阴性型预后较差。本研究发现,钙化与DCIS的病理组织学分级以及分子分型有一定相关性,钙化组病理学上多表现为高级别粉刺型,分子分型则以Luminal B型和HER2阳性型为主,而非钙化组则以低级别和Luminal A型为主,这可能是因为钙化提示肿瘤细胞侵袭性强,因此病灶内伴钙化的DCIS恶性程度大于无钙化型,患者预后也较无钙化型差。而肿块型DCIS的病理组织学分级和分子分型与超声表现为非肿块型的DCIS差异无统计学意义。高级别DCIS以肿块内伴钙化以及单纯微钙化型为主,低中级别DCIS超声表现多为形态规则,边界尚清,内部未见微小钙化的低回声肿块,与刘慧敏等[17]的研究结果相符。
综上所述,超声对肿块型DCIS以及单纯微钙化型DCIS的诊断效果较好,尤其是对肿块内伴钙化型,对单纯导管扩张型DCIS诊断效果较差,必要时需结合乳管镜检查。对于肿块内不伴钙化型超声有时会出现误诊,应结合MRI、乳腺X线摄影等其他影像学方法,必要时可行超声引导下穿刺活检,避免漏诊和误诊。DCIS的超声特征大多伴有钙化,钙化型DCIS在病理学上大多以高级别粉刺型为主,分子分型以Luminal B型和HER2阳性型为主,患者预后也较差,提示具有更高的侵袭性。不同类型的DCIS有不同的超声表现,将超声与其他影像技术相结合,对提高DCIS的诊断具有较高的价值。
