LGR4基因对脂肪转化与能量代谢的作用及其与运动协同调节机制分析
2020-06-05刘艳秋
王 勇,刘艳秋,刘 刚
(1.三明学院,福建三明365004;2.北京体育大学,北京100084)
0 引言
肥胖作为最重要的、广泛的世界性公共卫生问题之一,已经严重威胁人类健康。肥胖主要与机体长期处于能量摄入过多而消耗少造成代谢不平衡有关。摄入过剩的能量转化为甘油三酯(Tri⁃glyceride,TG)储存在脂肪细胞中形成了肥胖。大量研究主要从运动、膳食、生活方式途径探讨肥胖控制问题[1-2],但也有部分研究者注意到肥胖的遗传特征明显,基因在个体肥胖易感性方面起到关键作用[3-4]。糖蛋白激素受体(leucine-rich repeatcontaining G-protein coupled receptor 4,LGR4)在多种组织的发生、发展中起重要作用,研究发现肥胖者白色脂肪中LGR4表达明显增加,对于全身性LGR4基因敲除后的小鼠表现出食欲亢进,白色脂肪减少、基础代谢率增加,同时对高脂诱导的肥胖明显抵抗,证实LGR4参与脂肪活性调节与脂肪转化过程,对能量代谢及肥胖发生起到重要作用[5-6]。本文综述LGR4基因与脂肪转化、能量代谢方面的最新研究成果的研究进展,分析其在脂肪活性水平的调节、转化以及能量代谢等方面的作用,探讨运动与LGR4基因在脂肪转化、能量代谢方面可能存在的关联性机制。
1 人体脂肪形式、调节与转化现象
1.1 机体组织中脂肪形式及生理特征
近期研究表明,人体脂肪组织有多种形式,包括白色脂肪组织(White adipose tissue,WAT)、棕色脂肪组织(Brown adipose tissue,BAT)、米色脂肪细胞(Beige cell)等,三者在生物学特征方面表现不同[7-9](见表1)。WAT的作用是将体内过剩的能量以TG的形式储存,同时作为分泌细胞可分泌多种因子用于能量代谢的调节过程;BAT内部含有丰富的线粒体,研究显示,BAT主要是通过线粒体内膜表面丰富的解偶联蛋白1(UCP1)加强线粒体氧化磷酸化过程解偶联并促进游离脂肪酸的代谢,以此消耗体内的过剩能量,是一类以能量消耗为特征的脂肪细胞。研究也表明BAT活性与体质指数、空腹状态下的血糖水平、年龄等因素存在关联,结果显示BAT的含量与身体健康呈现出正相关;Beige cell散布在白色脂肪组织,UCP1呈现阳性,表现出类似于棕色脂肪细胞样表型,同BAT一样有细胞中有大量线粒体,具有高效燃烧能量的作用[10]。有研究认为,BAT和米色脂肪细胞是潜在干预肥胖的靶细胞[11],对其深入研究具有重要的临床意义。目前,在成年人身上的棕色脂肪与米色脂肪的含量非常少,大多数是具备储存能量的白色脂肪细胞,三者虽然同属脂肪组织,但起源不相同,一定条件下可发生相互转化。
1.2 脂肪组织间的转化过程
WAT、BAT和Beige cell三者细胞的前体细胞并不相同,但在一定条件下三者之间有复杂的转化过程(见图1):(1)Beige cell虽然散布在WAT细胞当中但是二者的前体细胞却并不相同,有研究表明,一方面在缺乏诱导产热基因表达刺激的情况下,Beige cell的前体细胞可分化为单室的WAT细胞,但在β肾上腺素能激动剂刺激的情况下,Beige cell前体细胞则可分化为多室、富含线粒体的米色脂肪[12];(2)BAT与Beige cell虽然在生理特性上具有很多相似之处,但二者却有着不同的起源,来源于表达Myf5细胞系的棕色脂肪细胞是经典棕色脂肪细胞,研究发现,PRDM16(PR域16蛋白)在BAT中的表达有较为明显的增加,UCP-1等棕色脂肪特异性基因可被其诱导表达[13]。因此,PRDM16作为棕色脂肪的标志基因,对于控制BAT细胞及Beige cell定向分化过程起到关键作用,研究认为,PRDM16通过与其他转录因子如Ppar-γ、c/EBPβ等共同作用发挥定向分化的能力,促进BAT及Beige cell的产生,并同时抑制WAT的形成,而小鼠敲除PRDM16基因后棕色脂肪细胞分化为肌细胞,而转染PRDM16基因后,骨骼肌细胞又会分化成为Beige cell,表明二者有着共同的起源,而且PRDM16基因是调控分化的“分子开关”;San⁃chez-Gurmaches等[14]研究认为Beige cell是来源于不表达Myf5的细胞系,说明二者有着不同的起源。有研究发现[15],有氧运动和抗阻运动在白色脂肪棕色化转化过程中有较好的表现,但具体的转化过程和机制尚不明确。

表1 三种脂肪细胞生物学特性比较
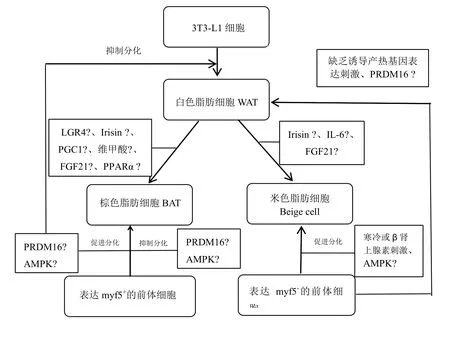
图1 脂肪细泡的分化、转化及主要相关影响因素
2 LGR4基因生物特征与调节功能
糖蛋白激素受体LGR4作为G蛋白偶联受体之一,广泛存在于人体内,不仅可以介导多种细胞外信号的细胞反应,而且还是一类最重要的细胞膜受体,介导多种信号分子的转导过程,对于多种器官的发生、发展起到至关重要的作用。LGR4的结构特点是具有7个跨膜结构的大分子蛋白和17个富含亮氨酸重复序列,在肾脏、肾上腺、骨骼等处均有表达,并参与了机体能量代谢平衡的调节,影响血压、血糖的调节。研究表明[16],LGR4与肥胖明显相关,LGR4基因敲除的小鼠模型,通过表型观察,虽然在高脂膳食下小鼠食物的摄入量、热量等数值显著高于正常小鼠,糖耐量改善,消耗增强,代谢水平提高,体重明显减轻,同时发现体内的WAT减少,转化为BAT,表明LGR4在BAT的活性功能调节、白色脂肪向棕色脂肪转化等过程中起到重要作用,也表明对体内脂肪堆积肥胖的发生和发展中起到重要作用,因此有研究者认为可以把LGR4基因作为分子靶点或药物作用靶点,用于筛选或制备促进白色脂肪棕色化、提高代谢水平的药物,通过对体内LGR4基因的敲除或抑制,把储存能量的白色脂肪细胞转换成具有消耗能量性质的棕色脂肪细胞。
3 运动在脂肪转化以及能量代谢中的调节作用
运动在体内的各种脂肪细胞的转化和能量代谢的调节涉及体质、肥胖及健康领域的诸多问题,成为研究热点。研究表明,运动能有效增加能量消耗[17-18],有助调节脂肪转化及能量代谢过程,是提高健康水平的最积极有效的方式,而运动促进健康效益是基于能量的消耗[19]。主要调节途径包括:(1)运动能有效改善机体内能量代谢[20]。运动时是通过增加肌肉做功,增加肌细胞耗氧、耗能而使能量代谢率升高。安静状态下,也能有效提高机体静息能量代谢水平,而研究者普遍认为静息能量代谢水平的提高常常是机体能量消耗过程的关键,对于健康具有积极意义。(2)运动能够有效提高骨骼肌代谢水平[21]。研究表明,运动促进骨骼肌肥大和生成现象,能有效提高基础代谢,而骨骼肌代谢内的雷帕霉素靶蛋白(mam-malian target of rapamycin,mTOR)是其重要代谢通路,通路中肝激酶B(liver kinase B,LKB)-腺苷酸活化蛋白激酶(adenosine monophosphate activated protein kinase,AMPK)-mTOR是一条重要信号途径,其中AMPK是细胞的能量感受器,而LKB在能量充足情况下可以直接磷酸活化AMPK,因此这一通路与细胞能量代谢密切相关。(3)运动在脂肪代谢调节中的作用。过氧化物酶体增殖物活化受体γ协同刺激因子1(PGC-1)是一类辅激活因子,大量研究表明[22],运动可上调PGC-1的表达以及提高其活性,进而促进线粒体生物合成增加、氧化磷酸化能力增强、毛细血管密度增加、氧化型肌纤维比例增多等多个方面来调控能量代谢。同时PGC-1与脂肪代谢有关,参与调控白色脂肪组织的棕色化分化过程及热生成,对于能量代谢有积极性作用[23]。
4 LGR4基因与运动在脂肪转化与能量代谢中相关性机制研究
4.1 LGR4基因在脂肪转化与能量代谢中的表现
肥胖具有典型的遗传特征,开展对于参与能量代谢的相关基因研究,并对其作用的可能性机制进行研究,对于肥胖症的预防治疗具有重要意义。刘瑞欣等[24]以LGR4基因敲除小鼠模型,观察正常饮食与高脂饲料诱导野生型(WT)与基因敲除(KO)小鼠的能量代谢相关指标,对BAT活性以及WAT的能量代谢相关基因的改变情况等进行了研究,发现在高脂饮食诱导条件下,LGR4基因敲除后的小鼠摄食量有明显增加,然而体重呈现偏轻,表明LGR4基因敲除小鼠对肥胖过程产生较为明显的抵抗;同时通过代谢笼试验证实LGR4基因敲除后的小鼠虽然活动度并未出现改变,但由于基础代谢率有了明显增加,体温偏高,同时观察到LGR4基因敲除后的小鼠体内BAT活性增强,细胞内线粒体数目明显增加,WAT明显减少,棕色脂肪特异性标志蛋白UCP1的表达在冷冻应激下增强,与能量代谢相关基因的表达出现上调等现象。因此,研究认为LGR4敲除后的小鼠BAT活性增强与WAT发生棕色化转化,是小鼠能量代谢率明显增加的主要原因,主要途径可能是通过LGR4影响PGC-lα基因的活性,并进而调节UCP1的表达,增加了机体WAT与BAT的能量代谢。敲除LGR4基因后小鼠的基础代谢率明显增加,能量消耗加大,导致体脂含量有效降低,而对于其他各项代谢指标包括血糖、血脂、血压等均有显著性改善,有效降低和改善体内能量代谢降低肥胖危害。
4.2 LGR4基因与运动在脂肪转化与能量代谢中相关性机制分析
LGR4基因的缺失或表达下调对白色脂肪向棕色脂肪、米色脂肪转化及能量代谢起到积极作用,LGR4表达的下调可致BAT活性增强与WAT发生棕色化改变是其代谢率增加的主要原因。LGR4基因与运动在脂肪转化与能量代谢中的可能性机制:①研究表明,LGR4基因的缺失或抑制将促进肝脏与脂肪组织PGC-1α、Akt基因表达水平明显增加,其磷酸化水平均有了明显提高,PGC-1α和下游调节基因表达上调,有效提高了机体中胰岛素敏感性,将有效提高外周组织对葡萄糖和脂质的利用。②有效激活骨骼肌及脂肪细胞内的AMPK活性。AMPK在调节脂肪转化及能量代谢信号转导机制中发挥关键作用,通过其及相关的信号通路调节细胞能量代谢及脂肪细胞分化,并通过抑制细胞内成脂分化的标志性基因PPARγ和C/EBPα的表达抑制白色脂肪前体细胞3T3-L1的增殖及分化,进而抑制WAT的形成;AMPK在BAT的分化过程中也发挥着重要作用,有效促进BAT的正常分化;米色脂肪细胞在AMPK作用下高表达UCP1,增强氧化呼吸率。③诱导PGC-1α基因表达,进而调节UCP1的表达,增加了机体BAT与WAT的能量代谢过程。研究表明,运动可通过钙调神经磷酸酶(calcineurin)、p38丝裂原活化蛋白激酶(p38MAPK)、AMPK、儿茶酚胺、心钠肽等上调PGC-1的表达,进而引起线粒体生物合成增加、氧化磷酸化能力增强、毛细血管密度增加、氧化型肌纤维比例增多、白色脂肪棕色化等多个方面来调控能量代谢。④促进PGC-1α基因下游分子Ⅲ型纤连蛋白结构域5(fibronectin type III domain con⁃taining protein 5,FNDC5)的裂解,随后在体内FNDC5被剪切转变为鸢尾素(Irisin),而Irisin专门靶向作用于米色细胞,其可以将白色脂肪转换成米色脂肪细胞,棕色脂肪细胞的特征亦被驱动。⑥降低肌肉生长抑制素(myostatin,MSTN)活性,通过激活AMPK-PGC1-FNDC5途径诱导白色脂肪组织的棕色化,MSTN基因敲除的小鼠表现出骨骼肌肥大、脂肪量降低,在WAT表现出BAT的特征,增加了BAT特征基因,包括UCP1、PGC-1、米色脂肪细胞(beige)的标记基因Tmem26和CD137,骨骼肌内MSTN基因敲除导致AMPK表达和磷酸化增加,进而激活PGC-1和FNDC5。⑦研究[26]认为,LGR4通过PKA信号通路调节Rb基因的表达并参与Beige/Browning过程。
5 小结与展望
LGR4基因对于脂肪转化与能量代谢影响的相关性机制目前尚无完整、全面的解释,但大量的研究已经把抑制或敲除LGR4基因作为预防肥胖的靶点,相信通过对LGR4基因表达的干预将对三种脂肪细胞的转化起到关键影响,进而增强机体的能量代谢过程,为临床肥胖及能量代谢障碍的干预治疗提供思路。
