肉制品中3 类有害物质的来源与控制方法研究进展
2020-06-04江黎雯薛超轶何志勇王召君秦昉陈洁徐正华曾茂茂
江黎雯 薛超轶 何志勇 王召君 秦昉 陈洁 徐正华 曾茂茂

摘 要:肉制品中含有丰富的蛋白质、脂肪及糖类等物质,这些营养物质在特定加工条件下可发生相互作用,形成有害化合物,如烟熏过程中易于生成的多环芳烃、高温烹饪条件下易于生成的杂环胺以及添加亚硝酸盐作防腐剂时易于生成的N-亚硝基化合物等。本文综述以上3 类物质的危害性、形成途径、限量标准及相关控制方法的研究进展,以期为健康肉制品的开发提供理论参考。
关键词:肉制品加工;多环芳烃;杂环胺;N-亚硝基化合物;控制方法
A Review of Three Kinds of Hazardous Substances in Meat Products: Sources and Control Methods
JIANG Liwen1, XUE Chaoyi1, HE Zhiyong1, WANG Zhaojun1, QIN Fang1, CHEN Jie1, XU Zhenghua2, ZENG Maomao1,*
(1. State Key Laboratory of Food Science and Technology, Jiangnan University, Wuxi 214122, China;
2. Huangpu Customs, Guangzhou 510770, China)
Abstract: Meat products are rich in protein, lipids, saccharides, etc., and the interactions among these ingredients could occur to form hazardous compounds under certain processing conditions, such as polycyclic aromatic hydrocarbons (PAHs) during smoking, heterocyclic amines (HAs) during high-temperature cooking, and N-nitroso compounds (NOCs) in products with nitrite as a preservative. This paper summarizes the basic properties, formation pathways and the maximum allowable limits of PAHs, HAs and NOCs in meat products and currently available methods to control these hazardous substances, so as to provide a theoretical basis for the development of healthful meat products.
Keywords: meat processing; polycyclic aromatic hydrocarbons; heterocyclic aromatic amines; N-nitroso compounds; control methods
DOI:10.7506/rlyj1001-8123-20200131-028
中圖分类号:TS251.5 文献标志码:A 文章编号:1001-8123(2020)04-0077-11
引文格式:
江黎雯, 薛超轶, 何志勇, 等. 肉制品中3 类有害物质的来源与控制方法研究进展[J]. 肉类研究, 2020, 34(4): 77-87. DOI:10.7506/rlyj1001-8123-20200131-028. http://www.rlyj.net.cn
JIANG Liwen, XUE Chaoyi, HE Zhiyong, et al. A review of three kinds of hazardous substances in meat products: sources and control methods[J]. Meat Research, 2020, 34(4): 77-87. DOI:10.7506/rlyj1001-8123-20200131-028. http://www.rlyj.net.cn
大多数肉制品是禽、畜肉类经过腌制、高温烹饪、烧烤、熏制及发酵等处理,以增强风味、便于贮藏等为目的发展起来的加工食品[1]。肉制品富含营养物质,包括优质蛋白质、矿物质(特别是铁和锌)、维生素(尤其是B族维生素)等,是人们日常平衡膳食的重要组成部分[2]。与此同时,由于肉制品中富含蛋白质和脂肪等成分,其在加工和贮运阶段会发生脂肪氧化和美拉德反应等,从而产生对人体健康有潜在风险的危害物[3]。世界卫生组织国际癌症研究机构(International Agency for Research on Cancer,IARC)发布的最新报告中将加工肉制品归为Ⅰ类致癌物和2A类致癌物,其中最突出的危害物为多环芳烃(polycyclic aromatic hydrocarbons,PAHs)类、杂环胺(heterocyclic amines,HAs)类、N-亚硝基化合物(N-nitroso compounds,NOCs)类、晚期糖基化末端终产物(advanced glycation end products,AGEs)等[4-5],有研究表明,这些危害物会对人体健康产生急性或慢性危害,如引起DNA损伤、引发肠道和胰腺等组织癌变等[6-8]。
我国是世界肉类生产和消费第一大国,肉制品安全性问题受到越来越广泛的关注。肉制品加工过程中的温度、时间、脂肪含量及烹饪方式等都会影响危害物的产生[9],目前对肉制品危害物的控制方法主要包括控制加工条件、添加外源抑制物、微波辐照处理等技术[10]。研究并依据危害物的具体生成途径、针对性地对配方和加工条件进行优化以控制肉制品加工过程中的危害物生成已经成为肉品科学领域的研究热点。本文分类介绍肉制品中PAHs、HAs和NOCs的基本性质、形成途径、限量标准以及相关控制方法,旨在为健康肉制品的加工提供理论参考。
1 PAHs类物质
1.1 PAHs的食品安全危害性
PAHs是包含2 个或2 个以上苯环且不含杂原子及其取代基的挥发性芳香族烷烃化合物,通常由煤、烟草、木炭等中的有机物不完全燃烧产生,是一类具有强致癌性且分布广泛的环境和食品污染物[11-12]。PAHs类物质是包括10 000余种化合物的大家族,根据常见的分子组成将其分为低于5 个苯环的轻环(LPAHs),如萘、菲等,以及大于等于5 个苯环的重环(HPAHs),如苯并(a)芘、二苯并(a,h)蒽等。常见的致癌性PAHs多含有4~6 个苯环,其中苯并(a)芘的致癌性是所有PAHs中最強的,同时也是食品中PAHs产生的主要标志[13]。PAHs可以与体内多种酶相互作用,产生与核酸和蛋白质共价结合的代谢产物PAHs二氢二醇衍生物,影响细胞的分裂与表达,进而诱发癌症[14]。研究表明,短期摄入PAHs会引起恶心、呕吐以及眼睛和皮肤的刺激,而长期摄入PAHs可能诱发皮肤、肺、膀胱等器官的肿瘤[11,15]。
1.2 肉制品加工中PAHs的形成途径
肉制品中的PAHs是通过有机物热解,如脂肪与火焰直接接触或木炭的不完全燃烧而形成,高温烹饪(烘烤、烧烤和油炸)和特定工艺(干燥和烟熏)均会促进其产生[16]。Chen等[17]在探究PAHs生成机理时发现,苯基自由基和不饱和烷基苯是PAHs生成的关键性中间体。Fasano等[18]发现,蛋白质、脂肪和碳水化合物在高于200 ℃热解过程中通过小分子的碎片化以及产生的自由基重组形成稳定的多环芳香族化合物。这些化合物积聚在烟熏肉制品表面,随后迁移至其内层中。Luzardo等[19]发现,肉制品在高温下燃烧时产生的自由基首先重组形成LPAHs,之后形成的HPAHs最终会转移至食物的疏水性区域,最终保留在富含脂肪的食物中。
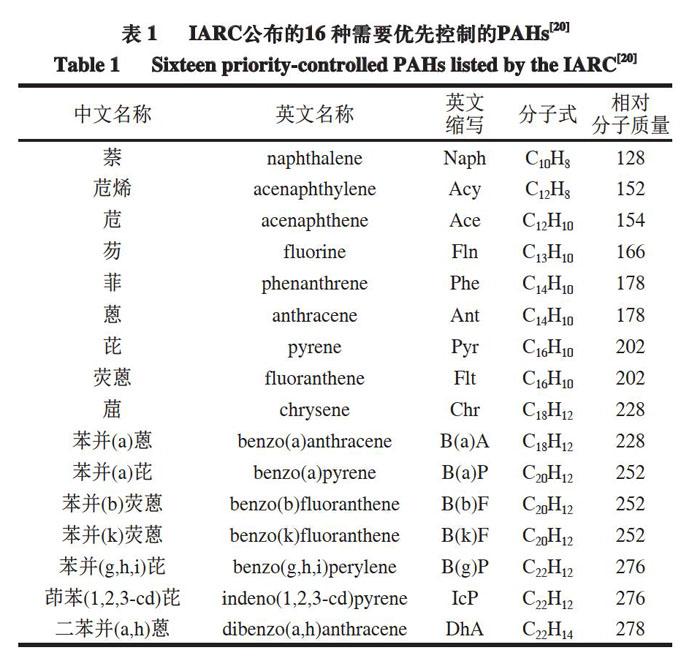
1.3 肉制品中PAHs的限量标准
IARC将16 种PAHs(表1)列为食品中需要优先控制的化学危害物[20],这16 种PAHs均为稠环芳烃,其中12 种属于LPAHs,4 种属于HPAHs。2008年欧盟食品安全局(European Food Safety Authority,EFSA)提出PAH4的概念,即测定16 种PAHs中的4 种(B(a)P、Chr、B(a)A和B(b)F)的含量,后又提出PAH8(PAH4、B(k)F、IcP、DhA和B(g)P)的标准,认为PAH4和PAH8是判定肉制品中PAHs含量最合适的指标;2011年,EFSA规定烟熏肉和烟熏肉制品中B(a)P含量不能超过2 μg/kg,PAH4总含量不能超过12 μg/kg[21]。我国GB 2762—2017《食品安全国家标准 食品中污染物限量》规定,烟熏肉和烧烤肉制品中B(a)P含量不能超过5 μg/kg。
1.4 肉制品中PAHs的控制方法
1.4.1 控制加工温度和时间
肉制品加工过程中脂肪酸裂解环化并聚合形成PAHs时需要较高能量,所以温度是PAHs形成的重要条件。研究表明,加工温度和时间可协同影响肉制品中PAHs的生成[22]:一定加工时间范围内,PAHs的生成量随着加工温度的增加而增加;而在相同加工温度条件下,延长加工时间也会导致PAHs生成量的显著增加,高温短时及低温长时的烟熏及油炸烹饪均会产生PAHs。Kao等[23]发现,在77 ℃条件下烤制时间小于6 min时,可以有效防止炭烤肉排中B(a)P形成,安全性最佳。此外,姜三群[24]研究烤制时间与羊肉串中有害物质变化规律时发现,500 ℃无烟炭烤0~7 min的羊肉串中B(a)P含量增加较慢,烤制7~9 min羊肉串中B(a)P含量显著增加,烤制结束时羊肉串中B(a)P含量一般会超过GB 2762—2017规定的5 μg/kg。Kuhn等[25]的研究结果同样证实,在采用传统加工工艺的熏肠中,低温烟熏6 h不会导致高水平的PAHs污染,而加热和更长的熏制时间会使最终样品中PAHs水平显著增加。因此,控制加工温度及时间能够有效减少肉制品中PAHs的含量。
1.4.2 控制热源距离及强度
肉制品加工时应与热源维持适当的距离,采用较短的加工时间,可保持肉品良好的感官品质和最佳状态。Rose等[26]研究发现,西式熏香肠在与燃料相距9 cm熏烤时,PAH4总量为0.18~0.23 ?g/kg,远低于距离为4 cm和7 cm时的PAH4总量(1.33~47.14 μg/kg),故适当增加肉制品与热源的距离能够有效降低肉制品中PAHs的含量。此外,Kendirci等[27]研究发现,热源的强度也会影响PAHs水平,红外烹饪牛肉丸时,在热通量、持续时间、应用距离分别为8.475 kW/m2、4 min、10.5 cm条件下牛肉丸中的Chr和Pyr含量最低,并且在相同的时间和距离下,可以通过将热通量降低到3.706 kW/m2使得产品中B(a)P的产生量控制在最低水平。
1.4.3 控制原料油脂含量及烹饪油质量
早期研究已经提出,由于脂肪的热解发生在肉制品的高温加工过程中,所以PAHs的水平与肉制品中的脂肪含量及脂肪的热解程度密切相关[28]。Gorji等[29]研究烧烤鸡肉前处理方式对PAHs含量的影响时发现,烧烤前将鸡肉去皮能够显著降低烤制鸡翅和鸡腿中PAHs的含量,并推测造成这一现象的原因可能是鸡皮中含有较高含量的脂肪,一方面根据肉制品中PAHs的可能生成机理可知,脂质中脂肪酸类物质在一定温度下可以环化生成PAHs;另一方面,脂肪酸可以和高度脂溶性的PAHs类物质混溶,从而易形成PAHs富集体。Lee等[30]研究发现,与传统烧烤方法相比,通过去除油滴的方式,烧烤猪肉和牛肉中的PAH4总含量减少48%~89%。因此,在保持肉制品良好风味的前提下,尽量减少原料中脂肪含量是控制PAHs污染的重要手段。此外,油炸肉制品中的PAHs与煎炸油的类型及反复油炸的次数密切相关[31],需要加强监控以避免长时间煎炸和重复使用相同的煎炸油,最大程度地减少风险暴露。
2.3 肉制品中HAs的限量标准
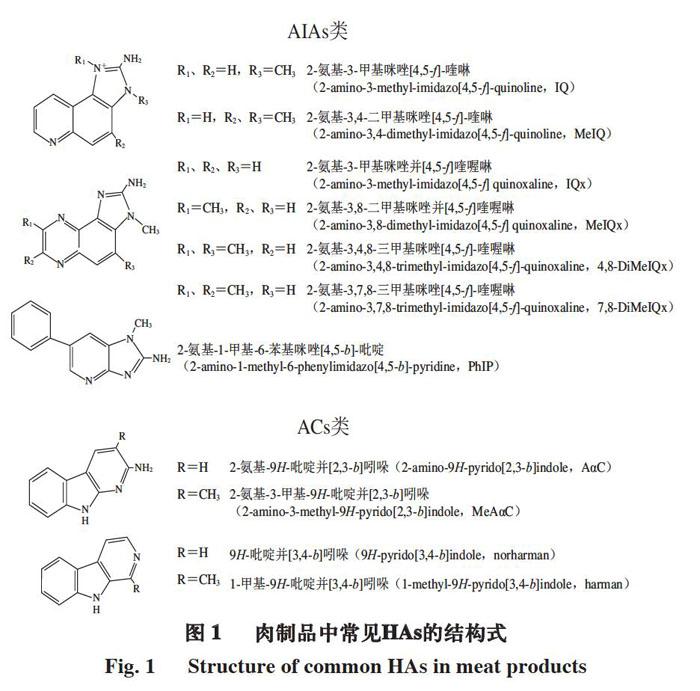
虽然大量流行病学研究结果表明,长期摄入HAs会使人体增加罹患癌症的风险,但由于饮食中HAs种类的复杂性以及各种HAs的危害程度不同,很难证实患癌与HAs的摄入剂量之间具有直接关系,因此至今并未出台明确的HAs限量标准。肉制品中HAs含量根据肉的种类、烹饪方式、加工条件的不同有很大差异,但总体上处于ng/g级别。IRAC于1993年将9 种HAs列为致癌物,其中MeIQ、PhIP、AαC、MeAαC、MeIQx、
3-氨基-1,4-二甲基-5H-吡啶[4,3-b]吲哚(3-amino-1,4-dimethyl-5H-pyrido[4,3-b]indole,Trp-P-1)、3-氨基-1-甲基-5H-吡啶[4,3-b]吲哚(3-amino-1-methyl-5H-pyrido[4,3-b]indole,Trp-P-2)及2-氨基-6-甲基二吡啶并[1,2-a:3,2-d]咪唑(2-amino-6-methyldipyrido-[1,2-a:3,2-d]imidazole,Glu-P-1)定义为潜在致癌物(2B级),IQ定义为可能致癌物(2A级)[53]。2011年,美国国家毒理学计划也认为IQ、MeIQ及PhIP等HAs是极大可预期致癌因素[54]。
2.4 肉制品中HAs的控制方法
2.4.1 控制加工温度和时间
多项研究表明,温度和时间是影响肉制品中HAs产生以及食品感官属性的关键性因素。温度是HAs形成的最重要因素之一。Gibis等[55]研究不同加工温度下培根中HAs含量,当煎炸温度由150~170 ℃升高至200~220 ℃时,培根中MeIQx和PhIP含量增加约0.5~2.5 倍,但是能获得脆度和颜色更佳的感官属性。Bu?a等[56]发现,烤架温度从180 ℃提高到220 ℃时,烧烤猪肉中4,8-DiMeIQx含量增加2 倍,7,8-DiMeIQx含量增加9 倍,猪肉嫩度和多汁性也随之下降。因此,为尽可能减少肉制品中的HAs,热处理加工温度最好不超过180 ℃。
当肉制品热处理时间较长时,也可观察到较高的HAs水平。Dong等[57]发现,230 ℃煎炸16 min牛肉馅饼中Norharman和Harman的含量分别约为煎炸4 min样品的18 倍和12 倍。而Manabe[58]、Arvidsson[59]等的研究均发现,低温长时间处理的模拟体系中会出现一定量的HAs。但是值得注意的是,在湿热体系中一些杂环胺(如PhIP和7,8-DiMeIQx)会随着加工温度的升高和加工时间的延长在反应后期发生分解[60]。因此,在大多数情况下,应考虑热处理温度和时间的组合来估算和分析HAs的形成。
2.4.2 控制加工过程中的水分和油脂
由于水是前体物质迁移的关键介质,因此保持肉制品中水分含量有助于减少HAs的形成。Skog等[61]分别在加水和干燥条件下处理不同浓缩比例的肉汁,发现水分含量影响所生成的HAs种类,干燥的加热环境更有利于PhIP的形成,而有水体系中通常会形成更多的IQ和MeIQx。杨调调[62]也发现,生香肠经过干燥、烘烤和蒸煮阶段后HAs含量逐步增加,而干燥阶段新生成的HAs最多。
脂肪作为肉制品中的主要营养成分之一,在HAs的生成中起着至关重要的作用。很多研究证实高脂肪肉类会产生更多的HAs,可能原因一是由于脂肪传热能力强,含有较高脂肪含量的肉类更容易在物理上达到产生HAs的热温度;二是脂肪氧化过程中会产生大量自由基,促进HAs自由基的形成途径。Knize等[63]报道了不同脂肪含量(8%、15%和30%)对碎牛肉中HAs形成的影响,发现脂肪含量为30%的炸碎牛肉提取物含有最多的HAs,且具有最强的致突变性。Zamora等[64]证明,氧化的油脂及其氧化产生的化合物均具有促进PhIP形成的作用。此外,HAs的形成与脂肪含量的关系与HAs的极性有关,极性HAs更易随着脂肪含量的增加而增加[65]。
2.4.3 添加外源抑制剂
很多外源抑制剂,如维生素、香辛料、植物提取物对HAs均具有良好的抑制效果,这些物质抗氧化活性强,可以抑制自由基生成,同时捕获醛类中间体并形成加合物,进而阻断各HAs的形成[43]。维生素作为常见的抗氧化剂,添加至肉制品中以抑制各HAs的研究早有报道。Tai等[66]发现,多种水溶性维生素均可明显抑制HAs的产生,其中高剂量VC的添加能抑制除Harman以外的多种HAs形成。Liao Guozhou等[67]发现,在炒制肉松过程中加入0.1% VE可以显著降低Norharman、PhIP、AαC及MeAαC的含量。除了天然抗氧化剂,使用合成抗氧化剂,如丁基羟基茴香醚也可以减少HAs的形成[68]。
香辛料(洋葱、辣椒、黑胡椒、大蒜及生姜等)作为最常用的肉类调味品,除了富含抗氧化物质,其所含有的萜类化合物和有机硫化物也可通过阻断美拉德反应减少HAs的生成。李进[69]研究八角、青花椒、红花椒、桂皮、陈皮、黑胡椒、香叶、姜8 种香辛料对卤肉中β-咔啉类HAs的抑制效果,发现香辛料的抑制能力与羟自由基清除能力相关,其中干姜、青花椒和桂皮抑制作用最明显,5%添加量下,对Norharman和Harman的抑制率达40%以上;同时,研究也发现不同组合的香辛料复配使用具有协同增效的作用。Sepahpour等[70]发现,當腌制料中姜黄与柠檬草添加量分别为52.4%、47.6%时,烤牛肉中Norharman和Harman含量分别从45.6、87.4 ng/g降低至0.5、2.8 ng/g。
近年来,越来越多的植物提取物被用于抑制HAs的生成,如菊花、绿茶、葡萄籽提取物及二氢杨梅素等均可以不同程度地抑制HAs生成,主要是由于这些天然提取物中富含多酚、黄酮及儿茶素等活性成分。Rounds等[71]
研究发现,添加橄榄、苹果皮和丁香提取物可降低PhIP和MeIQx的形成量,抑制率均超过50%。Weisburger等[72]
发现,绿茶中的茶多酚、多元酚60?,黑茶中的多元酚B?能显著抑制肉排汉堡诱变剂的形成,降低致突变性,且存在剂量依赖关系。赵磊等[73]研究果蔬中常见的15 种黄酮类化合物对烤鸡胸肉中5 种HAs(Norharman、Harman、PhIP、MeIQx和4,8-DiMeIQx)的影响,发现没食子儿茶素沒食子酸酯、柚皮素、木犀草素和染料木素的抑制效果最为显著,对PhIP、MeIQx和4,8-DiMeIQx的抑制率可达40%以上。因此,天然植物提取物作为一种健康、安全的HAs抑制剂具有广泛的应用前景。
此外,也有研究表明,在肉制品加工过程中添加盐、多糖及大豆蛋白等持水性物质可以阻碍HAs前体的迁移和相互作用,从而减少HAs的形成量。Persson等[74]在牛肉汉堡中添加氯化钠和三聚磷酸钠,减少了烹制过程中水分的蒸煮损失,MeIQx和4,8-DiMeIQx含量均显著降低。马铃薯淀粉、马铃薯膳食纤维、微晶纤维素及羧甲基纤维素等多糖类物质均被证明具有减少熟肉制品中HAs的能力。Wang等[75]研究发现,加入一定量的大豆浓缩蛋白可以降低煎炸牛肉中HAs的诱变活性,同时还发现加入大豆浓缩蛋白汉堡中的HAs与普通煎炸牛肉汉堡中的HAs相比具有更低的诱变活性。
2.4.4 微波处理
热处理前进行微波预处理是一种高效的降低肉制品中HAs的方法。肉制品经过微波处理后,含有小分子HAs前体物的原料肉汁液浸出,由于这些前体物质不进入肉类表面,且不能作为HAs形成的反应物,故HAs的生成量随之减少[76]。Felton等[77]研究表明,将牛肉饼微波所产生的液体在油炸前倒掉,可降低油炸牛肉饼中肌酸(肌酸酐)、葡萄糖及各种氨基酸等HAs前体物质的含量,HAs的生成量降低为正常生成量的14%,并且致突变活性远低于未经微波预处理的肉饼。陈妍方[78]也发现,微波场下咖啡酸对PhIP的抑制率始终高于传导加热,这是由于微波促进了咖啡酸在体系中的溶解,使其吸收更多能量,使得PhIP的抑制率始终保持较高水平。
3 NOCs
3.1 NOCs的食品安全危害性
NOCs是指含有-N-NO官能团,且在其第2位N上有2 个取代基团(烷基、芳基或酰胺基)的有机化合物,常来源于食物中天然或人为添加的硝酸盐和亚硝酸盐的转化,是一种广泛存在于动植物体内及体外的致癌、致畸、致突变危害物[79]。根据取代基的不同,NOCs分为N-亚硝胺(只含烷基或芳基)和N-亚硝酰胺(含酰胺基),N-亚硝胺进一步被分为挥发性亚硝胺(volatile nitrosamines,VNA)和非挥发性亚硝胺(non-volatile nitrosamines,NVNA)。加工肉制品中最常见的NOCs有N-亚硝基二甲胺(N-nitrosodimethylamine,NDMA)、N-亚硝基二乙胺(N-nitrosodiethylamine,NDEA)、N-亚硝基哌啶(N-nitrosopiperidine,NPIP)、N-亚硝基吡咯烷(N-nitrosopyrrolidine,NPYR)和N-亚硝基吗啉(N-nitrosomorpholine,NMOR)(图2)[80]。体内生成的NOCs在某些酶的激活下发生氧化脱氨和重氮烷等作用,直接或间接使DNA烷基化,影响DNA、RNA的转录与复制,引发癌症和畸变[81]。同时,NOCs具有亲和器官性,不同结构的NOCs可以定向诱导特定器官产生肿瘤。NDMA和NDEA能诱导哺乳动物的鼻腔、肝脏和肾脏产生肿瘤,而NMOR能诱导哺乳动物发生卵巢癌和结肠癌[82]。此外,有研究证明,NDMA和NDEA等含有短脂肪链的VNA致癌作用更强,是NOCs中具有致癌活性的主要物质[79]。
3.2 肉制品加工中NOCs的形成途径
肉制品中NOCs的形成与肉类成分、反应条件(pH值和温度)及加工工艺(腌制、成熟、发酵、熏制、热处理和贮存)密切相关。肉制品中NOCs产生的主要途径是食物中的亚硝酸盐在酸性条件下先形成亚硝酸,再转化为氮氧化物(N2O3),然后与原料肉本身所含的生物胺、肉类加工中蛋白质和脂肪氧化分解或高温降解产生的仲胺反应生成[83]。此外,烤制和熏制肉类所产生的烟雾中含有的大量气态氮氧化物也可能会转化为NOCs[84]。很多学者在模拟系统中探究NOCs形成的前体,发现NDMA可以由甘氨酸、肌酸、胆碱、卵磷脂和甜菜碱等几种前体化合物形成[85],NDEA是丙氨酸发生亚硝基反应所产生[83],而N-亚硝基脯氨酸、腐胺和亚精胺等物质是NPYR形成的前体[86]。另外,有研究表明,香料(黑胡椒、辣椒粉)和亚硝酸盐混合后会产生NPIP和NPYR,这是由于这些香料中存在胡椒碱、吡咯烷、哌啶等NPIP前体[87]。
3.3 肉制品中NOCs的限量标准
肉制品中形成的NOCs一般是痕量的,为0.1~10.0 μg/kg级别[88]。1978年IARC确证NOCs为有强致癌性的食物污染物,并将其中具有潜在致癌性的NDMA和NDEA列为2A类致癌物,其他NOCs列为2B级致癌物[89]。
2005年美国农业部规定,食品中VNA总量必须小于10 μg/kg[90],我国GB 2762—2017规定肉制品,包括熟肉干制品(肉类罐头除外)中NDMA含量不超过3 μg/kg。
3.4 肉制品中NOCs的控制方法
3.4.1 控制添加剂的种类和添加量
在肉制品加工中,食盐、硝酸盐、亚硝酸盐、多聚磷酸盐及蔗糖等常用添加物对NOCs的形成有潜在影响。其中,硝酸盐和亚硝酸盐作为最常用的肉制品添加剂具有护色、抑菌、抗氧化及形成特殊风味多重作用,但同时也是NOCs形成的最重要前体物质。许多研究表明,肉制品中NOCs的水平与硝酸盐和亚硝酸盐的添加量呈正相关[91],目前越来越多研究希望生产出亚硝酸盐的可替代物。Sebranek等[92]在原料肉中添加发酵芹菜粉作为腌制剂,与直接添加亚硝酸盐的对照组相比,所得到的肉制品颜色、风味和脂肪氧化等品质均无显著差异。
Li Peijun等[93]以生猪肉糊等为原料进行发酵,制备的亚硝酰基肌红蛋白和亚硝基生色团具有良好的稳定性和极佳的赋色效果,可作为一种新型的安全发色剂代替亚硝酸盐使用。此外,在肉制品中添加山梨酸钾、复合磷酸盐等其他食品添加剂会与亚硝酸盐发生相互作用,产生更多有致癌作用的不良产物,如2-甲基-1,4-二硝基吡咯和硝酸乙酯[94]。因此,在肉制品腌制中,尽可能减少亚硝酸盐使用量是控制NOCs水平最关键的工艺因素之一。
3.4.2 控制溫度和pH值
高温和低pH值环境有利于NOCs的生成,因此控制加工过程中的温度和pH值对减少NOCs的生成至关重要。提高加工温度可以增加体系中NOCs前体的含量,并促进亚硝基化反应的转化,因而肉制品中NOCs的水平随着加工温度的升高而增加。Rywotycki[95]发现,相比于蒸煮,温度更高的烘焙方式会导致肉制品中NDMA和NDEA污染水平有所增加,且烘焙温度越高,NOCs含量增长越快。Li Ling等[96]研究不同热处理方式对干腌肉中总NOCs含量的影响,结果表明,油炸或煎炸腌制香肠比微波加热腌制香肠含有更多的NDMA、NDEA和NPYR,这主要是由于微波加热温度较低,亚硝酸盐残留量低。
除了高温会增加NOCs的水平,pH值是影响亚硝基化反应的另一个重要因素。通常条件下,亚硝酸盐不能直接与次胺作用形成致癌物,而是在pH值为2~4时转化为氮氧化物后进行反应。马俪珍等[97]研究反应条件对羊肉中NOCs生成的影响,结果表明,由于H+与亚硝酸钠和仲胺均能发生作用,因此pH值过低或过高时NDMA的生成量均较低,当pH值为3.0左右时NDMA生成量最高,pH值大于5.0时NDMA生成量显著降低。因此,发酵肉制品的加工条件应该远离pH值为2~4的酸性环境,以减少NOCs的生成。
3.4.3 控制微生物
许多研究表明,微生物也参与NOCs的形成。青霉菌属及根霉菌属在NOCs的合成反应中具有生物催化作用,硝酸盐还原菌能使人体摄入的硝酸盐转化为亚硝酸盐,从而促进NOCs的合成[98]。某些特定的细菌(如肠杆菌属和厌氧芽孢杆菌属细菌)还能促使蛋白质降解为二级胺,产生一种促进亚硝基化反应的酶,并形成稳定反应的酸性环境[99]。因此,必须在加工过程中严格控制原料的新鲜度,保持肉制品加工贮运过程中的环境卫生,从而控制微生物数量,以减少NOCs生成。
3.4.4 添加外源抑制剂
抗氧化剂在体内外对NOCs的合成具有良好的阻断作用,如维生素、咖啡因、谷胱甘肽和各种氨基酸(甘氨酸、组氨酸、半胱氨酸等)等食品抗氧化剂均被广泛应用。抗氧化剂作为亚硝酸盐清除剂的机理是将亚硝酸盐质子化产生的亚硝酸(HNO2)还原为无害的N2和NO,或者清除亚硝基阳离子(NO+)来阻断NOCs的
生成[100]。此外,抗氧化剂还可以通过防止脂质及蛋白质的初始氧化反应来抑制NDMA和NDEA的形成。其中,抗坏血酸盐和异抗坏血酸盐在所有可阻断NOCs的物质中效果最好,当抗坏血酸盐浓度为亚硝酸盐2 倍时,无论是在机体内还是在食品中均可完全阻断NOCs的生成[95]。由于肉制品是以脂肪为主的体系,故VE等脂溶性抗氧化剂也被证实对NOCs有较好的消解能力[101]。
近几年来,有许多研究集中于使用天然植物提取液来抑制NOCs的合成。研究表明,桂皮、生姜、大蒜等富含硫化物的香辛料提取物对NOCs的阻断具有良好作用[102]。大蒜中含有的硫化物和苯二羧酸类物质能与亚硝酸盐结合生成硫代亚硝酸酯,从而阻断亚硝基化反应的发生。其他天然提取物,如茶叶[103]、葡萄籽[104]、羽衣甘蓝[105]等含有的黄酮、多酚类化合物具有多个酚羟基,在酸性条件下能电离出H+,与亚硝酸反应,消耗亚硝酸根,具有很强的抗氧化活性。这些天然化合物还可以通过提高机体内超氧化物歧化酶水平,增强清除自由基的作用,阻断NOCs在体内的合成。李晓雁等[103]研究表明,桂皮、洋葱和茶多酚3 种物质复配能够阻断猪肉发酵香肠中NOCs的生成。朱倩颖等[106]发现,在肉丸中添加0.04%~0.08%多香果可以明显降低NDMA、NPIP和NPYR含量,可能是由于多香果可抑制游离氨基酸向生物胺的转化,进而降低NOCs的生成量。Wang Yongli等[104]
发现,在干腌香肠和熏肉中添加茶多酚和葡萄籽多酚可以减少NOCs的含量,且抑制效果优于添加VE的对照组。Yang Hua等[107]研究发现,在添加亚硝酸盐的猪肉体系中加入儿茶素后,脂质氧化完全被抑制且蛋白质氧化有效降低,NDEA生成量大大减少。
3.4.5 辐照及生物降解
紫外辐照处理是降低肉制品中NOCs含量最有效可行的物理方法。紫外光产生具有强氧化能力的羟自由基,既可以分解前体物质生物胺和亚硝酸盐,还可以直接消解NOCs的亚硝基,同时能够减少微生物和降低脱羧酶活性[87]。Kodamatani等[108]发现,双氧水存在和紫外线照射1~2 h条件下所有NOCs均能被降解。Byun等[109]对意大利辣香肠和腊肠采用10 kGy的辐照剂量处理后在4 ℃条件下贮藏,结果表明,发酵肠中的NDMA和NPYP含量均显著降低。然而,高强度紫外光会导致肉制品色泽、风味等感官品质下降[110],故采用辐照处理时,辐照剂量控制为5~10 kGy较适宜。
近年来,利用微生物降解肉制品中的NOCs越来越受到研究者的关注。Kim等[111]发现,利用大肠杆菌和干酪乳杆菌模拟猪肉馅饼在大肠的体外消化时,NDEA的致突变性大大降低。同时,Kim[99]利用具有亚硝酸盐还原酶系统的乳杆菌进行发酵时,发现其对NDMA前体物质及NDMA均有抑制作用。肖亚庆[112]研究戊糖乳杆菌在整个发酵期间对香肠中NOCs的降解作用,结果表明,戊糖乳杆菌能有效降低体系中NDMA和NDEA的含量,与正常发酵20 d的对照组相比,2 种NOCs含量分别降低22%和23%以上。
4 结 语
在肉制品加工过程中,温和、简单的加工条件可以减少危害物的产生,严格控制温度、时间、水分、油脂、微生物等因素是肉制品加工中保证安全性的最重要措施。此外,添加外源性抑制剂(天然抗氧化物质、香辛料、保水剂等)、应用加工保藏技术(紫外、微波处理)等途径均可减少有害物质的生成,从而保证肉制品的安全性。随着研究的进一步深入,肉制品加工中的危害物将逐步得到有效控制,肉制品加工工艺正朝着更加绿色、安全的方向发展。
参考文献:
[1] 任晓镤, 朱玉霞, 鲍英杰, 等. 绿色制造技术在传统肉制品现代化加工中的应用及发展前景[J]. 肉类研究, 2017, 31(11): 60-64. DOI:10.7506/rlyj1001-8123-201711010.
[2] LAFARGA T, HAYES M. Bioactive peptides from meat muscle and by-products: generation, functionality and application as functional ingredients[J]. Meat Science, 2014, 98(2): 227-239. DOI:10.1016/j.meatsci.2014.05.036.
[3] DE SMET S, VOSSEN E. Meat: the balance between nutrition and health. A review[J]. Meat Science, 2016, 120(4): 145-156. DOI:10.1016/j.meatsci.2016.04.008.
[4] DIALLO A, DESCHASAUX M, LATINO-MARTEL P, et al. Red and processed meat intake and cancer risk: results from the prospective NutriNet-Santé cohort study[J]. International Journal of Cancer, 2017, 142(2): 230-237. DOI:10.1002/ijc.31046.
[5] WOLK A. Potential health hazards of eating red meat[J]. Journal of Internal Medicine, 2016, 281(2): 106-122. DOI:10.1111/joim.12543.
[6] DOMINGO J L, NADAL M. Carcinogenicity of consumption of red meat and processed meat: a review of scientific news since the IARC decision[J]. Food and Chemical Toxicology, 2017, 105(4): 256-261. DOI:10.1016/j.fct.2017.04.028.
[7] ALEXANDER D D, WEED D L, MILLER P E, et al. Red meat and colorectal cancer: a quantitative update on the state of the epidemiologic science[J]. Journal of the American College of Nutrition, 2015, 34(5): 1-23. DOI:10.1080/07315724.2014.992553.
[8] HUR S J, YOON Y, JO C, et al. Effect of dietary red meat on colorectal cancer risk: a review[J]. Comprehensive Reviews in Food Science and Food Safety, 2019(10): 1-13. DOI:10.1111/1541-4337.12501.
[9] MEURILLON M, RATEL J, ENGEL E. How to secure the meat chain against toxicants?[J]. Innovative Food Science and Emerging Technologies, 2018, 46(4): 74-82. DOI:10.1016/j.ifset.2017.10.004.
[10] 張苏苏, 苑冰冰, 赵子瑞, 等. 肉制品加工中有害物检测及控制技术研究进展[J]. 食品安全质量检测学报, 2017, 8(6): 1954-1960.
[11] KIM K, JAHAN S A, KABIR E, et al. A review of airborne polycyclic aromatic hydrocarbons (PAHs) and their human health effects[J]. Environment International, 2013, 60(10): 71-80. DOI:10.1016/j.envint.2013.07.019.
[12] PLAZA-BOLA?OS P, FRENICH A G, VIDAL J L M. Polycyclic aromatic hydrocarbons in food and beverages. Analytical methods and trends[J]. Journal of Chromatography A, 2010, 1217(41): 6303-6326. DOI:10.1016/j.chroma.2010.07.079.
[24] 姜三群. 羊肉串烤制中品質和有害物质变化规律及影响因素的研究[D]. 乌鲁木齐: 新疆农业大学, 2014: 22-27.
[25] KUHN K, NOWAK B, KLEIN G, et al. Determination of polycyclic aromatic hydrocarbons in smoked pork by effect-directed bioassay with confirmation by chemical analysis[J]. Journal of Food Protection, 2008, 71(5): 993-999. DOI:10.4315/0362-028X-71.5.993.
[26] ROSE M, HOLLAND J, DOWDING A, et al. Investigation into the formation of PAHs in foods prepared in the home to determine the effects of frying, grilling, barbecuing, toasting and roasting[J]. Food and Chemical Toxicology, 2015, 78(1): 1-9. DOI:10.1016/j.fct.2014.12.018.
[27] KENDIRCI P, ICIER F, KOR G, et al. Influence of infrared final cooking on polycyclic aromatic hydrocarbon formation in ohmically pre-cooked beef meatballs[J]. Meat Science, 2014, 97(2): 123-129. DOI:10.1016/j.meatsci.2014.01.020.
[28] FRETHEIM K. Polycyclic aromatic hydrocarbons in grilled meat products: a review[J]. Food Chemistry, 1983, 10(2): 129-139. DOI:10.1016/0308-8146(83)90029-8.
[29] GORJI M E, AHMADKHANIHA R, MOAZZEN M, et al. Polycyclic aromatic hydrocarbons in Iranian Kebabs[J]. Food Control, 2016, 60(2): 57-63. DOI:10.1016/j.foodcont.2015.07.022.
[30] LEE J, KIM S, MOON J, et al. Effects of grilling procedures on levels of polycyclic aromatic hydrocarbons in grilled meats[J]. Food Chemistry, 2016, 199(11): 632-638. DOI:10.1016/j.foodchem.2015.12.017.
[31] HAO Xuewei, LI Jing, YAO Zhiliang. Changes in PAHs levels in edible oils during deep-frying process[J]. Food Control, 2016, 66(2): 233-240. DOI:10.1016/j.foodcont.2016.02.012.
[32] 杨潇, 蔡克周, 胡斌, 等. 烟熏液对卤煮牛肉中12 种多环芳烃含量的影响[J]. 肉类研究, 2015, 29(7): 6-10. DOI:10.7506/rlyj1001-8123-201507002.
[33] ESSUMANG D K, DODOO D K, ADJEI J K. Effect of smoke generation sources and smoke curing duration on the levels of polycyclic aromatic hydrocarbon (PAH) in different suites of fish[J]. Food and Chemical Toxicology, 2013, 58(7): 86-94. DOI:10.1016/j.fct.2013.04.014.
[34] RAFFRAY G, SEBASTIAN P, COLLIGNAN A. Simulation model for the optimization of a radiant plate hot-smoking process[J]. Journal of Food Engineering, 2015, 147(2): 56-67. DOI:10.1016/j.jfoodeng.2014.09.025.
[35] FARHADIAN A, JINAP S, FARIDAH A, et al. Effects of marinating on the formation of polycyclic aromatic hydrocarbons (benzo[a]pyrene, benzo[b]fluoranthene and fluoranthene) in grilled beef meat[J]. Food Control, 2012, 28(2): 420-425. DOI:10.1016/j.foodcont.2012.04.034.
[36] 屠澤慧. 香辛料与照射处理对熏肠多环芳烃含量及品质的影响[D]. 合肥: 合肥工业大学, 2018: 19-22.
[37] JANOSZKA B. HPLC-fluorescence analysis of polycyclic aromatic hydrocarbons (PAHs) in pork meat and its gravy fried without additives and in the presence of onion and garlic[J]. Food Chemistry, 2011, 126(3): 1344-1353. DOI:10.1016/j.foodchem.2010.11.097.
[38] 陈炎, 杨潇, 屠泽慧, 等. 愈创木酚对卤煮牛肉中多环芳烃含量的影响[J]. 食品科学技术学报, 2017, 35(5): 32-40. DOI:10.3969/j.issn.2095-6002.2017.05.006.
[39] 聂文, 屠泽慧, 蔡克周. 葛根素和大蒜素对烟熏香肠中多环芳烃含量的影响[J]. 肉类工业, 2017(8): 37-41. DOI:10.3969/j.issn.1008-5467.2017.08.009.
[40] FARHADIAN A, JINAP S, HANIFAH H N, et al. Effects of meat preheating and wrapping on the levels of polycyclic aromatic hydrocarbons in charcoal-grilled meat[J]. Food Chemistry, 2011, 124(1): 141-146. DOI:10.1016/j.foodchem.2010.05.116.
[41] CHEN J, CHEN S. Removal of polycyclic aromatic hydrocarbons by low density polyethylene from liquid model and roasted meat[J]. Food Chemistry, 2005, 90(3): 461-469. DOI:10.1016/j.foodchem.2004.05.010.
[42] ALAEJOS M S, AFONSO A M. Factors that affect the content of heterocyclic aromatic amines in foods[J]. Comprehensive Reviews in Food Science and Food Safety, 2011, 10(2): 52-108. DOI:10.1111/j.1541-4337.2010.00141.x.
[43] CHEN Xiaoqian, JIA Wei, ZHU Li, et al. Recent advances in heterocyclic aromatic amines: an update on food safety and hazardous control from food processing to dietary intake[J]. Comprehensive Reviews in Food Science and Food Safety, 2020, 19(1): 124-148. DOI:10.1111/1541-4337.12511.
[44] ARVIDSSON P, BOEKEL M, SKOG K, et al. Kinetics of formation of polar heterocyclic amines in a meat model system[J]. Journal of Food Science, 1997, 62(5): 911-916. DOI:10.1111/j.1365-2621.1997.tb15005.x.
[45] FUCCELLI R, ROSIGNOLI P, SERVILI M, et al. Genotoxicity of heterocyclic amines (HCAs) on freshly isolated human peripheral blood mononuclear cells (PBMC) and prevention by phenolic extracts derived from olive, olive oil and olive leaves[J]. Food and Chemical Toxicology, 2018, 122(11): 234-241. DOI:10.1016/j.fct.2018.10.033.
[46] KAWAMORI T, TOTSUKA Y, UCHIYA N, et al. Carcinogenicity of aminophenylnorharman, a possible novel endogenous mutagen, formed from norharman and aniline, in F344 rats[J]. Carcinogenesis, 25(10): 1672-1967. DOI:10.1093/carcin/bgh189.
[47] GALLAHER D D, TRUDO S P. Chapter 36: nutrition and colon cancer[M]//COULSTON A M, BOUSHEY C J, FERRUZZI M G, et al. Nutrition in the prevention and treatment of disease. 4th ed. NewYork: Academic Press, 2017: 787-807. DOI:10.1016/B978-0-12-802928-2.00036-9.
[48] BARZEGAR F, KAMANKESH M, MOHAMMADI A. Heterocyclic aromatic amines in cooked food: a review on formation, health risk-toxicology and their analytical techniques[J]. Food Chemistry, 2019, 280(5): 240-254. DOI:10.1016/j.foodchem.2018.12.058.
[49] PEARSON A M, CHEN C, GRAY J I, et al. Mechanism(s) involved in meat mutagen formation and inhibition[J]. Free Radical Biology and Medicine, 1992, 13(2): 161-167. DOI:10.1016/0891-5849(92)90078-U.
[50] Z?CHLING S, MURKOVIC M. Formation of the heterocyclic aromatic amine PhIP: identification of precursors and intermediates[J]. Food Chemistry, 2002, 79(1): 125-134. DOI:10.1016/S0308-8146(02)00214-5.
[51] YOSHIDA D, MATSUMOTO T, YOSHIMURA R, et al. Mutagenicity of amino-α-carbolines in pyrolysis products of soybean globulin[J]. Biochemical and Biophysical Research Communications, 1978, 83(3): 915-920. DOI:10.1016/0006-291X(78)91482-1.
[52] HERRAIZ T. Identification and occurrence of the bioactive β-carbolines norharman and harman in coffee brews[J]. Food Additives and Contaminants, 2002, 19(8): 748-754. DOI:10.1080/02652030210145892.
[53] ZUCKERMAN J A. IARC monographs on the evaluation of carcinogenic risks to humans[J]. Journal of Clinical Pathology, 1995, 64(7): 691. DOI:10.1136/jcp.48.7.691-a.
[54] National Toxicology Program. NTP 12th report on carcinogens[J]. Report on Carcinogens Carcinogen Profiles, 2011, 12(4): 499. DOI:10.1001/jama.284.24.3187.
[55] GIBIS M, KRUWINNUS M, WEISS J. Impact of different pan-frying conditions on the formation of heterocyclic aromatic amines and sensory quality in fried bacon[J]. Food Chemistry, 2015, 168(2): 383-389.
DOI:10.1016/j.foodchem.2014.07.074.
[56] BU?A M, PRZYBYLSKI W, JAWORSKA D, et al. Formation of heterocyclic aromatic amines in relation to pork quality and heat treatment parameters[J]. Food Chemistry, 2019, 276(3): 511-519. DOI:10.1016/j.foodchem.2018.10.073.
[57] DONG A, LEE J, SHIN H. Formation of amino-imidazo-azaarenes and carbolines in fried beef patties and chicken breasts under different cooking conditions in Korea[J]. Food Science and Biotechnology, 2011, 20(3): 735-741. DOI:10.1007/s10068-011-0103-9.
[58] MANABE S, KURIHARA N, WADA O, et al. Formation of PhIP in a mixture of creatinine, phenylalanine and sugar or aldehyde by aqueous heating[J]. Carcinogenesis, 1992, 13(5): 827-830. DOI:10.1093/carcin/13.5.827.
[59] ARVIDSSON P, BOEKEL M, SKOG K, et al. Formation of heterocyclic amines in a meat juice model system[J]. Journal of Food Science, 1999, 64(2): 216-221. DOI:10.1111/j.1365-2621.1999.tb15868.x.
[60] BORDAS M, MOYANO E, PUIGNOU L, et al. Formation and stability of heterocyclic amines in a meat flavour model system: effect of temperature, time and precursors[J]. Journal of Chromatography B, 2004, 802(1): 11-17. DOI:10.1016/j.jchromb.2003.09.024.
[61] SKOG K I, JOHANSSON M A E, J?GERSTAD M I. Carcinogenic heterocyclic amines in model systems and cooked foods: a review on formation, occurrence and intake[J]. Food and Chemical Toxicology, 1998, 36(9/10): 879-896. DOI:10.1016/S0278-6915(98)00061-1.
[62] 杨调调. 西式熏煮香肠加工过程中杂环胺的累积规律及抑制
研究[D]. 无锡: 江南大学, 2019: 13-24.
[63] KNIZE M G, ANDRESEN B D, HEALY S, et al. Effects of temperature, patty thickness and fat content on the production of mutagens in fried ground beef[J]. Food and Chemical Toxicology, 1986, 23(12): 1035-1040. DOI:10.1016/0278-6915(85)90049-3.
[64] ZAMORA R, ZAMBRANO ALC?N E, HIDALGO F J. Effect of lipid oxidation products on the formation of 2-amino-1-methyl-6-phenylimidazo[4,5-b]pyridine (PhIP) in model systems[J]. Food Chemistry, 2012, 135(4): 2569-2574. DOI:10.1016/j.foodchem.2012.06.062.
[65] OZ F, KOTAN G. Effects of different cooking methods and fat levels on the formation of heterocyclic aromatic amines in various fishes[J]. Food Control, 2016, 67: 216-224. DOI:10.1016/j.foodcont.2016.03.013.
[66] TAI C Y, LEE K H, CHEN B H. Effects of various additives on the formation of heterocyclic amines in fried fish fibre[J]. Food Chemistry, 2001, 75(3): 309-316. DOI:10.1016/S0308-8146(01)00200-X.
[67] LIAO Guozhou, XU Xinglian, ZHOU Guanghong. Effects of cooked temperatures and addition of antioxidants on formation of heterocyclic aromatic amines in pork floss[J]. Journal of Food Processing and Preservation, 2009, 33(2): 159-175. DOI:10.1111/j.1745-4549.2008.00239.
[68] WEISBURGER J H. Specific Maillard reactions yield powerful mutagens and carcinogens[M]//LABUZA T P, REINECCIUS G A, MONNIER V M, et al. Maillard reactions in chemistry, food and health. Cambridge: Woodhead Publishing, 2005: 335-340.
[69] 李進. 香辛料抑制卤肉中β-咔啉类杂环胺形成的物质基础及机理初步研究[D]. 武汉: 华中农业大学, 2019: 33-45.
[70] SEPAHPOUR S, SELAMAT J, KHATIB A, et al. Inhibitory effect of mixture herbs/spices on formation of heterocyclic amines and mutagenic activity of grilled beef[J]. Food Additives and Contaminants: Part A, 2018, 35(10): 1911-1927. DOI:10.1080/19440049.2018.1488085.
[71] ROUNDS L, HAVENS C, FEINSTEIN Y, et al. Plant extracts, spices, and essential oils inactivate Escherichia coli O157:H7 and reduce formation of potentially carcinogenic heterocyclic amines in cooked beef patties[J]. Journal of Agricultural and Food Chemistry, 2012, 60(14): 3792-3799. DOI:10.1021/jf204062p.
[72] WEISBURGER J H, VELIATH E, LARIOS E. Tea polyphenols inhibit the formation of mutagens during the cooking of meat[J]. Mutation Research/Fundamental and Molecular Mechanisms of Mutagenesis, 2002, 516(1/2): 19-22. DOI:10.1016/S1383-5718(01)00351-5.
[73] 赵磊, 张会敏, 李煜彬, 等. 15 种黄酮类化合物对烤鸡胸肉中杂环胺含量的影响[J]. 食品科学, 2019, 40(23): 19-25. DOI:10.7506/spkx1002-6630-20181105-045.
[74] PERSSON E, SJ?HOLM I, SKOG K. Effect of high water-holding capacity on the formation of heterocyclic amines in fried beef burgers[J]. Journal of Agricultural and Food Chemistry, 2003, 51(15): 4472-4477. DOI:10.1021/jf021089q.
[75] WANG Y Y, VUOLO L I, SPINGARN N E, et al. Formation of mutagens in cooked foods V. The mutagen reducing effect of soy protein concentrates and antioxidants during frying of beef[J]. Cancer Letters, 1982, 16(2): 179-189. DOI:10.1016/0304-3835(82)90059-3.
[76] 董依迪, 邓思杨, 石硕, 等. 肉制品中杂环胺类物质的形成机制及控制技术的研究进展[J]. 食品工业科技, 2019, 40(8): 278-284. DOI:10.13386/j.issn1002-0306.2019.08.047.
[77] FELTON J S, FULTZ E, DOLBEARE F A, et al. Effect of microwave pretreatment on heterocyclic aromatic amine mutagens/carcinogens in fried beef patties[J]. Food and Chemical Toxicology, 1994, 32(10): 897-903. DOI:10.1016/0278-6915(94)90087-6.
[78] 陈妍方. 微波场下咖啡酸对雜环胺PhIP形成的抑制机制[D]. 无锡: 江南大学, 2019: 16-17.
[79] LIJINSKY W. N-nitroso compounds in the diet[J]. Mutation Research/Fundamental and Molecular Mechanisms of Mutagenesis, 1999, 443(1/2): 129-138. DOI:10.1016/S1383-5742(99)00015-0.
[80] DE MEY E, DE MAERE H, PAELINCK H, et al. Volatile N-nitrosamines in meat products: potential precursors, influence of processing and mitigation strategies[J]. Critical Reviews in Food Science and Nutrition, 2015, 57(13): 2909-2923. DOI:10.1080/10408398.2015.1078769.
[81] 蔡鲁峰, 李娜, 杜莎, 等. N-亚硝基化合物的危害及其在体内外合成和抑制的研究进展[J]. 食品科学, 2016, 37(5): 271-277. DOI:10.7506/spkx1002-6630-201605047.
[82] TRICKER A R, PREUSSMANN R. Carcinogenic N-nitrosamines in the diet: occurrence, formation, mechanisms and carcinogenic potential[J]. Mutation Research/Fundamental and Molecular Mechanisms of Mutagenesis, 1991, 259(3): 277-289. DOI:10.1016/0165-1218(91)90123-4.
[83] PENSABENE J W, FIDDLER W, DOERR R C, et al. Formation of dimethylnitrosamine from commercial lecithin and its components in a model system[J]. Journal of Agricultural and Food Chemistry, 1975, 23(5): 979-980. DOI:10.1021/jf60201a036.
[84] KO?AK D, OZEL M, G?G?S F, et al. Determination of volatile nitrosamines in grilled lamb and vegetables using comprehensive gas chromatography-nitrogen chemiluminescence detection[J]. Food Chemistry, 2012, 135(4): 2215-2220. DOI:10.1016/j.foodchem.2012.07.002.
[85] ENDER F, ?EH L. Conditions and chemical reaction mechanisms by which nitrosamines may be formed in biological products with reference to their possible occurrence in food products[J]. Zeitschrift für Lebensmittel-Untersuchung und-Forschung, 1971, 145(3): 133-142.
DOI:10.1007/BF01839621.
[86] HUXEL E T, SCANLAN R A, LIBBEY L M. Formation of N-nitrosopyrrolidine from pyrrolidine ring containing compounds at elevated temperatures[J]. Journal of Agricultural and Food Chemistry, 1974, 22(4): 698-700. DOI:10.1021/jf60194a008.
[87] DE MEY E, DE MAERE H, DEWULF L, et al. Assessment of the N-nitrosopiperidine formation risk from piperine and piperidine contained in spices used as meat product additives[J]. European Food Research and Technology, 238(3): 477-484. DOI:10.1007/s00217-013-2125-4.
[88] EFSA P O F A, MORTENSEN A, AGUILAR F, et al.
Re-evaluation of potassium nitrite (E249) and sodium nitrite (E250) as food additives[J]. EFSA Journal, 2017, 15(6): 4786. DOI:10.2903/j.efsa.2017.4786.
[89] KRYTOPOULOS A S. IARC monographs on the evaluation of the carcinogenic risk of chemicals to humans, Vol. 17: some N-nitroso compounds[J]. British Journal of Cancer, 1979, 40(4): 167-169. DOI:10.1038/bjc.1979.236.
[90] CREWS C. The determination of N-nitrosamines in food[J]. Quality Assurance and Safety of Crops and Foods, 2010, 2(1): 2-12. DOI:10.1111/j.1757-837X.2010.00049.x.
[91] HERRMANN S S, GRANBY K, DUEDAHL-OLESEN L. Formation and mitigation of N-nitrosamines in nitrite preserved cooked sausages[J]. Food Chemistry, 2014, 174(11): 516-526. DOI:10.1016/j.foodchem.2014.11.101.
[92] SEBRANEK J G, JACKSON-DAVIS A L, MYERS K L, et al. Beyond celery and starter culture: advances in natural/organic curing processes in the United States[J]. Meat Science, 2012, 92(3): 267-273. DOI:10.1016/j.meatsci.2012.03.002.
[93] LI Peijun, KONG Baohua, CHEN Qian, et al. Formation and identification of nitrosylmyoglobin by Staphylococcus xylosus in raw meat batters: a potential solution for nitrite substitution in meat product[J]. Meat Science, 2012, 93(1): 67-72. DOI:10.1016/j.meatsci.2012.08.003.
[94] BINSTOK G, CAMPOS C, VARELA O, et al. Sorbate-nitrite reactions in meat products[J]. Food Research International, 1998, 31(8): 581-585. DOI:10.1016/S0963-9969(99)00031-9.
[95] RYWOTYCKI R. The effect of baking of various kinds of raw meat from different animal species and meat with functional additives on nitrosamine contamination level[J]. Food Chemistry, 2007, 101(2): 540-548. DOI:10.1016/j.foodchem.2006.02.012.
