miR-200b调控PDCD4的表达对乳腺癌细胞增殖和侵袭的影响
2020-06-04
(四川省人民医院东院乳腺甲状腺外科,四川 成都 610000)
乳腺癌是女性最常见的恶性肿瘤之一,近年来其发病率有上升趋势[1]。尽管乳腺癌的筛查和治疗取得了一定进展,但仍然是女性因癌症死亡的主要疾病之一。目前的研究表明,乳腺癌的发生与遗传因素、免疫失调、激素紊乱有关,其发生、发展与多种抑癌基因与促癌因子比例失调密切相关,但其主要的发病机制尚不清楚[2],因此阐明乳腺癌发病机理及其相关分子机制,寻找新的治疗策略尤为重要。
microRNA(miR)是一类长度为18~24 nt的非编码短链RNA,不直接编码蛋白,而是通过调控目的基因的表达,从而影响细胞的增殖、迁移及侵袭[3]。miR-200b(miRBase ID:MIMAT0000318)是miR-200家族成员之一,在多种内皮细胞、干细胞和癌细胞中有表达,并广泛调节细胞的生物学行为[4-5]。miR-200b家族在上皮间质转化中发挥重要作用,可抑制癌细胞增殖和迁移[6]。有研究发现,miR-200b在结肠癌、胃癌、乳腺癌中的表达均有降低,但具体机制尚未阐明[7-9]。程序性细胞死亡因子4(programmed cell death factor4,PDCD4)是近年来发现的肿瘤抑制基因之一,与miR-200b在胃癌中的表达呈负相关,抑制胃癌细胞miR-21的表达后可上调表达,发挥抑制胃癌细胞增殖并诱导其凋亡的作用,且PDCD4的下调与雌激素受体阳性乳腺癌预后不良相关[10-11]。然而,miR-200b与PDCD4在乳腺癌的发生发展中是否起到关键作用尚不清楚,因此,本研究测定miR-200b在乳腺癌组织和细胞株中的表达水平,并通过生物信息学预测PDCD4和miR-200b结合序列的相似关系,进一步研究miR-200b和PDCD4在乳腺癌细胞株中的调控关系及其对乳腺癌细胞株生物学行为的影响,为阐明乳腺癌的发病机制提供新的方向。
1 材料与方法
1.1 临床标本采集与处理
收集2017年6月至2018年2月在我院经病理检查确诊为乳腺癌的患者标本(肿瘤组织及癌旁组织43例)。离体后迅速放入液氮罐中低温保存。所有患者术前未行化疗、放疗、基因靶向治疗,乳腺癌为原发病灶并经病理科证实。本研究通过我院伦理委员会审批,术前患者及其家属均签署知情同意书。
1.2 细胞株与主要试剂
人乳腺癌细胞HCC38、MCF-7、MDA-MB-231及人乳腺正常上皮细胞MCF10A均购于美国ATCC公司,1640培养液、特级胎牛血清、双抗溶液及OPTI-ME购于美国Gibco公司。PDCD4兔抗、GAPDH兔抗、二抗山羊抗兔均购于美国Santa Cruz公司。miR-200b qPCR引物以及RNA提取试剂盒、逆转录试剂盒、PCR试剂盒均购于上海吉玛基因有限公司。Lipo2000试剂购于美国Invitrogen公司。基质胶(Matrige1)购于美国BD公司。Transwell小室购于美国Costar公司。miR-200b-siRNA、PDCD4-mimics及对照miRNA购自上海吉凯制药技术有限公司。全蛋白提取试剂盒、BCA蛋白浓度检测试剂盒、高灵敏ECL化学放光试剂盒购于上海碧云天生物技术有限公司。
1.3 方法
1.3.1 细胞培养及转染分组 将HCC38、MCF-7、MDA-MB-231、MCF10A细胞在含10%胎牛血清的RPMI-1640培养基中培养,条件:温度37 ℃,5%CO2。转染前24 h,将细胞以50%~60%的密度接种于生长培养基中。根据培养手册,使用Lipofectamine RNAiMax将miR-200b siRNA转染MCF-7细胞,获得稳定转染细胞后将PDCD4 mimics转染到已转染miR-200b siRNA的MCF-7细胞中。将细胞分为4组,转染miR-200b siRNA的MCF-7细胞为miR-200b实验组,未转染的MCF-7细胞为miR-200b对照组,同时转染miR-200b和PDCD4蛋白的MCF-7细胞为PDCD4实验组,只转染miR-200b的MCF-7细胞为PDCD4对照组。
1.3.2 RNA提取和荧光实时定量PCR检测miR-200b的表达 Trozel法提取组织及细胞内总RNA,逆转录,PCR扩增miR-200b,使用GAPDH作为内参。反应条件:以100 ng总RNA为模板,逆转录cDNA,反应条件为37 ℃ 15 min,95 ℃ 5 min。然后根据PCR试剂盒说明书进行PCR反应。获得数据以RQ=2-ΔΔCT计算mRNA表达量。实验重复3次。miR-200b上游引物:5′-TGCCGTAATACTGCCTGGTAA-3′;下游引物:5′-CAGAGCAGGGTCCGAGGTA-3′。GAPDH内参上游引物:5′-GGTCGGGCAGGAAAGAGGGC-3′;下游引物:5′-CTAATCTTCTCTGTATCGTTCC-3′。PDCD4上游引物:5′-AAGAAAGGTGGTGCAGGAGG-3′;下游引物:5′-TGACTAGCCTTCCCCTCCAA-3′。
1.3.3 双荧光素酶活性测定 miR-200b和PDCD4重组质粒共转染到MCF-7细胞中。分组如下:miR-200b siRNA+Wt PDCD4、miR-200b NC+Wt PDCD4、miR-200b siRNA+Mut PDCD4、miR-200b NC+Mut PDCD4。根据siPORTneoFX使用方法操作,在转染后48 h 制备裂解物。然后根据说明书,使用双荧光素酶测定系统进行荧光素酶分析。实验重复3次。
1.3.4 蛋白免疫印迹实验检测PDCD4的表达水平 提取蛋白后,用12%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳凝胶分离等量的蛋白质。将凝胶上的蛋白质转移到硝酸纤维素膜上,然后在室温下用5%脱脂奶粉封闭2 h。PDCD4一抗(1∶1 000)在4 ℃下孵育温育过夜后,用辣根过氧化物酶标记的二抗(1∶5 000)孵育2 h,最后使用ECL显影液检测目标蛋白的表达水平。使用GAPDH作为蛋白对照。实验重复3次。
1.3.5 CCK-8实验测定细胞增殖活性 使用CCK-8试剂盒测定细胞的活性。将经过转染的MCF-7细胞接种在96孔板中,每孔1×104个细胞。在37 ℃、5%CO2的培养箱中孵育24 h。然后加入20 μL的CCK-8溶液,并在37 ℃下孵育4 h。使用酶标仪板在490 nm波长下测量不同组的OD值。实验重复3次。
1.3.6 Transwell侵袭实验 将基质胶在4 ℃环境中过夜融化,与3倍体积的无血清培养基混合均匀后加入24孔Transwell小室(每孔50 μL)。复温30 min后,将250 mL 10%FBS、1640加入下室中,并且将1×105个细胞种植在上室中,在培养箱中再培养 24 h。利用棉签轻微地清洁膜上表面的细胞,穿透聚碳酸酯膜的细胞用甲醇固定并用0.1%结晶紫染色。随机选择5个视野,在倒置显微镜下计数侵袭到下侧的细胞数。实验重复3次。
1.4 统计学分析
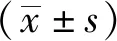
2 结果
2.1 人乳腺癌组织及不同乳腺癌细胞株中miR-200b表达水平的比较
实时定量PCR结果显示,miR-200b在乳腺癌组织中的表达低于正常乳腺组织,差异具有统计学意义(P<0.05),见图1a。HCC38、MCF-7、MDA-MB-231细胞株中miR-200b的表达水平高于正常乳腺上皮细胞MCF10A,差异有统计学意义(P<0.05),见图1b;MCF-7细胞株相对于HCC38和MDA-MB-231细胞株中miR-200b的表达水平较高,因此后续实验选取乳腺癌MCF-7细胞株作为研究对象。

a:miR-200b在不同组织中的表达水平 *:与正常组织比较,P<0.05; b:miR-200b在不同细胞株中的表达水平 *:与MCF10A比较,P<0.05
图1 人乳腺癌组织及不同乳腺癌细胞株中miR-200b表达水平的比较
2.2 miR-200b和PDCD4在乳腺癌细胞株MCF-7中的调控关系
采用TargetScan、PicTar4和miRanda数据库对miR-200b进行检索,预测其靶基因,发现miR-200b和PDCD4间有部分相同的结合序列(图2a)。因此通过双荧光素酶报告基因明确miR-200b和PDCD4间的调控关系。将miR-200b siRNA、PDCD4 3′-UTR共转染到MCF-7细胞中,双荧光素酶报告基因结果显示:与miR-200b NC+Mut PDCD4相比,miR-200b siRNA+Mut PDCD4的荧光素酶活性显著增高;抑制miR-200b的表达后,PDCD4的表达及活性相应上调[(1.51±0.33)vs.(1.22±0.15),P<0.001],见图2b。

a:miR-200b和PDCD4间有部分相同的结合序列;b:双荧光素酶报告基因明确miR-200b和PDCD4间的调控关系 *:与miR-200b siRNA Mut PDCD4比较,P<0.001
图2 miR-200b和PDCD4在乳腺癌细胞株MCF-7中的调控关系
2.3 miR-200b对MCF-7细胞株PDCD4蛋白表达水平、细胞增殖和侵袭能力的影响
蛋白免疫印迹实验发现,抑制miR-200b表达后,PDCD4蛋白表达含量下降(P<0.05),见图3a;并且抑制miR-200b表达后,与miR-200b siRNA+Wt PDCD4组相比,miR-200b NC+Wt PDCD4组的MCF-7细胞增殖率增高[(0.66±0.19)vs.(0.92±0.25),P<0.05],见图3b。细胞侵袭实验发现,培养36 h后,miR-200b siRNA+Wt PDCD4和miR-200b NC+Wt PDCD4侵袭至Transwell小室下的MCF-7乳腺癌细胞分别为(245.71±21.04)个和(449.39±39.17)个,表明抑制miR-200b表达后,乳腺癌MCF-7细胞株细胞侵袭能力增强(P<0.05),见图3c。
2.4 PDCD4对乳腺癌细胞株PDCD4蛋白表达水平、细胞增殖和侵袭能力的影响
蛋白免疫印迹实验发现,增强PDCD4表达后,PDCD4蛋白表达含量上调(P<0.05),图4a;增强PDCD4表达后,与miR-200b NC+Mut PDCD4组相比,miR-200b siRNA+Mut PDCD4组MCF-7细胞增殖率降低[(0.63±0.15)vs.(0.34±0.09),P<0.05],见图4b。细胞侵袭实验发现,培养36 h后,miR-200b siRNA+Mut PDCD4和miR-200b NC+Mut PDCD4侵袭至Transwell小室下的MCF-7乳腺癌细胞分别为(265.71±18.21)个和(142.33±16.29)个,表明增强PDCD4表达后,乳腺癌MCF-7细胞株细胞侵袭能力减弱,见图4c。

a:miR-200b对PDCD4蛋白表达的影响;b:miR-200b对细胞活性的影响;c:miR-200b对细胞侵袭能力的影响 *:与miR-200b NC+Wt PDCD4比较,P<0.05
图3 miR-200b对MCF-7细胞株PDCD4蛋白表达水平、细胞增殖和侵袭能力的影响
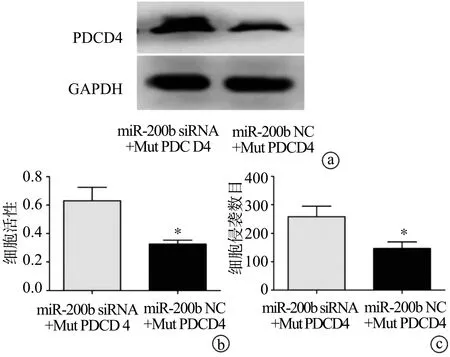
a:PDCD4蛋白表达的变化;b:PDCD4对细胞活性的影响;c:PDCD4对细胞侵袭能力的影响 *:与miR-200b siRNA+Mut PDCD4比较,P<0.05
图4 PDCD4对乳腺癌细胞株PDCD4蛋白表达水平、细胞增殖和侵袭能力的影响
3 讨论
乳腺癌在女性癌症中发病率居首位,居高不下的发病率以及肿瘤的复发和转移仍是目前关注的重点,虽然已有大量的学者对其发病机制进行研究,但尚无统一的定论[12]。目前研究表明,miRNA在肿瘤的发生发展过程中扮演着重要角色,通过与靶基因的3′-UTR结合,形成RNA诱导或沉默复合体,在转录或翻译水平对靶基因进行上调或下调,从而对肿瘤细胞生物学行为产生影响[13]。Liu等[14]的研究发现miR-214可通过促进PENT基因的表达,从而抑制骨肉瘤的增殖及转移。Shrestha等[15]的研究表明,miR-204在胃癌中可同时对CKS1B、CXCL1及GPRC5A基因进行调控,从而抑制胃癌细胞的增殖与凋亡。因此,寻找恶性肿瘤中特异性表达的miRNA及其调控的下游靶基因,再转录水平进行外源性调控,可能是治疗恶性肿瘤新的突破口。
miRNA正在成为各种基本生物过程中的关键参与者,并且其表达改变与肿瘤发生、发展和转移特异性相关。miR-200b在许多癌症中过度表达,如乳腺癌、胃癌和结肠直肠癌,是恶性肿瘤预后的负面因素,与转移程度呈正相关[16-18]。miR-200家族基因主要由miR-200a、miR-200b、miR-200c、miR-141、miR-429组成,自Gregory等[16]首次发现miR-200家族在恶性肿瘤中的表达呈抑制状态以来,越来越多的研究发现miR-200家族通过调节内皮细胞间质化从而用抑制肿瘤新生的血管支持自身的能力,阻断肿瘤的发展和转移[17]。对于肺癌、卵巢癌、肾癌或三阴性乳腺癌,体内miR-200家族基因高表达的患者生存期较低表达患者长,其中miR-200a在三阴性乳腺癌患者体内明显降低,体外实验发现其在乳腺癌细胞株中表达降低,通过抑制乳腺癌细胞凋亡,从而抑制乳腺癌的进展,但具体机制至今仍未阐明[18-19]。PDCD4是新发现的一种细胞凋亡相关基因。Shibahara等[20]于1995年在小鼠身上成功克隆PDCD4,发现其功能上可以调节细胞的程序性死亡,也通过抑制蛋白转录和翻译过程抑制肿瘤细胞生长。Kamel等[21]研究表明,PDCD4与microRNA-21在结直肠癌细胞中的表达呈负相关,通过上调PDCD4的表达,能够发挥抑制结直肠癌细胞增殖并诱导细胞凋亡的作用。而miR-200b与PDCD4在乳腺癌中的表达以及是否在乳腺癌的发生、发展过程中发挥重要的作用还未见报道,因此本研究通过实时定量PCR检验乳腺癌及正常乳腺组织中miR-200b的表达水平,发现miR-200b在乳腺癌组织中呈低表达,进一步抑制miR-200b的表达,乳腺癌细胞的增殖及侵袭能力显著增强,表明miR-200b是乳腺癌细胞中的抑癌基因,可以抑制乳腺癌细胞的增殖及侵袭。
本研究采用TargetScan、PicTar4和miRanda数据库对miR-200b进行检索,预测其靶基因,发现miR-200b和PDCD4间有部分相同的结合序列,推测PDCD4是miR-200b在乳腺癌中发挥抑癌作用的靶基因,故通过双荧光素酶报告基因明确miR-200b和PDCD4间的调控关系。本研究将miR-200b siRNA、PDCD4 3′-UTR共转染到乳腺癌MCF-7细胞中,结果显示抑制miR-200b的表达后,PDCD4的表达及活性相应上调,乳腺癌细胞的增殖及侵袭能力明显增强,并且同时过表达PDCD4后PDCD4蛋白表达含量增加,乳腺癌细胞的增殖及侵袭能力比之前降低,说明miR-200b可调控PDCD4基因的表达,抑制乳腺癌细胞的生物学行为,但其是否特异性靶向调控下游基因或蛋白进而抑制乳腺癌细胞的生物学行为还不得而知,也是本实验今后继续研究的方向。
综上所述,miR-200b可调控PDCD4基因的表达,抑制乳腺癌细胞的增殖及侵袭能力。本实验为miR-200b在乳腺癌细胞增殖和侵袭的作用方式和机制的阐释提供了一定的理论基础,也为乳腺癌的诊断和治疗开辟新的治疗靶点提供可能。
