均匀设计法优化麦麸阿魏酸的酶法提取工艺
2020-06-03赵文红冯丽然关二旗杨国龙
赵文红,冯丽然,关二旗,杨国龙*
河南工业大学粮油食品学院(郑州 450001)
麦麸是小麦生产副产品,在中国年产量超过2 000万t[1]。麦麸的用途单一,较大一部分会被用作动物饲料[2],这种用途技术含量特别低,造成资源的严重浪费;有时会被当作酿造辅料进行食品的加工,附加值较低[3],因此有必要对其进行进一步开发,以实现副产品资源的高效利用。
麦麸含有丰富的矿物元素[4]、膳食纤维[5]和酚酸等[6]天然活性成分。其中,阿魏酸(FA)是其含量最多的酚酸成分[7](其分子结构见图1)。阿魏酸具有的天然独特的抗氧化性、抑菌性和抗癌特性[8],且被人体吸收后易从尿液中排出,不在体内形成累积[9],因此在医药、食品行业和化妆品行业中均有应用[10]。试验针对麦麸中的阿魏酸进行提取工艺优化研究,可综合利用小麦副产物,提高麦麸附加值,从而实现更大的经济和社会效益。
目前,采用碱解法、酶水解法、酶-碱协同提取法、高温蒸煮法等[11]提取制备阿魏酸。其中,酶解法是利用生物活性酶水解植物细胞壁,从而使阿魏酸被分解出来。相比其他方法,酶法效果卓越,稳定性强且安全清洁[12],具有利用前景。试验通过酶水解法来提取麦麸中阿魏酸。
在前期初步酶解反应基础上,发现多种因素影响麦麸阿魏酸的提取,可通过均匀设计考察这些因素对酶解效果影响的大小及顺序。均匀设计是一种适合在考察因素多、水平多的情况下用较少的试验次数得到较优工艺条件的试验方法,可将各试验因素按重要性排序,简便灵活,并且所得结果精确可靠[13]。试验采用均匀设计来优化麦麸阿魏酸的提取工艺,从而得到最佳的酶解工艺条件。
在前期酶法提取麦麸阿魏酸基础上,利用Viscozymel复合酶水解麦麸,进行单因素试验和均匀设计优化麦麸阿魏酸的酶法提取工艺试验,并通过分光光度计和HPLC法进行提取物的定性鉴别,为小麦资源的综合利用和和保健品开发提供试验支撑。
图1 阿魏酸的结构式
1 材料与方法
1.1 材料、仪器与设备
小麦麸皮(郑州金苑面业有限公司);α-淀粉酶、中性蛋白酶(北京奥博星生物技术有限责任公司);Viscozymel复合酶(Sigma Life Science公司);生化试剂为生物纯(BR);无水乙醇、醋酸、醋酸钠等均为分析纯(AR)。
UV-6100S紫外分光光度计(上海美谱达仪器有限公司);XMTD-8222电热恒温水浴锅(上海精宏实验设备有限公司);BJ-300多功能粉碎机(德清拜杰电器有限公司);101电热鼓风干燥器(北京市永光明医疗仪器厂);AL204电子分析天平(梅特勒-托利多仪有限公司);PHS-3C酸度计(上海仪电科学仪器股份有限公司);XMTD-8222电热恒温水浴锅(上海精宏实验设备有限公司)。
1.2 试验方法
1.2.1 原料的预处理和酶活力测定
将新鲜麦麸在105 ℃下灭酶4 h,粉碎,按欧仕益等[8]的方法采用淀粉酶和蛋白酶脱除去麦麸中所含的淀粉和蛋白质,将样品烘干,粉碎,过80目备用。
在酶活力测定中,通过标准曲线法对Viscozymel复合酶进行酶活力测定[14],所得Viscozymel复合酶酶活为98.67 U/mL。
1.2.2 麦麸阿魏酸含量测定
参考Katapodis等[15]使用的紫外双波长法,取阿魏酸酶解液与100 mmol/L MOPS缓冲溶液(pH 6.0)按1∶2比例,分别在286和325 nm波长下测定溶液的吸光度。已知阿魏酸的摩尔吸光系数ε286=14 176 L·mol-1·cm-1,ε325=10 350 L·mol-1·cm-1,结合型阿魏酸的摩尔吸光系数ε’286=12 465 L·mol-1·cm-1,ε’325=19 345 L·mol-1·cm-1。根据朗伯比尔定律A=εbc可知物质的浓度与吸光度呈正比。按照式(1)计算酶解产物中阿魏酸含量。
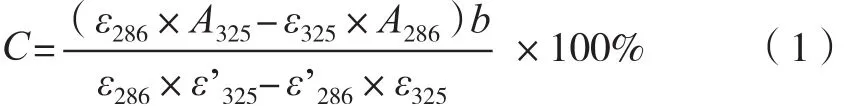
式中:C为阿魏酸浓度,mol/L;A286为被测液在286 nm处吸光度;A325为被测液在325 nm处的吸光度;b为比色皿厚度,cm。
1.3 酶法提取阿魏酸的单因素试验
1.3.1 最适酶解时间的确定
准确称取11份2 g麦麸膳食纤维,加入40 mL pH 5.0,质量浓度为3 g/L的酶液,在50 ℃恒温振荡器中分别酶解1,2,4,6,8,10,12,18,24,30和36 h,酶解结束后于沸水浴中灭酶,以3 500 r/min转速离心10 min,取上清液测定阿魏酸浓度。
1.3.2 最适酶添加量的确定
准确称取5份2 g麦麸膳食纤维,加入40 mL pH 5.0,质量浓度1,2,3,4和5 g/L的酶液,在50 ℃恒温振荡器中酶解4 h,酶解结束后于沸水浴中灭酶,以3 500 r/min转速离心10 min,取上清液测定阿魏酸的浓度。
1.3.3 最适pH的确定
准确称取6份2 g麦麸膳食纤维,分别加入40 mL pH 3.5,4.0,4.5,5.0,5.5和6.0,质量浓度为3 g/L的酶液,在50 ℃恒温振荡器中酶解4 h,酶解结束后于沸水浴中灭酶,以3 500 r/min转速离心10 min,取上清液测定阿魏酸浓度。
1.3.4 最适温度的确定
准确称取5份2 g麦麸膳食纤维,加入40 mL pH5.0,质量浓度为3 g/L的酶液,分别在30,40,50,60和70 ℃恒温振荡器中酶解1 h,酶解结束后于沸水浴中灭酶,以3 500 r/min转速离心10 min,取上清液测定阿魏酸浓度。
1.3.5 最适底物浓度的确定
分别准确称取1,2,3,4和5 g(25,50,75,100和125 g/L)膳食纤维,加入40 mL pH 5.0,质量浓度为3 g/L的酶液,在50 ℃恒温振荡器中酶解4 h,酶解结束后于沸水浴中灭酶,以3 500 r/min转速离心10 min,取上清液测定阿魏酸的浓度。
1.4 均匀设计法优化阿魏酸提取工艺条件设计
为了进一步优化酶法提取麦麸阿魏酸的条件,在以酶解液中阿魏酸的浓度为指标研究5个单因素试验基础上,采用SPSS 19.0软件中的Regression-Linear分析模型进行设置。选用均匀设计表U10(105),均匀设计偏差D为0.241 4。选用对阿魏酸的提取量影响较大的5个因素——酶解时间(X1)、酶添加量(X2)、酶解pH(X3)、酶解温度(X4)和底物浓度(X5)作为考察因素,设计各因素取值范围见表1。以阿魏酸的提取量为指标,优化酶法提取麦麸阿魏酸的最佳工艺条件,试验设计方案见表2。

表1 均匀设计各因素取值表
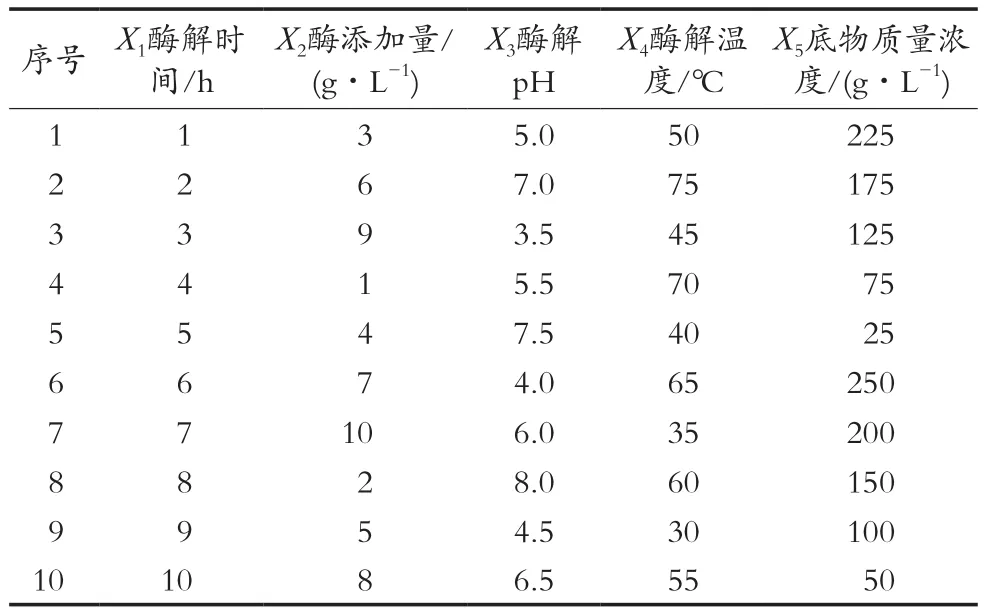
表2 U10(105)均匀设计试验方案
1.5 酶法提取麦麸阿魏酸的验证试验
按照1.4中数据分析得出的最佳提取工艺条件,进行3次重复试验,对试验结果进行验证,观察对麦麸阿魏酸提取量的影响。
1.6 酶解液中阿魏酸组分的定性鉴别
1.6.1 酶解液中阿魏酸组分的紫外光谱分析
参照孙元琳等[16]的研究,取适量阿魏酸样品与100 mmol/L MOPS缓冲溶液(pH 6.0)按1∶2比例,进行紫外可见吸收扫描,扫描范围为220~400 nm。
1.6.2 酶解液中阿魏酸组分的HPLC分析
精密称取适量阿魏酸对照品,加入甲醇溶解标准品,作为对照品储备溶液。参照曾凤彩[17]的研究,取1 mL麦麸阿魏酸样品(1 mg/mL)于试管中,加入1 mL NaOH溶液(0.4 mol/L)混匀后避光在35 ℃反应3 h。取出冷却后,加入1.5 mL H3PO4溶液(0.4 mol/L)中和。将反应液和对照品溶液过0.45 μm有机滤头后进行HPLC检测。HPLC条件为:色谱柱ZORBAX SBC18柱(4.6 mm×250 mm×5 μm);流动相为V(甲醇)∶V(1%醋酸溶液)=0.28∶0.72;流速1.0 mL/min;检测波长320 nm;柱温40 ℃;进样量10 μL。
1.7 数据处理
试验数据以x±SD表示,数据采用Microsoft Excel 2010软件、SPSS 19.0软件、Origin 8.0 绘图软件进行分析。
2 结果与分析
2.1 酶法提取阿魏酸的单因素试验结果
2.1.1 酶解时间对阿魏酸提取的影响
研究酶解时间对阿魏酸提取浓度的影响,选择酶解时间1~36 h,在底物质量浓度75 g/L、酶添加量3 g/L、反应pH 5.0、反应温度50 ℃条件下,酶解时间对阿魏酸浓度的影响如图2所示。
结果表明,随着酶解时间延长,所得阿魏酸浓度先增大后减小,酶解时间为4 h时,得到阿魏酸浓度最大,达到13.17×10-6mol/g。酶解4 h后,随着酶解时间增长,阿魏酸浓度急剧减小,随后趋于平缓。原因可能是酶在反应过程中部分失活,产物的生成对酶促反应有一定的抑制作用,以及随着反应的进行底物浓度逐渐降低等原因,造成酶解反应速度下降。因此最佳酶解时间为4 h。
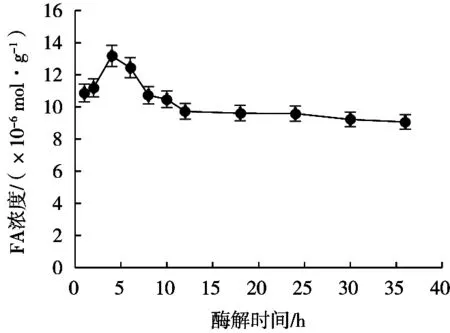
图2 酶解时间对阿魏酸提取的影响
2.1.2 酶添加量对阿魏酸提取的影响
研究酶添加量对阿魏酸提取浓度的影响,选择酶添加量范围1~5 g/L,在反应温度50 ℃、底物质量浓度75 g/L、反应pH 5.0、反应时间4 h条件下,酶添加量对阿魏酸浓度的影响如图3所示。
从图3可以看出,随着酶添加量增加,阿魏酸浓度先增加后减小,酶添加量3 g/L时,得到的阿魏酸浓度最大,达到12.68×10-6mol/g。酶添加量3 g/L后,随着酶添加量增加,阿魏酸浓度呈下降趋势。
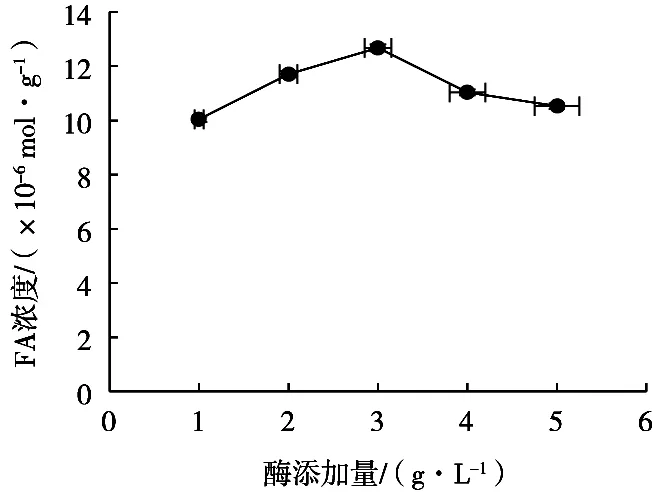
图3 酶添加量对阿魏酸提取的影响
2.1.3 酶解pH对阿魏酸提取的影响
研究酶解pH对阿魏酸提取浓度的影响,选择酶解pH 3.5~6.0,在反应温度50 ℃、底物质量浓度75 g/L、酶添加量3 g/L、反应时间4 h条件下,酶解pH对阿魏酸浓度的影响如图4所示。
从图4可以看出,随着pH增大,阿魏酸浓度逐渐减小,从pH 3.5到pH 5.0变化趋势较明显,从pH 5.0到pH 6.0的变化缓慢,pH 3.5时,阿魏酸浓度达到最大值。因此最佳酶解pH 3.5。
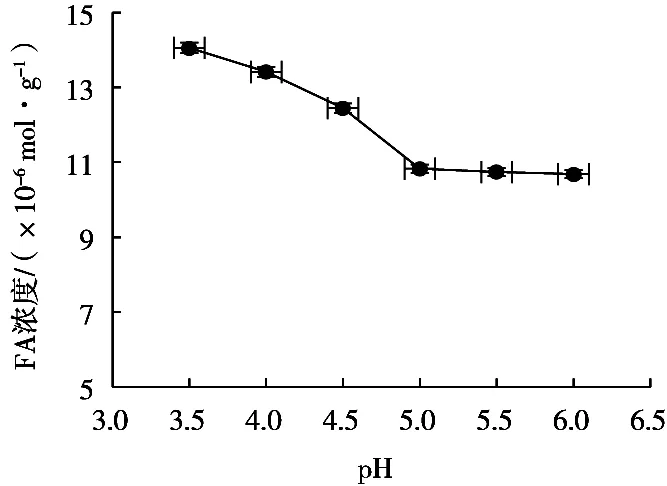
图4 酶解pH对阿魏酸提取的影响
2.1.4 酶解温度对阿魏酸提取的影响
研究酶解温度对阿魏酸提取浓度的影响,选择酶解温度范围30~70 ℃,在底物质量浓度75 g/L、酶添加量3 g/L、反应pH 5.0、反应时间1 h条件下,酶解温度对阿魏酸浓度的影响如图5所示。
结果表明,在30~50 ℃范围内,随着酶解温度提高,阿魏酸浓度逐渐增大,温度50 ℃时,阿魏酸浓度达到最大值,随着温度的继续升高,阿魏酸浓度急剧下降。原因是酶的最适酶解温度50 ℃,继续增加温度后,酶活力降低,酶解效果变差,因而阿魏酸浓度降低。因此最佳酶解温度为50 ℃。
2.1.5 底物质量浓度对阿魏酸提取的影响
研究底物质量浓度对阿魏酸提取浓度的影响,选择底物质量浓度25~125 g/L,在反应温度50 ℃、酶添加量3 g/L、反应pH 5.0、反应时间4 h条件下,底物浓度对阿魏酸浓度的影响如图6。
结果表明,在试验范围内,随着底物浓度增加,阿魏酸浓度增加,底物质量浓度25 g/L时,阿魏酸浓度为2.12×10-5mol/g,而底物质量浓度125 g/L时,阿魏酸浓度降为1.49×10-5mol/g。原因是底物浓度增加时,降低了酶与底物的接触几率,酶反应受到抑制,不利于酶解反应进行,使得提取的阿魏酸含量降低。在后续优化试验中的中位底物质量浓度选为75 g/L。
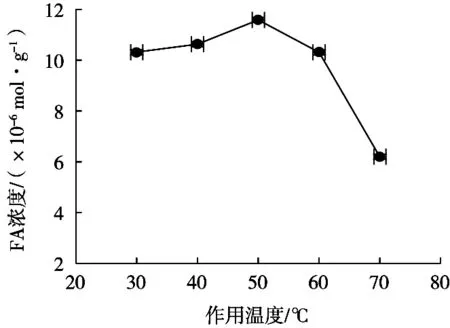
图5 酶解温度对阿魏酸提取的影响
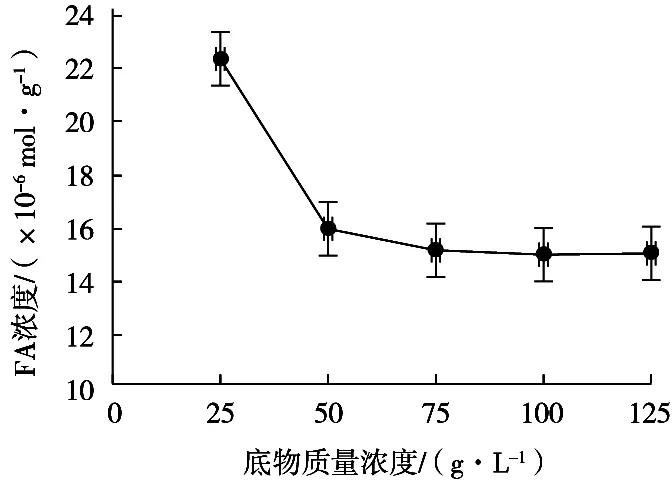
图6 底物质量浓度对阿魏酸提取的影响
2.2 均匀设计法优化阿魏酸的提取工艺结果
为进一步优化酶解时间(X1)、酶添加量(X2)、酶解pH(X3)、酶解温度(X4)和底物质量浓度(X5)这5个对麦麸阿魏酸提取量影响较大的因素,在单因素试验的基础上,使用U10(105)均匀设计方案,均匀设计试验结果如表3所示。
如果采用直观分析法,可以看出5号试验所得到的阿魏酸的提取量最高为3.76×10-5mol/g,相应的提取条件为:酶解时间5 h、酶添加量4 g/L、酶解pH 7.5、酶解温度40 ℃、底物浓度25 g/L。利用SPSS 19.0软件对试验结果运用后退法进行多元回归分析,取显著性水平a=0.05,建立回归方程:Y=b0+b1X1+b2X2+b3X3+b4X4+b5X5。回归系数:b0=2.23×10-4,b1=-0.99×10-5,b2=1.07×10-5,b3=1.80×10-5,b4=-0.02×10-5,b5=-0.09×10-5。偏回归系数为:B1=-1.29,B2=1.39,B3=1.17,B4=-0.15,B5=-2.99。
标准化偏回归系数的大小顺序为:B5>B2>B1>B3>B4。可见酶解提取阿魏酸的均匀设计试验中5个因素对提取的影响顺序为:底物浓度>酶添加量>酶解时间>酶解pH>酶解温度。通过回归方程中酶的添加量系数为正数,可知该因素对试验结果产生正向的影响。同时对阿魏酸的均匀设计显著性检验及残差分析,如表4。
由回归分析结果和表4的变量分析表可知,样本容量n=10,试验建立的回归方程为Y=2.23×10-4-0.99×10-5X1+1.07×10-5X2+1.80×10-5X3-0.02×10-5X4-0.09×10-5X5。检验值Ft=2.65,临界值F(5,4)(0.05)=0.18,Ft>F(5,4)(0.05),回归方程显著,证明所建立模型有效。通过软件寻优计算得出最佳工艺指标参数,其中回归方程Y预期最大值为3.59×10-5mol/g,此时X1=5,X2=4,X3=7.5,X4=40,X5=25,即酶解时间5 h、酶添加量4 g/L、酶解pH 7.5、酶解温度55 ℃、底物质量浓度25 g/L,在此工艺参数下所得的阿魏酸提取量可达3.64×10-5mol/g。
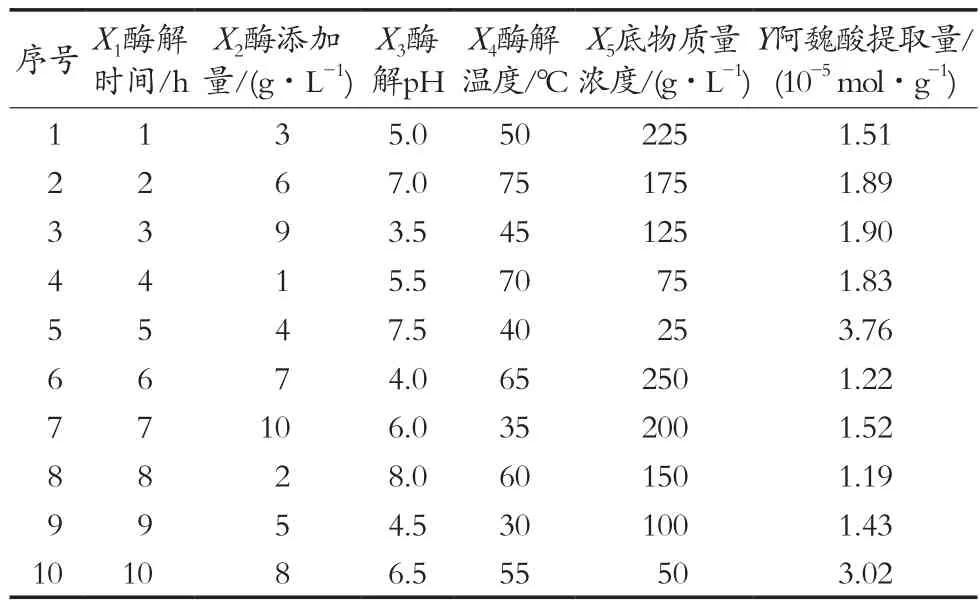
表3 U10(105)均匀设计试验结果

表4 变量分析表
2.3 酶解提取阿魏酸的验证试验
根据均匀设计优化得出工艺参数,即酶解时间5 h、酶添加量4 g/L、酶解pH 7.5、酶解温度55 ℃、底物质量浓度25 g/L,以及试验最佳工艺参数(酶解时间5 h、酶添加量4 g/L、酶解pH 7.5、酶解温度40 ℃,底物浓度25 g/L)条件下进行验证试验,结果见表5。结果表明,优化工艺条件下得到麦麸阿魏酸的平均提取量为(3.64±0.07)×10-5mol/g,优于试验最佳工艺条件下麦麸阿魏酸的提取量(3.46±0.073 32)×10-5mol/g。优化工艺条件重复试验RSD为1.95%,由此表明此工艺参数基本可靠,且重现性好。
2.4 酶解液中阿魏酸组分的定性鉴别
2.4.1 阿魏酸组分的紫外光谱分析
将提取的麦麸阿魏酸的紫外全波长扫描如图7所示,从阿魏酸的紫外全波长扫描图谱中可以看出,在325 nm左右出现最大吸收峰。这与Jankovska等[18]研究中在325 nm左右这个位置出现较强的吸收特征峰表明是酚酸分子中苯环的特征吸收一致,表明酶解液组分中含有阿魏酸。
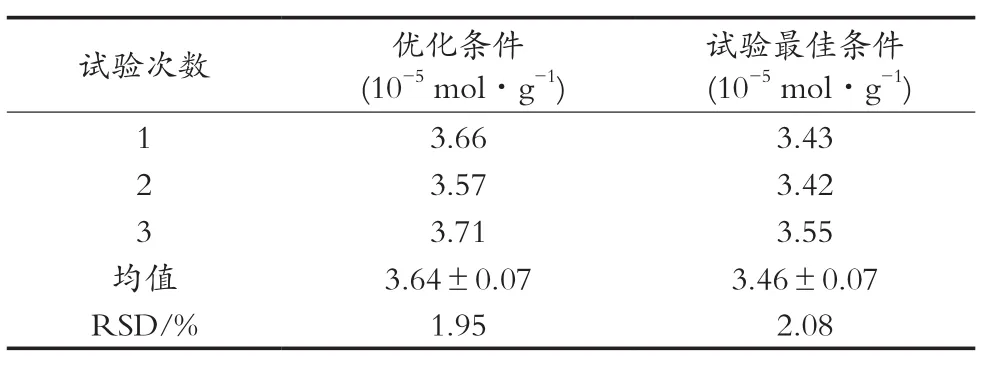
表5 酶解提取阿魏酸的工艺验证
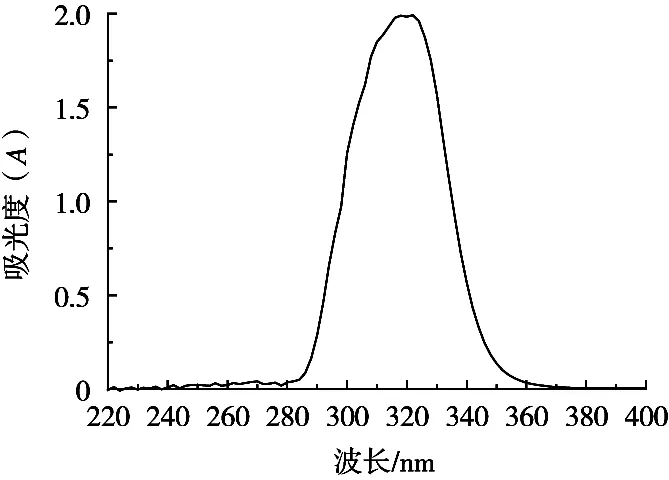
图7 Sephadex LH-20凝胶柱洗脱组分的紫外全波长扫描图谱
2.4.2 阿魏酸组分的HPLC分析
采用HPLC检测对照品和提取的样品中阿魏酸的成分,结果见图8。
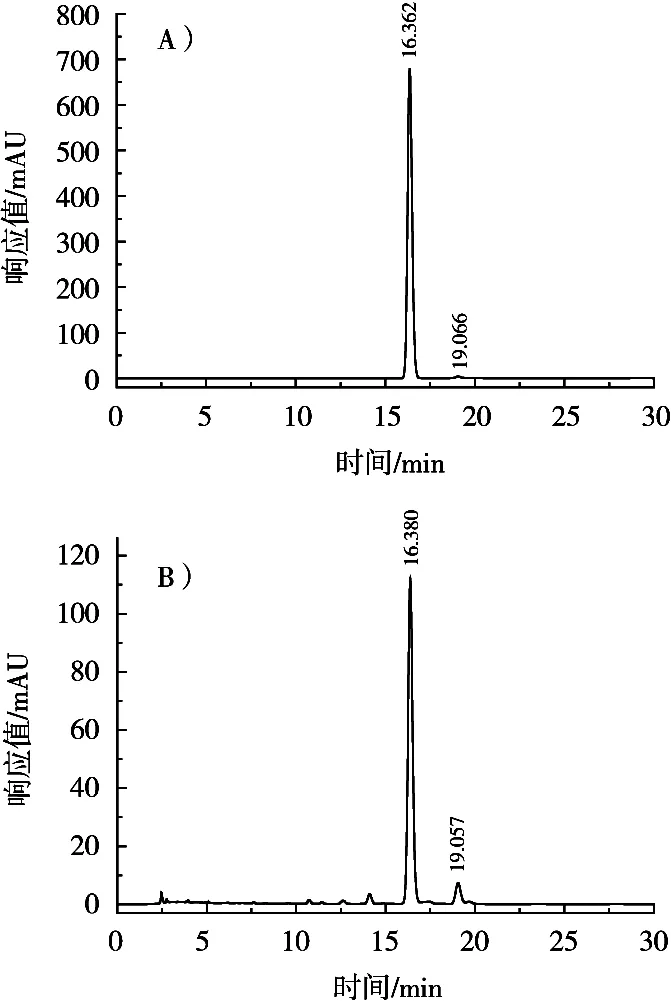
图8 反式阿魏酸对照品(A)和麦麸样品(B)HPLC图谱
结果表明,反式阿魏酸HPLC的出峰时间为16.362 min,其中图谱在19.066 min还出现一个很小的峰,此峰为顺式阿魏酸的特征峰[19]。与FA标品相比,提取的麦麸阿魏酸样品在16.362和19.066 min左右均出现检出峰(图B),说明酶解液成分中存在顺、反式阿魏酸,并且顺式与反式峰面积比例都在1∶10左右,这与丁明玉等[20]通过高效液相色谱法确认阿魏酸在川芎和当归药材中的存在形式研究一致。
3 结论与展望
试验采用Viscozymel复合酶水解麦麸,以阿魏酸的提取量为评价指标,在单因素试验的基础上,利用均匀设计法优化影响提取阿魏酸的酶法的最佳工艺条件,并经分光光度计和HPLC法进行定性鉴别。
1) 采用均匀设计法。对提取阿魏酸的均匀设计显著性检验分析结果可得,检验值Ft=2.65,临界值F(5,4)(0.05)=0.18,Ft>F(5,4)(0.05),回归方程显著,证明所建立模型有效。据报道显示,正交试验法具有均匀分散、齐整可比的特点,但是当试验的因素和水平数都较多时,正交设计不具备可行性,而采用均匀设计可大大减少试验的工作量,在很大程度上节约人力和物力;响应面设计能够得到几种变量因素间的交互作用,但是对自变量有特殊要求,而均匀设计法具有更加方便和迅速的优势,并能将各试验因素按重要性排序。
2) 酶法提取麦麸阿魏酸的均匀设计试验中5个因素对提取的影响顺序为:底物浓度>酶添加量>酶解时间>酶解pH>酶解温度。获得的最佳工艺为:酶解时间5 h、酶添加量4 g/L、酶解pH 7.5、酶解温度55℃、底物质量浓度25 g/L。此时麦麸阿魏酸提取量为3.64×10-5mol/g。对试验得到的优化条件进行验证试验可知,优化工艺条件重复试验RSD为1.95%,均匀设计优化结果与试验最佳工艺结果基本吻合。
3) 经过分光光度计和HPLC法进行定性鉴别。麦麸酶解液的紫外光谱可见在325 nm存在较强的吸收峰,此结果显示其具酚酸特征结构;HPLC图谱显示其在16.362和19.066 min左右出现面积比例1∶10的检出峰,与标准品对照可知提取物为顺式阿魏酸和反式阿魏酸物。
近年来,阿魏酸的生理活性功能不断被研究证实,从麦麸中提取阿魏酸的工艺也具有重要的现实意义。在后续研究中,可通过优化食品原料中阿魏酸的提取工艺,利用阿魏酸及阿魏酸衍生物的抗氧化活性,将其应用在保健品、食品、化妆品行业中,为实现副产品资源的高效利用提供理论依据与参考。
