PEG 化羟甲基小白菊内酯抗肿瘤前药纳米颗粒的制备及性能
2020-06-03屈文豪杨全军颜德岳
屈文豪, 杨全军, 黄 平, 黄 卫, 颜德岳
(1. 上海交通大学化学化工学院,金属基复合材料国家重点实验室,上海 200240;2. 上海交通大学附属第六人民医院药剂科,上海 200233)
小白菊内酯(PTL)是从菊科植物中提取出来的一类倍半萜内酯天然产物,对乳腺癌、结肠癌和白血病等众多癌症具有良好的生物活性[1,2]。PTL 主要通过与核因子(NF-κB)、信号传导与转录激活子(STATs)、应激活化蛋白酶(JNK)等多种信号通路中的蛋白相互作用以及诱导细胞内活性氧簇(ROS)来调控细胞中的各类免疫应答反应[3-6]。小白菊内酯衍生物羟甲基小白菊内酯(MMB)的生物活性与小白菊内酯类似,可从洋玉兰的根皮中提取得到[7],也可在二氧化硒/过氧化叔丁醇(SeO2/tBuOOH)催化下由PTL 经氧化反应得到[8,9]。与PTL 相比,由于MMB 的C-14 位上引入一个伯羟基,故可对其进行进一步化学修饰,以提高其水溶性、生物利用度及靶向能力。例如,Yang 等[10]通过化学修饰,在MMB 的C-14 位点引入不同基团构建了一系列衍生物,其中部分衍生物显示出较高的抗癌活性。Janganati 等[11]合成了一系列MMB 的氨基甲酸酯和碳酸酯二聚体衍生物,可有效改善其水溶性,并评估了所得衍生物对血液肿瘤和实体肿瘤细胞(如结肠癌、乳腺癌、胶质细胞瘤等)的抗癌活性。上述化学修饰在一定程度上改善了MMB 的水溶性,部分衍生物的抗癌活性还有所提高,但仍属于小分子化合物,存在在人体内血液停留时间短、生物利用度低且选择性差等问题。
近年来,纳米药物载体的输送体系发展日新月异[12,13]。纳米药物载体在药物输送上具有独特的优势,通过实体瘤的高通透性和滞留效应(EPR),它们可被动靶向到肿瘤部位并富集[14,15],进一步通过胞吞的方式大量进入肿瘤细胞,释放出药物,发挥良好的治疗作用[16,17]。目前,已报道了大量基于纳米药物载体的药物输送体系[18-20],如:Chang 等[21]采用嵌段共聚物聚(乙二醇)-b-聚(ε-己内酯-co-γ-羟基-ε-己内酯)自组装负载化疗药物阿霉素,得到粒径为100~140 nm 的载药胶束,该胶束具有较高的载药量、良好的缓释作用和抗肿瘤活性;韩克等[18]设计了一类水溶性多糖并将其作为化疗药物多柔比星的载体,制得了聚电解质复合药物纳米颗粒,载药纳米颗粒的稳定性较高,细胞摄取显著增强。然而,大多数纳米药物载体不易通过美国食品药物管理局(FDA)的认证,临床应用困难。聚乙二醇(PEG)是目前FDA 批准的少数可用于人体的医用聚合物敷料,并已广泛应用于药物输送领域[22]。经PEG 修饰的小分子药物可自组装形成纳米颗粒,具有较长的体内循环时间、较小的生物毒性、较高的生物利用度和较好的治疗效果[23],如PEG 修饰的喜树碱、紫杉醇等纳米药物目前已进入临床试验阶段[24]。
本文采用PEG 对MMB 进行修饰,构建一类基于MMB 的前药纳米颗粒,详细研究思路如图1 所示。首先,在二环己基碳二亚胺/4-二甲氨基吡啶(DCC/DMAP)催化下,由MMB 与羧基聚乙二醇单甲醚(mPEG10-COOH)经一步酯化反应缩合得到两亲性前药mPEG10-MMB,然后在水中自组装形成mPEG10-MMB 前药纳米颗粒,当mPEG10-MMB 前药纳米颗粒进入肿瘤细胞后,在肿瘤细胞的酸性环境中,酯键降解并释放出MMB,从而有效杀死肿瘤细胞。
1 实验部分
1.1 原料和试剂
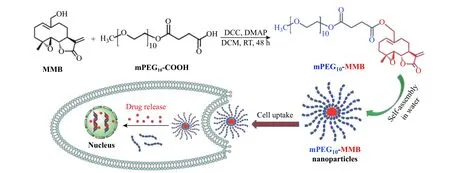
图 1 两亲性前药mPEG10-MMB 的合成、自组装及药物输送Fig. 1 Synthesis, self-assembly and drug delivery of amphiphilic mPEG10-MMB prodrug
4-二甲氨基吡啶(DMAP,纯度99%)、二环己基碳二亚胺(DCC,纯度99%)、尼罗红(NR,纯度99%):百灵威(J&K)试剂公司;3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(MTT):纯度99%,西格玛(Sigma)试剂公司;MMB:上海市第六人民医院药剂科提供;mPEG10-COOH:Mn= 550,Mw/Mn<1.05,上海炎怡生物科技有限公司;二氯甲烷(DCM):上海阿拉丁(Aladdin)生化科技股份有限公司;二甲基亚砜(DMSO)、无水硫酸钠:国药集团化学试剂有限公司;人宫颈癌细胞(HeLa 细胞):中国科学院上海生物科学研究所;胎牛血清(FBS)、杜尔贝科改良伊格尔(DMEM)培养基、磷酸盐缓冲液(PBS,pH = 7.4)、多聚甲醛:PAA 公司;透析袋:Mw= 1 000,绿鸟科技有限公司。
1.2 测试与表征
采用Varian 公司Mercury plus-400 型核磁共振波谱仪测试样品的核磁共振氢谱(1H-NMR),测试温度25 °C,溶剂CDCl3,内标三甲基硅烷(TMS);采用Waters 科技有限公司Q-TOF Premier 型超高分辨液相色谱-质谱(LC-MS)联用仪分析测试样品分子量,洗脱剂为乙腈-超纯水(体积比为1∶1);采用珀金埃尔默有限公司Lam UV-Vis 型紫外-可见分光光度计测试样品紫外吸收光谱,测试温度25 °C,扫描波长范围200~650 nm,速率为480 nm/min;采用英国马尔文仪器有限公司Zetasizer Nano ZS 型动态光散射(DLS)分析仪测试前药纳米颗粒粒径,测试温度25 °C,散射角90°;采用日本电子株式会社JEOL JEM-CX-II 透射电子显微镜(TEM)测试前药纳米颗粒形貌,加速电压为200 kV;采用美国BD 公司LSRFortessa 流式细胞仪记录细胞摄取数据;采用德国徕卡(Leica)公司TCS SP8 STED 3X 型活细胞超高分辨率多光子激光共聚焦显微镜(CLSM)拍摄前药纳米颗粒进入细胞图像。
1.3 mPEG10-MMB 两亲性前药的合成
mPEG10-MMB 两亲性前药由mPEG10-COOH 与MMB 通过酯化反应合成得到,具体制备过程如下:在50 mL单口圆底烧瓶中,依次加入mPEG10-COOH(208 mg,0.378 mmol)、DCC(93.6 mg,0.454 mmol)和10 mL 无水二氯甲烷,0 °C 下搅拌30 min 使固体全部溶解。然后,将5 mL 溶有MMB(50 mg,0.190 mmol)和DMAP(51.7 mg,0.423 mmol)的二氯甲烷溶液加入上述烧瓶中,室温下避光反应48 h 后,过滤除去白色沉淀,滤液用旋转蒸发仪除去有机溶剂得到固体粗产物。粗产物用二氯甲烷重新溶解、过滤并收集滤液。滤液用去离子水洗涤2 次,饱和NaHCO3溶液洗涤1 次,再用去离子水洗涤1 次,最后加入无水Na2SO4干燥过夜。过滤除去Na2SO4,收集有机层并浓缩得到固体。将固体溶于少量DMSO 中并转移至透析袋中,用去离子水透析24 h,透析液经冷冻干燥得到白色固体产物102.3 mg(产率43%)。1H-NMR(400 MHz,CDCl3)δ:6.24 (s,1H),6.24 (s,1H),5.57 (t,1H),4.70 (s,1H),4.49 (s,1H),4.25 (d,2H),3.85 (s,2H),3.64 (m,101H),3.56 (s,3H),3.38 (s,3H),2.85 (s,2H),2.64 (d,J = 14.3 Hz,5H),2.42 (m,2H),2.22 (s,7H),1.55 (s,4H),1.25 (s,16H),1.12 (s,4H),0.87 (s,2H)。
1.4 mPEG10-MMB 两亲性前药的自组装
称取5 mg mPEG10-MMB 溶于1 mL DMSO 中,采用微量注射泵以0.8 mL/h 滴加速率将该溶液缓慢滴加到4 mL 搅拌的超纯水中。滴加完毕后,将组装体溶液转移至透析袋中进行透析,每4 h 更换一次去离子水,共透析24 h。透析结束后,测得其组装体溶液体积为15 mL,质量浓度为0.33 mg/mL。
1.5 负载NR mPEG10-MMB 前药纳米颗粒的制备
将5 mg mPEG10-MMB 溶于1 mL DMSO 中,然后加入0.2 mL NR 质量浓度为0.4 mg/mL 的DMSO 溶液,室温振荡2 min。采用微量注射泵以0.8 mL/h 滴加速率将上述溶液缓慢滴加到4 mL 搅拌的超纯水中,滴加完毕后,将组装体溶液转移至透析袋中,用去离子水透析24 h,每4 h 换1 次去离子水。透析结束后,得到负载NR 的mPEG10-MMB 前药纳米颗粒溶液。
1.6 mPEG10-MMB 前药纳米颗粒临界胶束浓度的测定
mPEG10-MMB 前药在水中形成纳米颗粒的临界胶束浓度(CMC)采用尼罗红荧光探针法测定。将10 μL NR 的丙酮溶液(浓度为2 × 10−4mol/L)加入到1 mL 不同质量浓度的mPEG10-MMB 前药水溶液中,室温搅拌过夜,使丙酮完全挥发,NR 的终浓度为2 × 10−6mol/L,而mPEG10-MMB 前药的质量浓度为0.005~200 μg/mL。采用LS-50B 型荧光光谱仪测定不同浓度mPEG10-MMB 水溶液的荧光光谱,激发波长设为550 nm,光栅宽带为10 nm。记录不同mPEG10-MMB 前药浓度水溶液荧光光谱中NR 的最大荧光发射强度,并以最大荧光发射强度对mPEG10-MMB 前药的对数质量浓度作图,曲线拐点对应的质量浓度即为mPEG10-MMB 前药在水中的CMC。
1.7 mPEG10-MMB 前药纳米颗粒的细胞内摄
采用流式细胞仪和激光共聚焦显微镜检测HeLa 细胞对mPEG10-MMB 前药纳米颗粒的摄取情况。
流式细胞仪测试:将HeLa 细胞以每孔5.0 × 105个的密度铺在六孔板中,在CO2培养箱中孵育24 h。细胞贴壁后,去除培养基,加入2 mL 负载NR(NR 质量浓度为2.5 μg/mL)的mPEG10-MMB 前药纳米颗粒无血清DMEM 溶液,继续在CO2培养箱中分别孵育1、2、4 h 后,除去培养基,用冷PBS 洗涤3 次。使用胰蛋白酶消化细胞并收集于流式管中。采用BD LSRFortessa 流式细胞仪收集并分析门内1.0 × 104个细胞的荧光数据。
激光共聚焦显微镜测试:将直径为20 mm 的圆形盖玻片置于6 孔板中,然后将HeLa 细胞以每孔5.0 ×105个细胞的密度接种到6 孔板中。24 h 后,吸取培养基,加入1 mL 负载NR 的mPEG10-MMB 前药纳米颗粒无血清DMEM 溶液,纳米颗粒的浓度为30 μmol/L,继续培养4 h 后除去DMEM 培养基,用冷PBS 洗涤3 次,每次漂洗5 min,随后加入w=4%的多聚甲醛固定细胞,室温下避光30 min。细胞固定好后,吸去多聚甲醛,并用冷PBS 漂洗3 次。然后加入1 mL DAPI 染液(2 μg/mL),室温下避光染色10 min。染色结束后,除去DAPI染液,用冰PBS 洗涤3 次,每次5 min,最后再用超纯水漂洗1 遍。将一侧有细胞的盖玻片覆盖在滴有少量抗荧光淬灭剂的载玻片上固定,避光保存样品,采用激光共聚焦显微镜直接观察。
1.8 mPEG10-MMB 前药纳米颗粒的细胞毒性测试
通过MTT 法分别测定了mPEG10-MMB 前药纳米颗粒对正常细胞和肿瘤细胞的毒性。
选用大鼠正常肝细胞(BRL-3A)细胞株,研究mPEG10-MMB 前药纳米颗粒对正常细胞的毒性。首先将BRL-3A 细胞按每孔5 × 103个的密度,将正常细胞接种在96 孔板中,置于CO2体积分数为5%的37 °C 培养箱中培养24 h。细胞贴壁后,更换新的培养基,设定不同浓度梯度的mPEG10-MMB 前药纳米颗粒(0.1~100 μmol/L)溶液,细胞在培养箱中培养72 h。每个孔中加入20 μL MTT 的PBS 溶液(5 mg/mL)。避光培养4 h后,除去含有未反应MTT 的培养基,随后每孔中加入200 μL DMSO,振荡10 min 充分溶解蓝紫色结晶甲臜,用BIO-RAD Model 680 型酶标仪在490 nm 处测量每个孔的吸光度值,细胞存活率(SC)由以下公式计算得到:

公式中:As为实验组吸光度值(含有细胞的培养基,MTT,药物);Ab为空白对照组吸光度值(不含细胞和药物的培养基,MTT);Ac为阴性对照组吸光度值(含有细胞的培养基,MTT,没有加药)。其中,空白对照组细胞存活率设定为100%。
选用HeLa 细胞株,研究mPEG10-MMB 前药纳米颗粒对肿瘤细胞的毒性,具体操作步骤同上。
2 结果与讨论
2.1 两亲性前药mPEG10-MMB 的结构表征
MMB、mPEG10-COOH、mPEG10-MMB 的1H-NMR 谱图见图2。比较图2 的核磁共振氢谱可以看出,酯化反应产物中同时出现了原料mPEG10-COOH 和MMB 的特征峰,其中MMB 的羟基与mPEG10-COOH 的羧基反应形成酯键后,其临近亚甲基上质子信号峰的化学位移从4.14(1)移动到4.69(1'),而MMB 中双键的质子信号峰的化学位移仅从6.23(2)略微移动至6.24(2'),这是由于其远离酯化反应位点,故化学位移变化不明显。同时,化学位移在3.50~3.70 和3.33 分别属于mPEG10-COOH 中重复单元―CH2―CH2O―和末端单元―OCH3的特征信号峰(b+c)和(a),在mPEG10-MMB 的1H-NMR 谱图中也相应出现(b'+c')和(a'),且化学位移基本保持不变。可见,本文成功合成了mPEG10-MMB 前药。
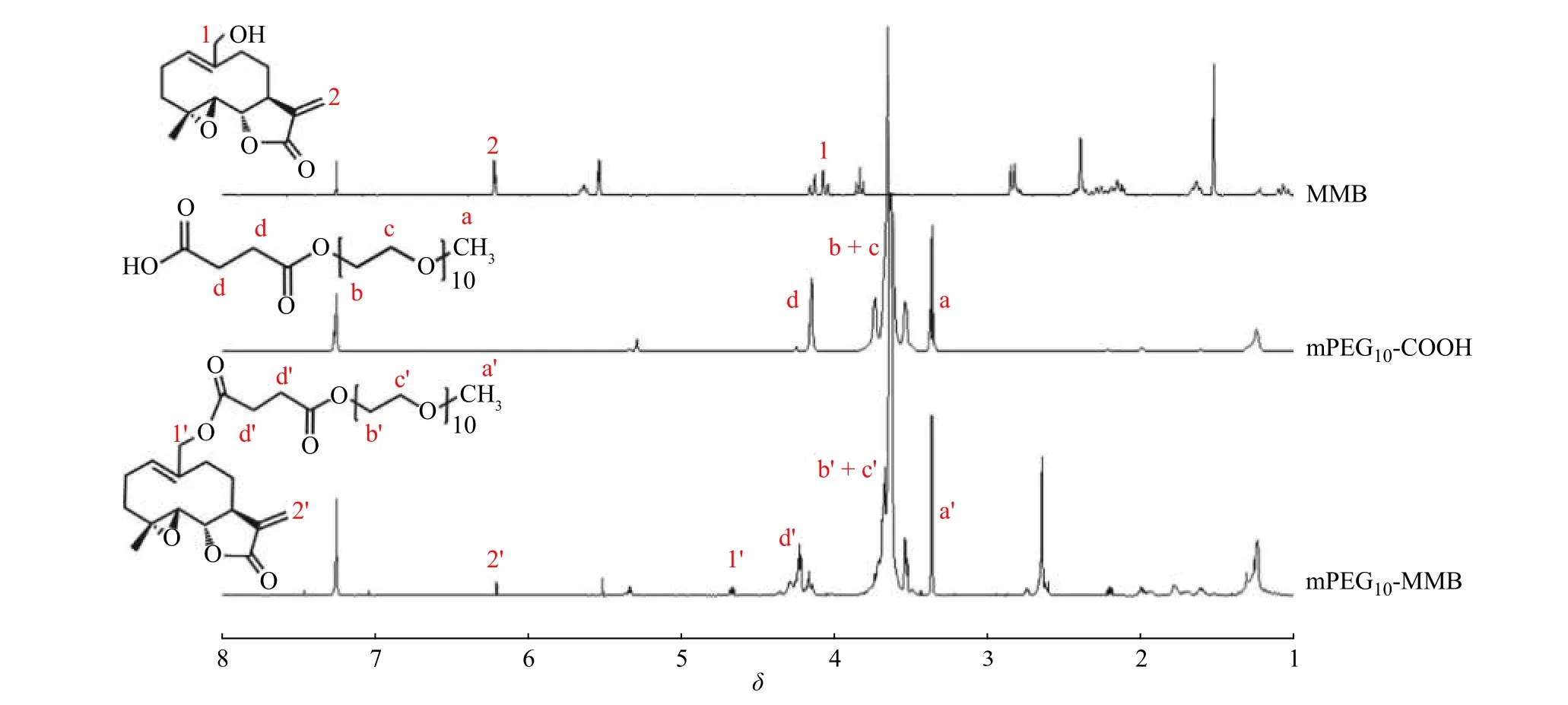
图 2 样品的1H-NMR 谱图Fig. 2 1H-NMR spectra of samples
两亲性前药mPEG10-MMB 以及原料mPEG10-COOH 的LC-MS 谱图如图3 所示。两者的LC-MS 谱图中均出现了一系列不同Mn信号峰和对应的保留时间,相邻的峰与峰之间Mn之差为44,与PEG 中重复单元(―CH2―CH2―O―)的分子量一致,说明mPEG10-COOH 的Mn存在一定分布。根据mPEG10-MMB 前药合成反应方程式,原料与产物数均分子量应满足如下关系:Mn(mPEG10-MMB)= Mn(mPEG10-COOH) + Mn(MMB) −18,即前药mPEG10-MMB 与原料mPEG10-COOH 的数均分子之差应接近MMB 的数均分子量264。从图3中对应的Mn信号峰可看出,mPEG10-MMB 的Mn比mPEG10-COOH 的Mn多出262.14,与上述理论公式的计算结果基本一致,进一步证明mPEG10-MMB 前药的成功合成。

图 3 mPEG10-COOH 和mPEG10-MMB 前药的LC-MS 谱图Fig. 3 LC-MS spectra of mPEG10-COOH and mPEG10-MMB prodrug
mPEG10-MMB 前药在乙腈溶液中的UV-Vis 光谱如图4 所示。从图中可以看出,原料MMB 的吸收峰位于226 nm 处,mPEG10-COOH 的吸收峰位于208 nm 处,而mPEG10-MMB 前药出现了两个吸收峰,分别位于286 nm 和206 nm 处,也从另一个角度证明mPEG10-MMB 前药的成功合成。
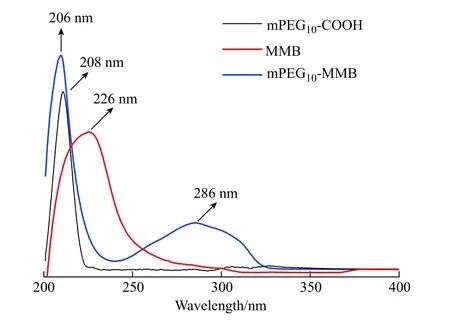
图 4 mPEG10-COOH、MMB 和mPEG10-MMB 前药的UV-Vis谱图Fig. 4 UV-Vis spectra of mPEG10-COOH, MMB and mPEG10-MMB prodrug (ρ (Sample) = 20 μg/mL)
2.2 mPEG10-MMB 前药纳米颗粒的粒径及形貌
分别采用DLS 和TEM 对mPEG10-MMB 前药在水中自组装得到的组装体的表征结果如图5 所示。从图5(a)的DLS 结果可以看出,mPEG10-MMB前药可在水中自组装形成平均粒径为120.3 nm,粒径分布为0.207 的聚集体。而从图5(b)的TEM 照片可以看出,mPEG10-MMB 前药在水中自组装形成的聚集体为平均粒径约108.5 nm 的球形纳米颗粒。TEM 测得的平均粒径比DLS 测得的小了约11.8 nm,这是由于TEM 测试中样品处于干态,而DLS 测试样品处于湿态所致。
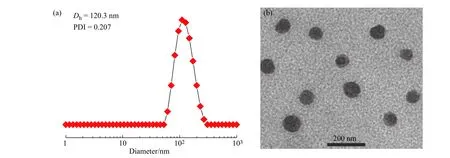
图 5 mPEG10-MMB 前药纳米颗粒的(a)DLS 曲线和(b)TEM 照片Fig. 5 (a) DLS curve and (b) TEM image of mPEG10-MMB prodrug nanoparticles
2.3 mPEG10-MMB 前药纳米颗粒的CMC
水溶液中NR 的最大荧光发射强度与mPEG10-MMB 前药质量浓度的关系如图6 所示。在550 nm的激发光下,当mPEG10-MMB 的质量浓度较低时,NR 的最大荧光发射强度较弱且几乎保持不变,说明只有少量的疏水性NR 分子分散在水相中。当mPEG10-MMB 前药质量浓度继续增加到某一特定值时,NR 的最大荧光发射强度突然增加,快速达到NR 分子完全处于疏水环境中的数值。NR 的最大荧光发射强度发生突变说明,mPEG10-MMB 前药在水中发生了微相分离,形成了一定的疏水微区(即自组装形成了胶束)。根据图6中曲线的拐点,可以得到mPEG10-MMB 前药的CMC 约为7.7 μg/mL。
2.4 mPEG10-MMB 前药纳米颗粒的细胞内摄
选用HeLa 细胞对mPEG10-MMB 前药纳米颗粒的细胞内摄情况进行研究。由于mPEG10-MMB 前药纳米颗粒自身没有荧光,故选用NR 作为荧光探针并将其负载到mPEG10-MMB 前药纳米颗粒中,然后与HeLa 细胞共同孵育指定时间并采用流式细胞仪进行分析,结果如图7 所示。从图中可以看出,HeLa 细胞内的NR 荧光强度随着孵育时间的增加而变强,这说明随着负载NR 的mPEG10-MMB 前药纳米颗粒与HeLa 细胞孵育时间的增加,越来越多的负载NR 的mPEG10-MMB 前药纳米颗粒进入HeLa 细胞内,导致其荧光强度增强。
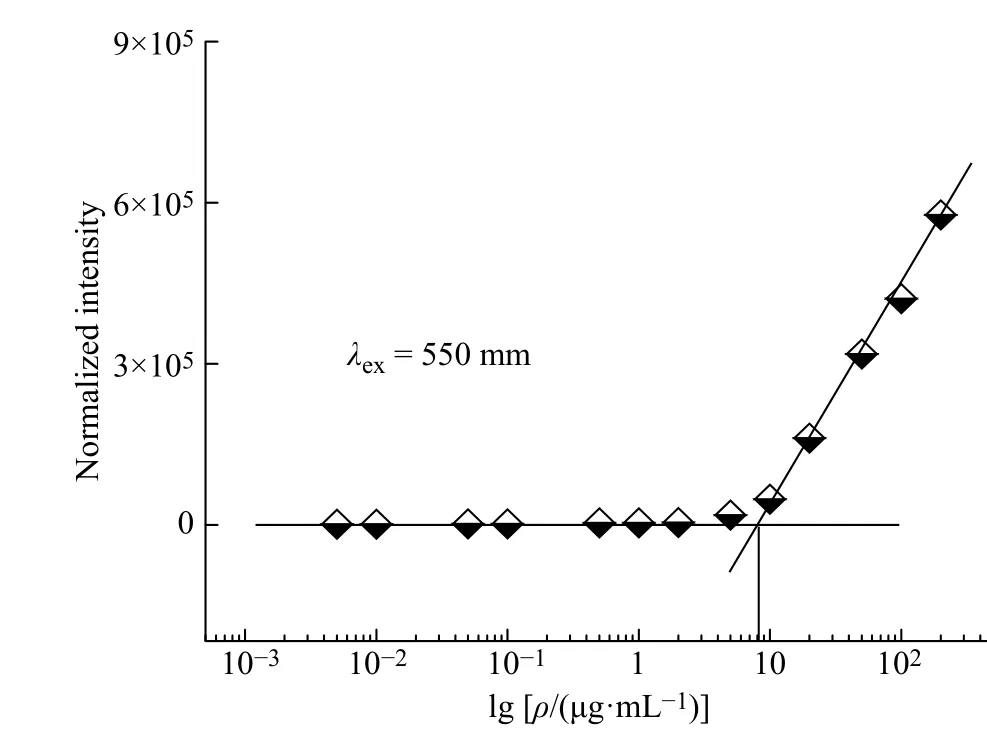
图 6 NR 的最大荧光发射强度与mPEG10-MMB 前药质量浓度的关系Fig. 6 Maximum emission intensity of NR versus the mass concentration of mPEG10-MMB

图 7 与封装NR 的mPEG10-MMB 前药纳米颗粒孵育不同时间后HeLa 细胞内的几何平均荧光强度(插图为未处理的(a)HeLa 细胞和(b)封装NR 的mPEG10-MMB 前药纳米颗粒培养4 h 后的Hela 细胞分别测得的流式细胞曲线)Fig. 7 Time-dependent profiles of NR-loaded mPEG10-MMB prodrug nanoparticles fluorescence intensity in HeLa cells(Insert: (a) representative flow cytometry histogram profiles of untreated Hela cells and (b) HeLa cells incubated with NRloaded mPEG10-MMB prodrug for 4 h)
Hela 细胞与负载NR 的mPEG10-MMB 前药纳米颗粒一起培养4 h,并用DAPI 对细胞核染色,然后进行CLSM 测试,结果如图8 所示(其中:微分干涉差(DIC)图为原始Hela 细胞照片,DAPI 图为染色的Hela 细胞核照片,NR 图为负载NR 的mPEG10-MMB 前药纳米颗粒与Hela 细胞共培养后的照片,叠加(Merge)图为DAPI 和NR 照片的叠加图)。从Merge 图中可以看出,负载NR 的mPEG10-MMB 前药纳米颗粒可被癌细胞有效摄取。流式细胞仪和CLSM 的测试结果都表明mPEG10-MMB 前药纳米颗粒能有效进入肿瘤细胞中。
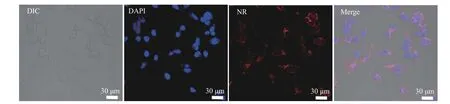
图 8 负载NR 的mPEG10-MMB 前药纳米颗粒与HeLa细胞培养4 h 的激光共聚焦显微镜照片(细胞核用DAPI 染色)Fig. 8 CLSM images of HeLa cells incubated with NR-loaded mPEG10-MMB prodrug nanoparticles for 4 h (Cell nuclei are stained with DAPI)
2.5 mPEG10-MMB 前药纳米颗粒的体外抗肿瘤活性
采用MTT 法评估了mPEG10-MMB 前药纳米颗粒对HeLa 细胞增殖的抑制效果。MTT 法又称MTT比色法,常用来检测细胞存活率和生长,其基本原理是活细胞线粒体中琥珀酸脱氢酶能将MTT 还原为水中不溶解的蓝紫色结晶甲瓒(Formazan)并沉积于细胞中,而死细胞却没有这种功能。用DMSO 溶解细胞中生成的甲瓒得到的蓝紫色溶液,其在490 nm 波长处有特征吸收,用酶联免疫检测仪测定该波长处的光吸收值,即可间接反映出活细胞的数量。在一定的细胞数量范围内,MTT 结晶形成的蓝紫色甲瓒量与活细胞数成正比。分别将MMB 和mPEG10-MMB 前药纳米颗粒与HeLa 细胞培养72 h 后,用MTT 法测得细胞毒性,结果如图9 所示。从图中可以看出,mPEG10-MMB 前药纳米颗粒对HeLa 细胞生长的抑制效果明显优于MMB,它们的半抑制浓度分别为13 μmol/L 和24 μmol/L,这是由于mPEG10-MMB 前药纳米颗粒具有被动靶向作用,可被癌细胞内吞并在癌细胞内富集,由于癌细胞内环境呈微酸性,促使mPEG10-MMB 前药中的酯键降解,释放出MMB,从而有效抑制肿瘤细胞的增殖。
2.6 mPEG10-MMB 前药纳米颗粒的细胞毒性
通过MTT 实验评价了mPEG10-MMB 前药纳米颗粒对BRL-3A 正常细胞的毒性。BRL-3A 正常细胞的存活率与mPEG10-MMB 前药纳米颗粒浓度的关系如图10 所示。随着mPEG10-MMB 纳米颗粒浓度的提高,BRL-3A 细胞的存活率虽有一定程度的下降,但相比于相同药物浓度下HeLa 肿瘤细胞的存活率,其仍要高出2 倍左右。例如当mPEG10-MMB 前药纳米颗粒浓度为100 μmol/L 时,BRL-3A 正常细胞的存活率约为60%,而HeLa 肿瘤细胞的存活率仅约为20%不到。由此可见,mPEG10-MMB 前药纳米颗粒在有效抑制肿瘤细胞的同时,对正常细胞毒性相对较低,具有潜在的临床应用前景。

图 9 MTT 法测得的MMB 和mPEG10-MMB 前药纳米颗粒对HeLa 细胞的细胞毒性Fig. 9 In vitro cytotoxicity of MMB and mPEG10-MMB prodrug nanoparticles to HeLa cells determined by MTT assay
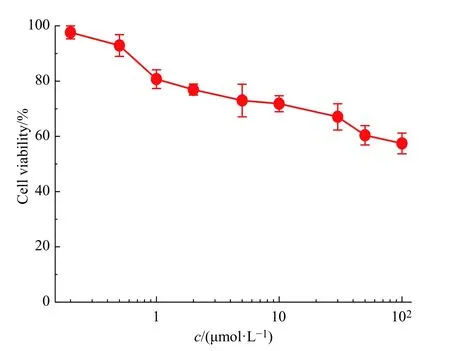
图 10 MTT 法测得mPEG10-MMB 前药纳米颗粒对BRL-3A细胞的细胞毒性Fig. 10 In vitro cytotoxicity of mPEG10-MMB prodrug nanoparticles to BRL-3A cells determined by MTT assay
3 结 论
(1)通过mPEG10-COOH 与MMB 之间的一步酯化反应偶联得到两亲性前药mPEG10-MMB。
(2)两亲性前药mPEG10-MMB 可在水中自组装形成纳米颗粒,可实现MMB 的被动靶向输送。
(3)mPEG10-MMB 前药纳米颗粒可通过内吞方式被肿瘤细胞摄取。
(4)与MMB 小分子药相比,mPEG10-MMB 前药纳米颗粒对HeLa 肿瘤细胞增殖具有更好的抑制作用,同时,对正常细胞的毒性相对较低。
