库仑滴定法测定钒电池电解液中钒(Ⅲ)与钒(Ⅳ)的含量
2020-06-03谷广娜王俊岭冯书晓马军营
谷广娜,王俊岭,冯书晓,马军营
(河南科技大学 化工与制药学院,洛阳471023)
钒电池是利用不同价态的钒离子在硫酸电解质溶液中发生氧化还原反应,实现化学能与电能之间的相互转换,从而具有大容量的快速充放电且功率和容量可调节等优点,被相关行业认为是最佳新能源储存介质[1-2]。该电池的容量和充放电效率,与电解液中不同价态的钒离子浓度有关,而该电解液中的钒离子的起始状态通常为钒(Ⅲ,V3+)和钒(Ⅵ,VO2+)混合态,当两种离子浓度的比值为1时,电池比容量达到最大[3-4],因此如何简便、快速且高效的测定V3+和VO2+的含量,对产品的质量控制意义重大。
目前,测定钒电池电解液中V3+和VO2+的分析方法主要有分光光度法、电位滴定法和电感耦合等离子体原子发射光谱法[5-7]。其中,分光光度法与电感耦合等离子体原子发射光谱法均存在标准样品获取较困难等缺点;电位滴定法则采用强氧化剂如:高锰酸钾、重铬酸钾等作为滴定剂,应用最为普遍,但操作较为繁琐,且滴定产物不稳定,易出现系统误差。
库仑滴定法是建立在控制电流电解基础上,可准确而灵敏地测定样品中常量、微量、半微量甚至痕量组分的电化学分析方法[8]。与其他分析方法相比,具有操作简便、分析快速和灵敏度高等优点,已被广泛应用于相关行业分析方法的研究中[9-12]。
本工作以重铬酸钾为氧化剂,硫酸铈为电解质溶液,采用库仑滴定法测定钒电池电解液中V3+和VO2+的含量,可为相关产品的质量研究提供参考依据。
1 试验部分
1.1 仪器与试剂
ZDJ-5型库仑滴定仪;工作电极对为两支自制的铂片电极(1 cm×1 cm);指示电极对分别为自制的铂片电极(2 cm×1 cm)与饱和甘汞电极;ME 104型电子天平;ZDJ-4A型自动电位滴定仪;S-210型pH酸度计。
重铬酸钾标准溶液:0.156 3 mol·L-1,将基准试剂重铬酸钾置于105℃恒温干燥箱中干燥2 h后冷却至室温,称取22.070 0 g,用水溶解并转移至500 mL容量瓶中,用水定容,混合均匀后备用。
高锰酸钾标准溶液:0.151 3 mol·L-1,称取11.85 g高锰酸钾溶解于500 mL水中,加热煮沸并保持微沸15 min,冷却于暗处放置后,过滤,贮存于棕色容量瓶中,标定后使用。
4种钒电解液样品购置于不同生产厂家;硫酸铈、二氧化钒和氯化钒均为分析纯;试验用水为蒸馏水。
1.2 试验方法
1.2.1 样品的前处理
移取适量的钒电池电解液于锥形瓶中,加入过量的重铬酸钾标准溶液后,并记录其体积,再加入3 mol·L-1磷酸溶液10 mL,搅拌均匀,即得待测样品溶液[3]。
1.2.2 库仑滴定法
向电解池内加入0.5 mol·L-1硫酸铈电解质溶液(pH为3.0)50 mL后,阴极区内分别放入铂片电解电极和指示电极对,阳极区内放入铂片对电极,阴极区和阳极区之间以饱和硫酸钾盐桥相连,设置电解电流强度为200.0 m A,加入1.0 mL待测样品溶液,采用电位法指示滴定至第二电位突跃后结束,平行测定6次,分别根据公式(1)和公式(2)计算样品中V3+与VO2+的浓度。
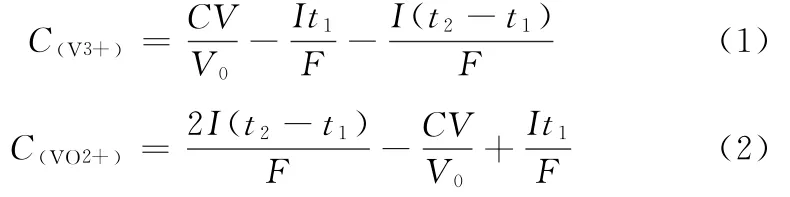
式中:C(VO2+)为样品中 VO2+的浓度,mol·L-1;C(V3+)为样品中V3+的浓度,mol·L-1;C为重铬酸钾标准溶液浓度,mol·L-1;V为重铬酸钾标准溶液体积,mL;V0为预处理后样品溶液的体积,mL;I为电解电流强度,m A;t1为滴定至第一电位突跃点时间,s;t2为滴定至第二电位突跃点时间,s;F为法拉第电解常数96 500,C·mol-1。
1.2.3 电位滴定法
按照文献[3]中的分析方法,利用自动电位滴定仪,采用高锰酸钾标准溶液滴定样品至第二电位突跃后结束,根据消耗的滴定剂体积,分别计算V3+与VO2+的浓度。
2 结果与讨论
2.1 电解质溶液的选择
2.1.1 浓度
已知酸性介质中不同离子的标准电极电位如下:φθ(Ce4+/Ce3+)=1.61 V,φθ(Cr2O72-/Cr3+)=1.33 V,φθ(VO+2/VO2+)=1.0 V,φθ(V3+/V2+)=-0.26 V,电解池阴极区内硫酸铈电解质溶液首先被还原生成滴定剂Ce3+,然后分别连续滴定样品溶液中剩余的Cr2O72-和 VO2+[13]。采用Cr2O72-氧化样品溶液中的V3+、VO2+为VO+2,其中,V3+与VO2+的浓度分别为0.712,0.726 mol·L-1,试验考察了电解质硫酸铈溶液的浓度分别为0.1,0.3,0.4,0.5,0.6,0.7,1.0 mol·L-1时对测定结果的影响,计算V3+与VO2+的测定值以及测定值的相对标准偏差(RSD),结果见表1。
由表1可知:当电解质硫酸铈溶液的浓度为0.5 mol·L-1时,V3+与 VO2+的回收率分别为99.6%,101%,且 V3+与 VO2+的 RSD 分 别 为1.0%,1.4%,说明方法具有较高的精密度,试验选择0.5 mol·L-1的硫酸铈溶液作为电解质溶液。
2.1.2 酸度
滴定还原产物V2+在低酸度溶液内稳定性较差,因此试验过程中需要通入氮气保护[14],试验考察了不同酸度的电解质硫酸铈溶液对V3+与VO2+测定结果的影响,其中V3+与VO2+的浓度分别为0.712,0.726 mol·L-1,计算 V3+与 VO2+的测定值以及测定值的RSD,结果见表2。
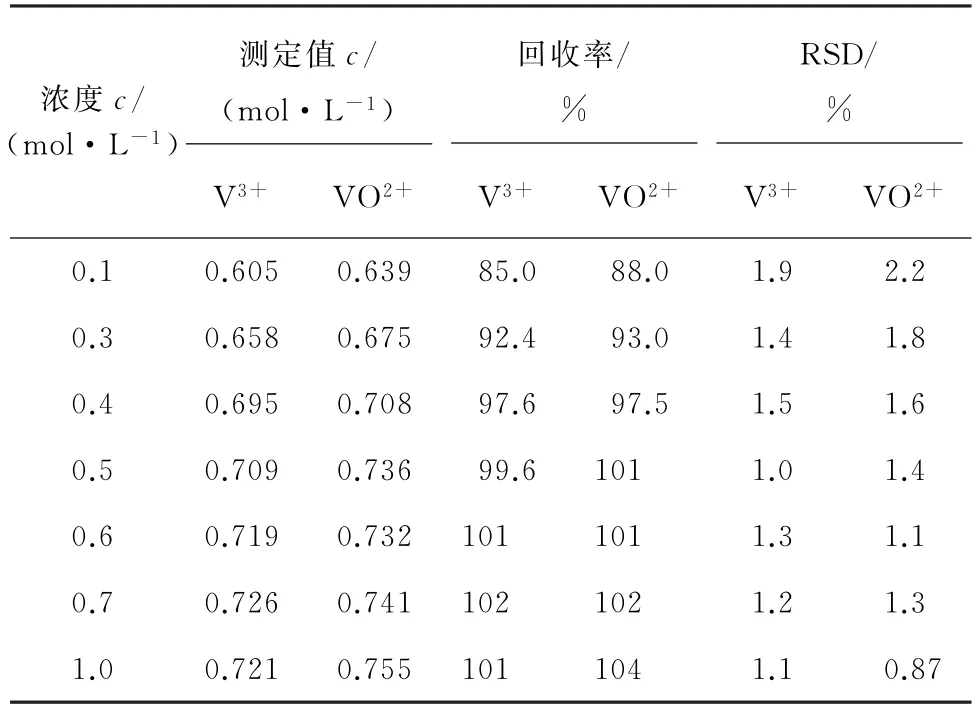
表1 电解质溶液的浓度对测定结果的影响(n=6)Tab.1 Effect of electrolyte solution concentration on determination results(n=6)

表2 电解质溶液的酸度对测定结果的影响(n=6)Tab.2 Effect of acidity of electrolyte solution on determination results(n=6)
由表2可知:当电解质硫酸铈溶液的pH为3.0时,V3+与VO2+回收率均接近99.0%,试验选择电解质硫酸铈溶液的pH为3.0。
2.2 滴定终点的确定
试验采用电位法确定库仑滴定终点,相关滴定曲线见图1。
由图1可知:该滴定曲线有两个明显的滴定突跃,其中区间908~815 m V内电位突跃对应Cr2O72-还原,区间710~550 m V内电位突跃对应VO2+还原,通过该滴定曲线一阶微商得到两个电位突跃点。

图1 库仑滴定曲线Fig.1 The curve of coulometric titration
2.3 样品溶液的稳定性试验
待测样品溶液中不同价态的钒离子均被Cr2O72-氧化至 VO2+,然而 VO2+在溶液中不稳定[15],试验考察了静置时间分别为0.5,1.0,2.0,4.0,6.0,12.0 h时样品溶液的稳定性,计算 V3+与VO2+的测定值以及测定值的RSD,结果见表3。
由表3可知:随着静置时间的延长,V3+与VO2+的测定值波动较大,在0~2.0 h内取样可保证V3+与VO2+的回收率为96.1%~105%,试验选择样品处理后须在2.0 h内完成检测。
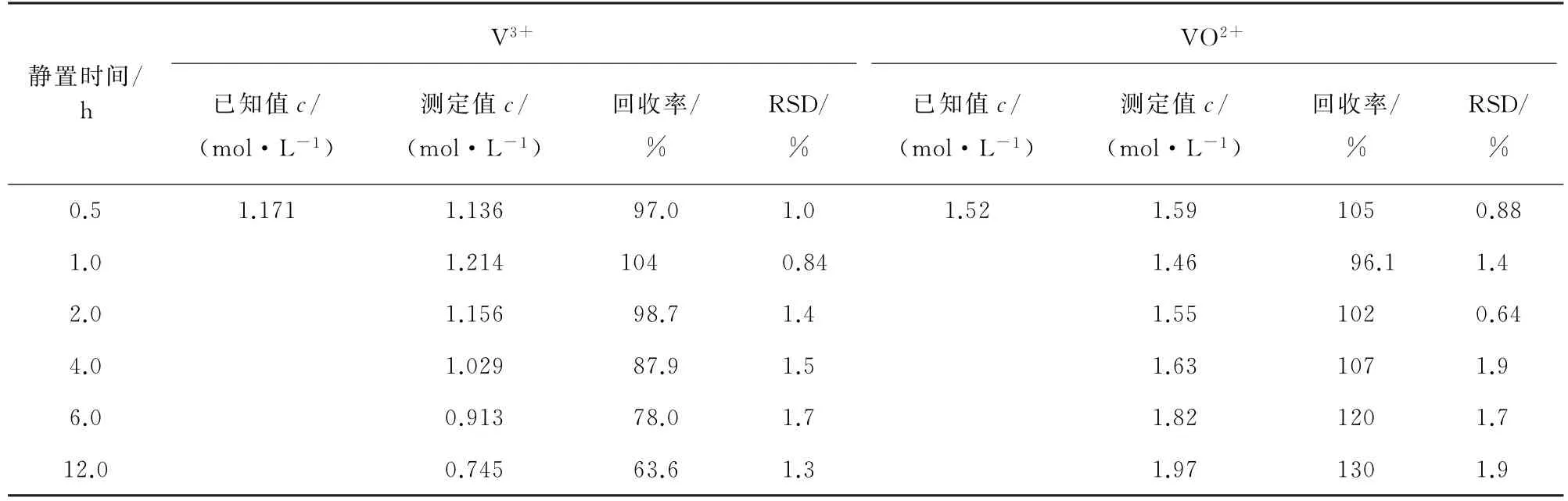
表3 样品溶液的稳定性试验结果(n=6)Tab.3 Results of test for stability of the sample solution(n=6)
2.4 方法比对
分别采用本法与电位滴定法测定样品1、样品2和样品3中V3+和VO2+的含量,每个样品平行测定6次,计算测定平均值和测定值的RSD,结果见表4。
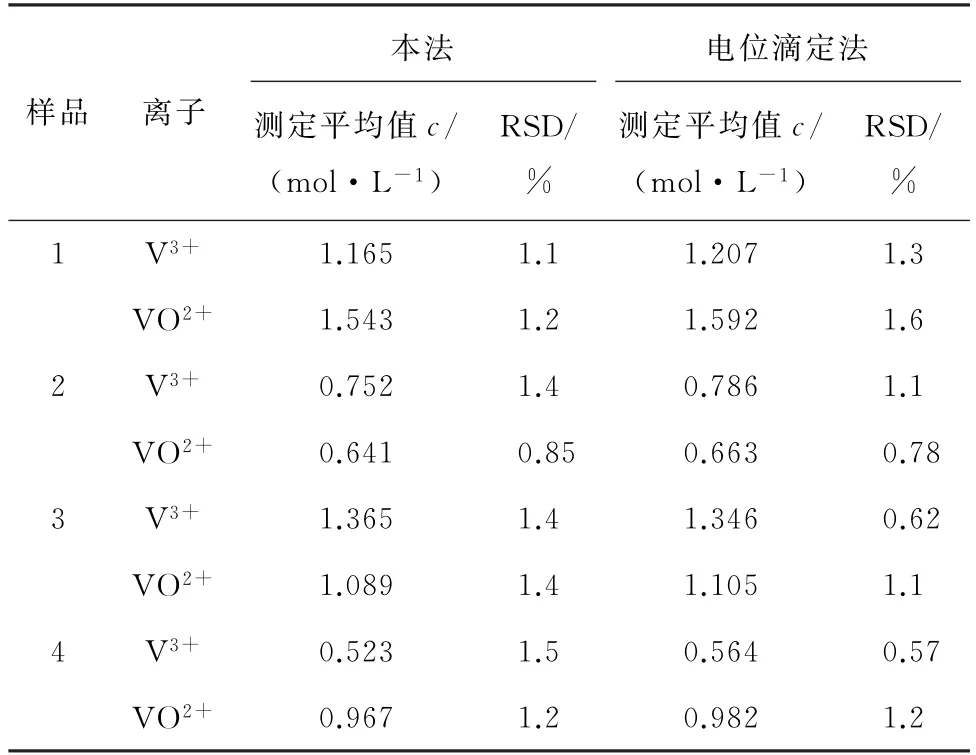
表4 不同分析方法测定结果比较(n=6)Tab.4 Comparison of the results found by different analysis methods(n=6)
由表4可知:本法的测定平均值与电位滴定法相近,且RSD均低于1.5%,说明方法精密度较高。
本工作提出了采用库仑滴定法测定钒电池电解液中V3+和VO2+的含量,与电位滴定法相比较,库仑滴定法测定步骤更加简便,无需提前配制和标定滴定溶液,且滴定产物稳定,从而可避免相关系统误差产生,使得测定结果的精密度与准确度更好,因此可满足相关行业的检测需求。
