海马体神经元内源性大麻素 I 型受体与小清蛋白共表达的研究
2020-06-03张钰林
张钰林 王 枫
1(中国科学院深圳先进技术研究院 深圳 518055)
2(中国科学院大学 北京 100049)
1 引 言
内源性大麻素系统(Endocannabinoid System,ECS)广泛分布于中枢神经系统,在疼痛、运动功能、麻醉与觉醒、学习记忆和情绪情感以及神经发生等生理过程和行为中发挥着重要的调控作用[1-7]。ECS 由内源性大麻素(Endocannabinoids)、大麻素 I 型受体(Cannabinoid Receptor 1,CB1R)、大麻素 II 型受体(Cannabinoid Receptor 2)、合成酶、代谢酶及转运体组成[7-8]。其中,内源性大麻素主要包括花生四烯酸乙醇胺(Anandamide)和 2-花生酰基甘油(2-Arachidonoylglycerol),作为一种逆行作用的神经递质,与突触前膜上的 CB1R 结合后,对该突触发挥调控作用。CB1R 广泛位于与焦虑、恐惧和应激等相关的大脑区域中,调控神经递质释放,并作为大麻素治疗神经系统疾病的主要潜在靶点[9]。外周神经系统中也少量表达 CB1R,它们分散地表达在神经肌肉接头处[10]。
大量的研究表明,斑马鱼、啮齿类动物、狗、非人灵长类动物以及人类的脑内都分布着大量的 CB1R[11-12]。作为神经系统中最为丰富的 G 蛋白耦联受体[13-14],CB1R 参与调节多种脑生理过程。通过放射自显影术、免疫组织化学和原位杂交等方法,CB1R 在大脑中的解剖学分布已被广泛研究。脑内的 CB1R 主要表达在大脑皮层、基底神经节、海马体、杏仁核、丘脑和下丘脑,以及大脑脚、脑桥核、中脑导水管周围灰质和小脑皮层等结构中[12,15-18]。但 CB1R 的表达具有脑区特异性,如在前脑分布相对密集,而在后脑分布则相对稀疏[18]。其中,在海马体、纹状体和黑质中的神经元以及小脑皮质中的蒲肯野细胞(Purkinje Cell)上的表达丰度最高,嗅球、扣带皮层、内嗅皮层和梨状皮层,以及杏仁核和伏隔核次之,而在丘脑和下丘脑神经元上的表达则很低。CB1R 的这种差异性分布模式可能与大麻素对学习与记忆、情绪与认知,以及运动控制等的调节作用有关[19],也可能为预测和治疗与 ECS 相关的神经和心理疾病提供帮助。比如,大麻素激活海马体胶质细胞上的 CB1R,使 CA3-CA1 兴奋性突触发生长时程抑制,进而导致工作记忆损伤[20]。海马体 γ-氨基丁酸(γ-Aminobutyric Acid,GABA)能神经元上的 CB1R 则直接参与了低显著性线索相关的联想型学习[21]。中脑导水管周围灰质、延髓以及脊髓后角上的 CB1R 介导了疼痛信号的传递[22],且 CB1R 与神经病理性疼痛导致的抑郁症状也存在相关性[23]。此外,本文作者课题组研究发现 CB1R 阳性细胞在小鼠的眶额皮层、岛叶皮层、次级视觉皮层、纹状体、穹窿和背侧下丘脑等脑结构中的分布呈现雌雄差异特征[24]。综上,探究 ECS 结构和功能及其性别差异有助于开发和完善大麻素对神经精神疾病的精准治疗方式。
ECS 发挥调控作用时往往与其他神经递质在结构和功能上相互作用。在成年斑马鱼[25-26]和小鼠[27]大脑中,食欲素 I 型和 II 型受体与 CB1R 广泛共表达在同一神经元上,参与复杂的大脑功能,如疼痛、摄食和睡眠-觉醒等[28-29]。灵长类动物的背外侧前额叶皮质中 91% 的 CB1R 阳性(CB1R+)神经元表达胆囊收缩素(Cholecystokinin,CCK),51% 的 CCK 阳性(CCK+)神经元表达 CB1R,CB1R+/CCK+神经元活动的改变则与精神分裂症患者的皮层网络振荡和工作记忆紊乱有关[30-32]。生长激素抑制素受体和 CB1R 共表达在大脑皮层、纹状体和海马体神经元上,二者相互作用可降低大麻素产生的副作用,为改善药物滥用提供了新的可能性[33-34]。CB1R 在 GABA 能和谷氨酸能神经元上的平衡被破坏与亨廷顿式舞蹈症有关[35]。其他研究表明皮层和海马体中的 CB1R 神经元与多巴胺神经元和 5-羟色胺神经元都存在共标[36-38]。上述研究证实,CB1R 与中枢神经系统中许多常见的神经递质,如 CCK、GABA、多巴胺、谷氨酸、5-羟色胺、生长激素抑制素、食欲素等的受体存在共表达,提示 ECS 参与调节这些神经递质的释放。中枢神经系统中还存在一类重要的抑制性神经元——小清蛋白(Parvalbumin,PV)神经元。PV 神经元是脑内最多且最重要的中间神经元,约占中间神经元总数的 40%,大量分布在皮层和皮层下结构中,呈现篮状或吊灯样形态,放电频率高且强烈,广泛投射到大脑其他区域[39],可特异性地发挥阻滞功能。如选择性地阻断海马体 PV 阳性(PV+)神经元的突触传递,则会干扰小鼠对熟悉动物和陌生动物的辨别,扰乱了社交记忆的提取[40]。而激活小鼠上丘中的 PV+神经元可诱发本能防御反应,形成恐惧记忆,重复激活这些神经元则可引起抑郁样行为[41]。PV 神经元还在神经发生、多感觉注意、情绪认知、新物体识别等方面发挥重要调控作用[39,42]。然而,当前却鲜有 PV 神经元是否与 CB1R 神经元共标的相关报道[43-44]。
为此,本研究围绕中枢神经系统中 CB1R 是否与 PV 共表达这一问题展开。通过构建带有绿色荧光报告蛋白的 CB1R-iCre-EGFP 转基因小鼠,借助免疫荧光染色和激光共聚焦显微成像技术,在小鼠的背侧和腹侧 CA1、CA2、CA3 以及齿状回(Dentate Gyrus,DG)中发现少量神经元同时表达 PV 和 CB1R,且这些 PV+/CB1R+神经元在上述脑区中的分布密度和比例未见雌雄差异。本研究从定性和定量的角度证明小鼠海马体神经元存在 CB1R 和 PV 共表达,该结果为进一步阐明 CB1R 和 PV 在结构和功能上的相互作用提供一定参考价值,也将有助于更全面地了解 ECS 在中枢神经系统中的调控作用。
2 材料与方法
2.1 动物
实验动物采用 CB1R-iCre-EGFP 转基因动物,来源于中国科学院深圳先进技术研究院,由纯合的 CB1R-iCre-EGFP 小鼠与野生型 C57BL/6J 小鼠杂交得到。实验所用雌雄小鼠各 6 只,年龄为 8~12 周,其中雌鼠体重 20~22 g、雄鼠体重 25~28 g。小鼠饲养在无特定病原体的屏障环境内,光照/黑暗周期为 12 h/12 h,相对湿度为 40%~70%,光照强度为 15~20 lx。饲养期间,提供给小鼠充足的食物和水,每周更换新垫料,保证其生活环境健康舒适。实验动物方案经由中国科学院深圳先进技术研究院动物伦理委员会审查(SIAT-IRB-170314-NS-WLP-A0345)通过。
2.2 样品采集
2.2.1 溶液的准备
准备及配制实验所需的各种溶液,包括磷酸缓冲液(Phosphate Buffer Solution,PBS)、4% 多聚甲醛溶液、30% 蔗糖溶液、1% 戊巴比妥钠溶液等。具体地,PBS 溶液配制:将 PBS 缓冲液粉剂(武汉博士德生物工程有限公司)溶解于去离子水中,调节 pH 为 7.2~7.4。4% 多聚甲醛溶液(武汉博士德生物工程有限公司)保存于-20 ℃ 冰箱中,实验前解冻备用。30% 蔗糖溶液配制:将分析纯的蔗糖粉末(上海凌峰化学试剂有限公司),按照 30% 的质量与体积比,溶解于 PBS 缓冲液中,保存于 4 ℃ 冰箱中。1% 戊巴比妥钠溶液配制:将戊巴比妥钠粉末,按照 1% 的质量与体积比,溶解于 0.9% 氯化钠注射液(江西科伦药业有限公司)中,于室温条件下保存。
2.2.2 灌注及组织固定
用 1% 戊巴比妥钠溶液麻醉小鼠,麻醉剂量标准为 0.1 mL/10 g 体重。待小鼠深度麻醉后,将其腹部朝上固定在实验台上,用手术剪剪开腹腔和胸腔,并用止血钳外翻胸部组织,使心脏充分暴露,然后小心地去除心脏表面的筋膜。接着将注射针小心地插入左心室心尖,用剪刀快速地剪开右心耳,打开蠕动泵,使 PBS 溶液进入小鼠的体液循环(15 mL/min),以排除全身的血液。其中,血液排尽的标准为小鼠肝脏由暗红色变为乳白色。而后,迅速将蠕动泵的溶液更换为 4% 多聚甲醛,每只小鼠灌注 10~12 mL 4% 多聚甲醛溶液,可初步固定脑组织。再用镊子剥出脑袋,放于装有 4% 多聚甲醛溶液的玻璃瓶中 1~2 天,以便充分固定。最后将 4% 多聚甲醛溶液更换为 30% 蔗糖溶液,使其脱水固定。其中,脱水的标准为,脑组织完全沉淀到瓶底,一般需要 2~3 天时间。
2.3 组织切片
脑组织完全固定后,放于塑料脑模具中,加入冰冻包埋剂(Opti-mum Cutting Temperature,OCT;Sigma)复合物,置于冰冻切片机(Leica CM1950)的冷冻室。待其凝固后,将组织固定在托盘上,前后左右调整位置,使脑组织切片的横截面与小鼠脑图谱上的结构基本一致。随后进行组织切片(厚度为 30 μm)。收集目标脑区的脑片,放于加有 PBS 溶液的 24 孔板中,于 4 ℃ 冰箱中保存。
2.4 免疫荧光染色与贴片
从雌雄小鼠脑组织切片中挑选出含有背侧和腹侧海马体的脑片,放于新的 24 孔板中,加入 PBS 溶液,置于室温摇床上(90 r/min)清洗脑片,共 3 次,每次 5 min。接着用吸管移除 24 孔板中的 PBS 溶液,加入第一抗体(一抗)进行孵育。其中,用于双染的一抗为兔源 Anti-GFP antibody (ab6556, Abcam)和鼠源 Anti-Parvalbumin antibody (MAB1572, Sigma-Aldrich),使用前采用免疫荧光抗体稀释液进行稀释,两者稀释比例均为 1∶500。免疫荧光抗体稀释液的配制方法如下:称量 0.03 g 叠氮化钠、0.25 g 角叉菜胶、5 g 胎牛血清白蛋白、量取0.3 mL 100%TritonX-100,放于滴瓶中,随后加入 PBS 缓冲液定容至 100 mL,保存于 4 ℃ 冰箱中。加入一抗孵育液后,将 24 孔板置于室温摇床上孵育 1 h,再更换到 4 ℃ 摇床上(90 r/min)孵育 24 h。然后移除一抗孵育液,用 PBS 溶液清洗脑片(方法同上)。加入用抗体稀释液稀释好的第二抗体(二抗)进行孵育。其中,用于双染的荧光二抗为 Goat anti-Rabbit 488(131416, Jackson Research)和 Goat anti-Mouse 594(ab150116, Abcam),两者稀释比例均为 1∶300。将加入荧光二抗的 24 孔板用锡箔纸包裹住,置于室温摇床上避光孵育 1.5~2 h。随后去除荧光二抗,滴加稀释比例为 1∶10 000 的 4', 6-二脒基-2-苯基吲哚(2-(4-Amidinophenyl)-6-indolecarbamidine dihydrochloride,DAPI)荧光染料,放于室温摇床上避光孵育 5 min。待孵育完成后,再次用 PBS 溶液清洗脑片(方法同上)。
用毛笔将脑片贴在载玻片上面,室温下避光风干后,滴加抗荧光衰减封片剂FluoromountTM(Sigma),并用盖玻片封片;待玻片完全干透后,放于玻片收纳盒,保存于 4 ℃冰箱中以备后续成像使用。
2.5 显微成像与细胞计数
利用高灵敏度共聚焦显微镜(LSM 880,Zeiss)对组织样品进行扫描成像,其中荧光信号通道选用 Alexa 594、488 和 DAPI,分别由 561 nm、493 nm 和 405 nm 的激发光激发。选择 10×物镜对背侧和腹侧海马整体范围成像,成像模式为 Tile-scan。采用 63×油镜分别对背侧海马体 CA1 (dorsal CA1,dCA1)、腹侧 CA1 (ventral CA1,vCA1)、背侧 CA2 (dorsal CA2,dCA2)、腹侧 CA2 (ventral CA2,vCA2)、背侧 CA3 (dorsal CA3,dCA3)、腹侧 CA3 (ventral CA3,vCA3),以及背侧 DG (dorsal DG,dDG)和腹侧 DG (ventral DG,vDG)进行局部成像。
从每只动物的样品中选择 3~4 张与 dCA1、vCA1、dCA2、vCA2、dCA3、vCA3 以及 dDG 和 vDG 亚区相对应的图像进行细胞计数。利用 ZEN(Zeiss)软件,在脑片上圈画出所需计数的目标区域,在 DAPI 标识的细胞核信号下,对该区域内所有的神经元计数;在 Alexa 488 通道下,对绿色信号计数,即为该区域内 CB1R+神经细胞数目;在 Alexa 594 通道下,对红色信号计数,即为该区域内 PV+神经细胞数目;在 Alexa 488 和 594 双通道下,对黄色信号计数,即为该区域内 PV+/CB1R+神经细胞数目。
2.6 统计与分析
采用 Microsoft Excel 2016 对单个样品的数据进行处理,计算出 dCA1、vCA1、dCA2、vCA2、dCA3、vCA3 以及 dDG 和 vDG 8 个脑区中 PV+、CB1R+和 PV+/CB1R+神经元的分布密度,以及 PV+/CB1R+神经元在 PV+和 CB1R+神经元中的比例。所有组内及组间数据的分析在 GraphPad Prism 7.0 软件中完成,以“平均值±标准误差”表示,采用单因素方差分析方法分别统计分析每类神经元在不同脑区中的分布密度和占比,以及雌雄数据之间的对比。
3 实验结果
3.1 PV+、CB1R+ 和 PV+/CB1R+ 神经元在海马体中的分布
研究报道小鼠背侧及腹侧 CA1、CA3 和 DG 上大量分布 PV+神经元[39],而 CA1、CA2、CA3 的锥体细胞层和 DG 分子层的神经元则表达较为丰富的 CB1R[15],然而 PV 与 CB1R 是否表达在同一神经元上并不清楚。为了更清楚地研究 PV+神经元和 CB1R+神经元在中枢神经系统中是否共表达,本文使用 Cre 重组酶依赖的条件性基因打靶策略(图 1),构建了以 CB1R 为启动子并使所有 CB1R+细胞均表达绿色荧光蛋白的转基因小鼠。
通过对小鼠海马体组织切片进行免疫荧光染色和激光共聚焦成像发现,背侧海马体中 CB1R(图 2(a)绿色荧光)和 PV(图 2(a)红色荧光)均有较高表达,且两者存在一定共标(图 2(a)黄色荧光)。对于腹侧海马体,结果与背侧海马体相似(图 2(b))。定量结果显示,背侧和腹侧海马体中除分布较多 PV+和 CB1R+神经元外,还表达有少量 PV+/CB1R+神经元(表 1)。整体来看,PV+/CB1R+神经元在 CA1 中的分布密度最高,CA2 和 CA3 次之,DG 中最低。这些结果提示,海马体中 CB1R+神经元与 PV+神经元存在共标。
3.2 CB1R+、PV+ 和 PV+/CB1R+ 神经元在 CA1、CA2、CA3 和 DG 中的分布

图 1 CB1R-iCre-EGFP 小鼠的基因表达载体结构示意图Fig. 1 Schematic diagram of gene expression vector of CB1R-iCre-EGFP transgenic mouse
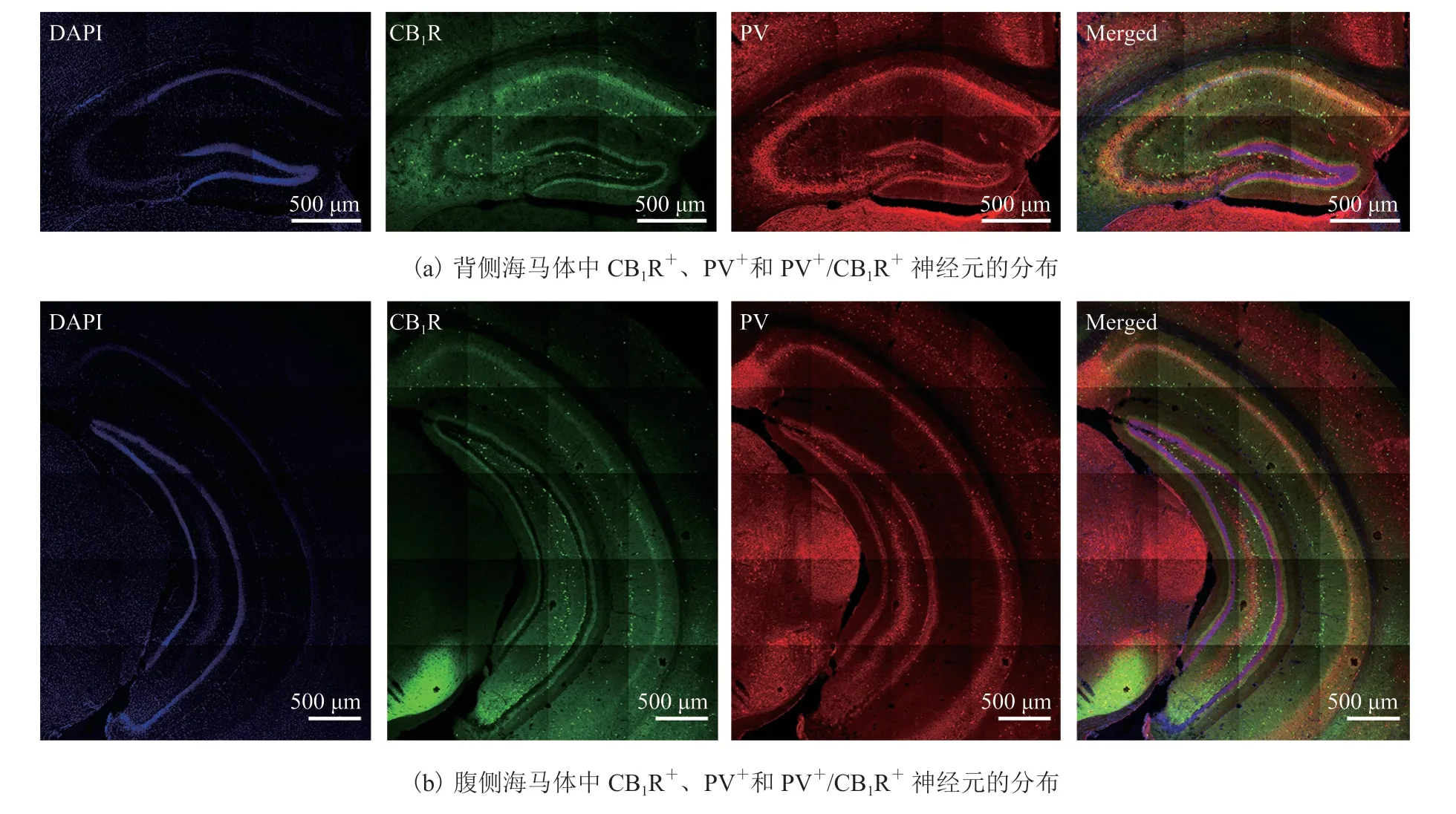
图 2 海马体中 CB1R+、PV+和 PV+/CB1R+ 神经元的分布Fig. 2 The distribution of CB1R+, PV+, and PV+/CB1R+ neurons within hippocampus

表 1 PV+、CB1R+ 和 PV+/CB1R+ 细胞在海马体中的分布Table 1 The distribution of PV+, CB1R+, and PV+/CB1R+ cells within the hippocampus
考虑到低倍镜下视野清晰度存在局限,为了进一步确认海马体 CB1R+神经元与 PV+神经元的共表达,选择分别对 CA1、CA2、CA3 和 DG 进行局部高倍成像。图 3(a-d)显示,高倍镜下可以清晰地观察到,海马体四个亚区中少量的 CB1R+神经元上表达有 PV。从神经元的分布密度来看,无论是雄鼠(图 3(e))还是雌鼠(图 3(g)),dCA1、vCA1、dCA2、vCA2、dCA3、vCA3、dDG 和 vDG 中均分布有少量 PV+/CB1R+神经元,其在 dCA1 中的分布密度最高,雌、雄分别为 153.48 cells/mm2和 207.60 cells/mm2;而在 dDG 中的分布密度较低,雌、雄分别为 50.32 cells/mm2和 59.47 cells/mm2。本研究进一步分析了 PV+/CB1R+神经元在海马体各亚区 PV+和 CB1R+神经元中的占比,发现雄鼠(图 3(f))和雌鼠(图 3(h))海马体 PV+/CB1R+神经元在 PV+和 CB1R+神经元中所占的比例无显著性差异。以上结果表明,海马体内存在少量 PV+/CB1R+神经元,即海马体部分神经元同时表达 PV 与 CB1R。
3.3 CB1R+、PV+ 和 PV+/CB1R+ 神经元在海马体中分布无雌雄差异
研究表明在发育过程中,性激素与 ECS 使大脑的结构和功能出现性别差异[45],导致男、女性在某些神经精神疾病的易感性和发病率方面表现不同[46]。CB1R 在发情期雌鼠前额叶皮层和杏仁核中的表达显著低于雄鼠[47]。然而,PV+、CB1R+和 PV+/CB1R+神经元在雌雄小鼠海马体中的表达及分布是否存在差异尚不清楚。基于此,本文分别统计了雌、雄小鼠 PV+、CB1R+和 PV+/CB1R+神经元在海马体中的分布密度。本文作者课题组前期的研究发现,大脑皮层、隔核、海马体、丘脑、下丘脑和脑桥等区域中 CB1R mRNA 表达水平在雌鼠不同生殖周期以及发情期与非发情期之间无显著性差异[24],因此本研究没有特意区分雌鼠的生殖周期。统计结果显示,dCA1、vCA1、dCA2、vCA2、dCA3、vCA3 以及 dDG 和 vDG 中 PV+(图 4(a))、CB1R+(图 4(b))和 PV+/CB1R+(图 4(c))神经元的表达密度均无雌雄差异。同样地,雌雄小鼠 PV+/CB1R+神经元在这些脑区的 CB1R+神经元(图 4(d))和 PV+神经元(图 4(e))中所占比例也无统计学差异。以上结果表明,PV+/CB1R+神经元在小鼠海马体中的分布无雌雄差异,这可能与 ECS 在进化上的保守性有关[13]。

图 3 CB1R+、PV+ 和 PV+/CB1R+ 神经元在 CA1、CA2、CA3 和 DG 中的分布Fig. 3 The distribution of CB1R+, PV+, and PV+/CB1R+ in the CA1, CA2, CA3, and DG
3.4 PV+/CB1R+ 神经元在 PV+ 和 CB1R+ 神经元中的占比

图 4 CB1R+、PV+ 和 PV+/CB1R+ 神经元在雌雄小鼠海马体中的分布对比Fig. 4 The comparison of distribution of CB1R+, PV+, and PV+/CB1R+ neurons in the hippocampus between male and female mouse
上述结果证实,小鼠背侧和腹侧 CA1、CA2、CA3 及 DG 中部分神经元共表达 PV 和 CB1R,且这些 PV+/CB1R+神经元在海马体中的分布无雌雄差异。那么,海马体 PV+/CB1R+神经元在 CB1R+和 PV+这两类神经元中所占的比例如何呢?为此,本文分别分析了小鼠海马体 PV 在 CB1R+神经元和 CB1R 在 PV+神经元中的比例。结果显示,dCA1、vCA1、dCA2、vCA2、dCA3、vCA3、dDG 和 vDG 中的 CB1R+神经元里都有少量表达 PV(图 5(a)),平均表达量为 6.04%,CB1R+神经元内 PV 的表达情况在这些脑区之间无统计差异(图 5(c))。同样地,以上脑区中 PV+神经元里也都表达有 CB1R(图 5(b)),平均表达量为 7.71%,且 PV+神经元内 CB1R 的表达情况在不同脑区之间无显著性差异(图 5(d))。该结果表明,PV+/CB1R+神经元在海马体中呈现均匀分布的特征。
4 讨 论
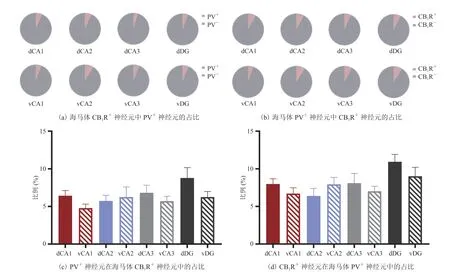
图 5 海马体 PV+/CB1R+ 神经元在 PV+ 和 CB1R+ 神经元中的占比Fig. 5 The ratio of the hippocampal PV+/CB1R+ neurons in PV+ and CB1R+ neurons
在哺乳动物中枢神经系统中,神经递质往往在结构和功能上相互作用,共同调节一系列生理过程和行为反应。其相互作用的方式之一就是这些信号分子的受体共表达在同一神经元上。例如,CB1R 分布在表达有 CCK、GABA、多巴胺、5-羟色胺、谷氨酸、食欲素和生长激素抑制素等递质受体的神经元末梢上,当其与配体结合后,抑制突触前膜的递质释放,参与调控疼痛、运动功能、麻醉与觉醒、学习记忆和情绪情感等。可以说,CB1R 在中枢神经系统中扮演着“刹车”的角色,防止神经元过度活跃。中枢神经系统中还有一类具有相似效应的中间神经元——PV 神经元。PV 神经元与其他亚型 GABA 能神经元在脑内分布和生理功能等方面往往表现出不同特征。例如,CCK+GABA 能神经元在海马体、内侧前额叶皮层和腹侧颞叶皮层等区域中高密度分布,放电模式温和,并表达有 5-羟色胺III 型受体,参与调节焦虑抑郁等情绪。而 PV+GABA 能神经元作为脑内最主要的抑制性神经元,广泛分布在皮层和皮层下结构中,呈现出高频快速放电模式,在伽玛振荡、神经发生、情绪认知、多感觉注意、新物体识别、习得性行为和社交记忆的提取与消除以及精神疾病等方面发挥着重要的调控作用。所以,进一步全面地认识 PV 神经元的结构和功能有助于我们更精准地理解上述各种生理和病理活动的发生机制。Pawelzik 等[43]发现 CA1 中一类篮状细胞表达 PV 和 μ-阿片肽受体,但不表达 CB1R、CCK 和 P 物质(Substance P)受体,而另一类篮状细胞表达 CB1R、CCK 和 P 物质受体,但不表达 PV 和 μ-阿片肽受体。Katona 等[48]在电子显微镜下观察到海马体 CCK+细胞的轴突末梢上分布有大量的 CB1R,而 PV+细胞的轴突末梢上未见 CB1R。上述研究结果表明,PV+GABA 能中间神经元几乎不表达 CB1R。由于之前的研究大部分都是在野生型小鼠上进行的,受标记 CB1R 技术手段的限制,CB1R+神经细胞的检测灵敏度达不到实际需求。在本研究中,通过构建 CB1R-iCre-EGFP 的转基因小鼠,所有表达 CB1R 的神经细胞被标记上绿色荧光蛋白,这有利于更容易地在 CB1R 神经元上观察到 PV 的表达。本研究分别从定性和定量的角度发现,小鼠海马体的部分神经元同时表达 PV 和 CB1R。此结果不但丰富了 CB1R+神经元的亚型,而且也可为证实 PV 与 CB1R 在功能上存在相互作用提供一定参考价值。
另外,大量研究表明许多精神疾病、情绪疾病以及行为障碍的发病率表现出性别差异。例如,雌性小鼠对与焦虑恐惧相关的情绪异常行为的易感性高于雄性小鼠,这与前额叶皮层 PV 神经元活动的性别差异有一定关系[49-50]。性激素与 ECS 在发育过程中使大脑产生功能和结构上的性别差异,这种差异则会影响癫痫发作的区域敏感性以及在大脑中的传播方式[45]。本文通过对组织切片进行免疫荧光染色和激光共聚焦成像发现,CB1R 在背侧和腹侧海马体中均有大量表达,且 CB1R+神经元在这些区域中的分布没有雌雄差异。本课题组前期的工作[24]也证实,小鼠运动皮层、内侧缰核、下丘、背侧海马体以及 vCA2、vCA3 和 vDG 中 CB1R mRNA 的表达量也无雌雄差异。所以,本研究所展示的 CB1R 分布特点与前期的研究结果基本一致。进一步地,本研究还发现 PV+/CB1R+神经元在小鼠海马体背侧和腹侧 CA1、CA2、CA3 和 DG 脑区中的分布密度和比例也无雌雄差异,这可能与 ECS 在进化上的保守性有关。这些结果共同填补了全脑 CB1R 表达及分布模式的性别差异的空白,并有助于进一步开发和完善以 CB1R 为靶点的神经精神类疾病的治疗方案。
然而,本研究仅根据分子生物学方法来确定神经元共表达,证据仍相对单薄。对于神经元分类以及共表达,最准确的方法应该是综合分子生物学、形态学、电生理以及单细胞测序等手段。鉴于 PV 神经元具有明显的吊灯样和篮状形态,以及具有快放电模式特征,可利用分子标志物标记 PV+并表达 CB1R 的神经元,再进行高分辨率光学显微镜或电子显微镜成像、电生理检测、神经递质检测以及单细胞测序,综合多个不同水平的结果来共同确定该 CB1R+神经元是否为 PV 神经元亚型。因此,未来的研究工作应该在跨尺度和多水平的层面上进行鉴别 CB1R 神经元的类型,这将为 CB1R 神经元分类提供一个更加准确和可靠的结果,也将有助于进一步探究内源性大麻素系统的精准调控作用。
5 结 论
本研究围绕中枢神经系统中 CB1R+神经元是否表达 PV 这一问题展开。通过构建带有绿色荧光报告蛋白的 CB1R-iCre-EGFP 转基因小鼠,并借助免疫荧光染色方法和激光共聚焦显微成像技术,结果显示小鼠的背侧和腹侧 CA1、CA2、CA3 及 DG 部分神经元存在 PV 和 CB1R 共表达,且这些 PV+/CB1R+神经元在以上脑区中的分布密度和比例无雌雄差异。本研究结果提示海马体中 PV 和 CB1R 在结构上存在相互作用,并可能为进一步阐明两者在功能上的相互作用提供一定参考价值,同时为两者在性别差异中的功能研究提供辅助证据。
