柑橘CCD基因家族鉴定及CcCCD4a对果肉颜色的影响
2020-06-03张亚飞彭洁朱延松杨胜男王旭赵婉彤江东
张亚飞,彭洁,朱延松,杨胜男,王旭,赵婉彤, 2,江东, 2
柑橘CCD基因家族鉴定及对果肉颜色的影响
张亚飞1,彭洁1,朱延松1,杨胜男1,王旭1,赵婉彤1, 2,江东1, 2
(1西南大学柑桔研究所,重庆 400712;2中国农业科学院柑桔研究所,重庆 400712)
【】研究类胡萝卜素裂解双加氧酶(CCD)基因家族在柑橘基因组中的分布、结构及进化,对在果肉颜色形成过程中的表达及其在不同果肉颜色的柑橘种质中的基因型进行研究,为开发用于果肉颜色的分子辅助育种标记奠定基础。根据已报道的CCD,采用同源比对法检索柑橘基因组中的CCD家族基因()。采用生物信息学软件构建系统进化树,进行亚细胞定位预测,预测蛋白质的相对分子质量与等电点(pI)等理化性质,预测保守motif,绘制家族基因Scaffold定位图。利用实时荧光定量PCR技术(qRT-PCR)分析在柑橘果实颜色发育过程中的表达模式,利用测序技术鉴定30个柑橘品种的基因型,采用Tassel软件进行单倍型分析。从克里曼丁橘()基因组中鉴定出14个CcCCD基因家族成员,可将其分为5个亚家族,即CcCCD1、CcCCD4、CcCCD7、CcCCD8和CcNCED。该家族蛋白理论等电点分布在6.05—8.53,编码氨基酸数目介于412—611个;亚细胞定位预测结果显示该基因家族成员主要位于叶绿体和细胞质中;聚类分析发现,CCD8亚家族与其他家族成员遗传距离较远,柑橘中各均能在其他物种中找到同源基因;Scaffold定位分析发现,14个CCD家族成员成员分布在除5号Scafflod外的所有Scafflod上,且分布不均匀。对10个柑橘品种在4个时期的果肉色泽进行表型鉴定,随着果实趋于成熟,果肉的色调角(h)逐步下降,果肉颜色逐步加深;在不同柑橘品种中相对表达量存在显著差异,果肉颜色为浓橙红色的品种表达量显著低于果肉为橙色或浅橙黄色的品种(<0.05),相对表达量与色调角呈显著正相关(<0.05);对30个柑橘品种进行测序分析,发现单倍型hap-1、hap-4和hap-5为果肉浓橙红色品种优势单倍型。‘克里曼丁’橘包含14个CCD基因家族成员,各成员均含有RPE65保守结构域,并定位于细胞的不同位置,分布在不同的Scaffold上。参与柑橘果肉颜色的形成,其基因相对表达量与果肉色调角呈显著正相关,可作为潜在的柑橘果实颜色的辅助育种标记,尤其是单倍型hap-1、hap-4、hap-5与果肉红色的关联度较高,对颜色育种的早期杂种群体筛选有一定帮助。
柑橘;CcCCD基因家族;;果肉颜色;基因表达;单倍型
0 引言
【研究意义】柑橘是世界范围内最重要的经济作物之一,其艳丽的果肉、果皮色泽是吸引消费者的重要因素之一,也是育种学家所关注的重要性状。已有研究表明,类胡萝卜素裂解双加氧酶(CCD)基因广泛参与果实颜色的调控[1]。利用生物信息学的方法对柑橘全基因组的CCD基因家族(CcCCD)进行全面分析,重点对在柑橘果肉颜色发育过程中的基因表达和不同果肉颜色柑橘种质中的基因型进行研究,对指导培育果肉为橙红色的柑橘品种具有重要意义。【前人研究进展】类胡萝卜素是一类在动植物中广泛存在的类异戊二烯色素。叶黄素(Xanthophylls)、紫黄质(Violaxanthin)是植物捕光蛋白复合物的关键组成部分[2],番茄红素(Lycopene)、-胡萝卜素(-carotene)等是影响植物花和果实颜色的重要色素[3-4],其含量高低决定了果肉色泽的深浅。高等植物中主要由类胡萝卜素裂解双加氧酶负责类胡萝卜素的氧化裂解,CCD是一类非血红素铁酶,均含有RPE65(Retinal pigment epithelial membrane protein)结构域,负责结合Fe2+[5]。根据其底物是否含有环氧结构,可将其进一步划分为类胡萝卜素裂解双加氧酶(CCDs)和9-顺式环氧类胡萝卜素双加氧酶(NCEDs)[6-7]。在拟南芥中共鉴定到9个CCD成员,其中4个CCDs成员(),5个NCEDs成员()。在9'-10'双键裂解C40类胡萝卜素,形成C13、C14小分子挥发性物质,对植物香气的形成具有重要影响[8-10]。和主要参与植物激素调节,其裂解产物是植物激素独角金内酯的重要前体[11-12]。以环氧类胡萝卜素为底物,是植物脱落酸(ABA)合成的限速酶,对植物抗逆性有重要作用[13-14]。成员较为复杂,在拟南芥、水稻、蔷薇等都只鉴定到了一个成员[1,7,15],而在番茄、葡萄、藏红花、菊花[16-19]等鉴定到了多个,目前证据表明其可能参与花、果皮、果肉颜色的形成,柑橘的底物为-隐黄质和玉米黄质,裂解位点在7'-8'双键,代谢产物为柑橘所特有的C30类胡萝卜素,使橘皮表现为橙红色[20-21]。ZHENG等[22]研究发现启动子上的一个MITE插入导致表达增强积累更多橙红色的C30类胡萝卜素。日本学者Minamikawa等[23]利用柑橘资源及杂种群体的全基因组关联分析,发现与果肉颜色性状强关联的1个SNP位于附近,暗示可能直接或间接影响柑橘果肉颜色的形成。CCD由于具有多种生物学功能,在调节植物的生长发育、非生物胁迫和颜色形成等方面具有重要作用,因此倍受研究者的关注。【本研究切入点】CCD基因家族广泛参与植物生长发育和果实颜色形成,但目前对CCD基因家族的研究主要集中在拟南芥、番茄、水稻等模式植物中,对柑橘CCD基因家族进行全基因组鉴定尚未见报道。可能参与调控柑橘果肉颜色的形成,但该基因在果实颜色形成过程中的表达与果肉颜色变化之间的关系尚不清楚,不同颜色柑橘品种的基因型也未有研究。【拟解决的关键问题】本研究对CcCCD基因家族成员进行鉴定,并对该家族的基本信息、Scafflod定位、系统进化等进行预测分析;同时,选择10个柑橘品种,利用qRT-PCR技术测定果肉色泽形成期在不同柑橘品种中的表达特征,同时通过对30个柑橘品种的基因型鉴定,为探究功能和开发基于的分子标记奠定基础。
1 材料与方法
1.1 柑橘CCD基因家族成员鉴定
柑橘‘克里曼丁’橘()基因组和蛋白组[24]数据下载自NCBI(https://www.ncbi.nlm. nih.gov/)。通过如下4种方法鉴定CcCCD家族成员:(1)下载RODRIGO等鉴定的5个[21](、、、、);(2)用柑橘中已鉴定到的5个和其他物种中已知的CCD家族基因(附表1)蛋白序列在克里曼丁橘蛋白质组数据库进行Blast搜索,获取柑橘中的同源序列;(3)在Pfam数据库(http://pfam.xfam.org/)中下载所有物种RPE65(PF03055)结构域序列,利用Hmmer2.3(http://hmmer.janelia.org/)构建隐马氏模型,在克里曼丁橘蛋白数据库中搜索含有RPE65结构域的序列;(4)合并(1)(2)(3)的结果,将得到的结果使用在线工具SMART(http://smart.embl- heidelberg.de/)分析结构域,去除不包含RPE65结构域的序列,最终得到CcCCD家族所有基因。
1.2 CcCCD家族生物信息学分析
对CcCCD蛋白的分子量和等电点使用ExPASy Proteomics Server(http://www.expasy.org/proteomics)进行预测。用在线软件MBC(http://cello.life.nctu.edu. tw)对CcCCD蛋白进行亚细胞定位预测。利用MEGA7(https://www.megasoftware.net/)中的MUSCL程序将鉴定到的CcCCD家族蛋白序列和其他物种的CCD家族蛋白进行多重序列比对,并利用近邻法(Neighbor- Joining,NJ)构建系统进化树(bootstrap=1 000)。柑橘中已有命名的名称不变,未命名的基因根据拟南芥中同源基因命名,没有同源基因的命名为,同一个亚家族内的基因根据染色体上的位置按照小写字母依次排序。用在线工具MEME(http://meme-suite.org/)鉴定各家族成员motif。在phytozome数据库(https://phytozome.jgi.doe.gov/)中下载CcCCD成员的注释信息,用GSDS (http://gsds. cbi.pku.edu.cn/)制作基因结构图。同时获取基因的位置信息,用在线工具MG2C(http://mg2c.iask.in/ mg2c_v1.1/)展示Scafflod定位图。
1.3 试验材料
本试验用于基因分型的30份柑橘种质资源均来源于国家果树种质重庆柑橘资源圃(具体信息见表1),除猴橙为甜橙外,大部分材料为宽皮柑橘及其杂种。2019年4月选取树势中等、树体健康的植株随机采集春梢叶片,液氮研磨后用于DNA提取。选取10株果肉色泽具有明显差异的柑橘植株,取果实进行基因表达分析(表1中编号1—10的材料),从果实转色期开始,每15 d采样一次(2019年9月28日、10月12日、10月27日、11月13日),直到充分转化为该品种固有色泽,拍照,进行色泽表型鉴定,取果肉液氮研磨用于RNA提取。
1.4 果肉色泽测定
取不同时期样品果实沿赤道面横切,使用CR-400色差计(柯尼卡美能达)记录各样品颜色信息。采用Lab模型描述所测得的颜色数据。根据测量得到的*、*值按照公式h=tan-1(b*/a*)获得色调角h,色调角h取值在0°—90°代表色泽介于红色与黄色,数值越小越偏向于红色,反之越偏向于黄色。本试验测定条件为:光源D65,标准观察角度2°,照明区域Φ50 mm。每个样品进行3次生物学试验重复,每次重复进行5次数据测定。
1.5 实时荧光定量PCR
使用RNAprep pure植物总RNA提取试剂盒(DP432,天根)提取植物总RNA。使用PrimeScriptTMRT Reagent Kit With gDNA Eraser Perfect Real Time(RR047,TaKaKa)试剂盒将RNA反转录成cDNA 供荧光定量使用。使用Prime3(https://primer3plus. com)设计引物,引物信息见表2。内参基因为柑橘,在CFX96 TouchTM荧光定量PCR仪上对在10个柑橘品种中不同时期的表达量进行分析。扩增体系含2 μL cDNA,上、下游引物各0.5 μL(10 μmol∙L-1),SYBR 6.25 μL,ddH2O 3.25 μL,总体系12.5 μL。反应程序为:95℃预变性30 s;95℃变性5 s,60℃退火30 s,95℃延伸15 s,40个循环,每个处理3次重复。以2ΔΔCt法计算相对表达量。
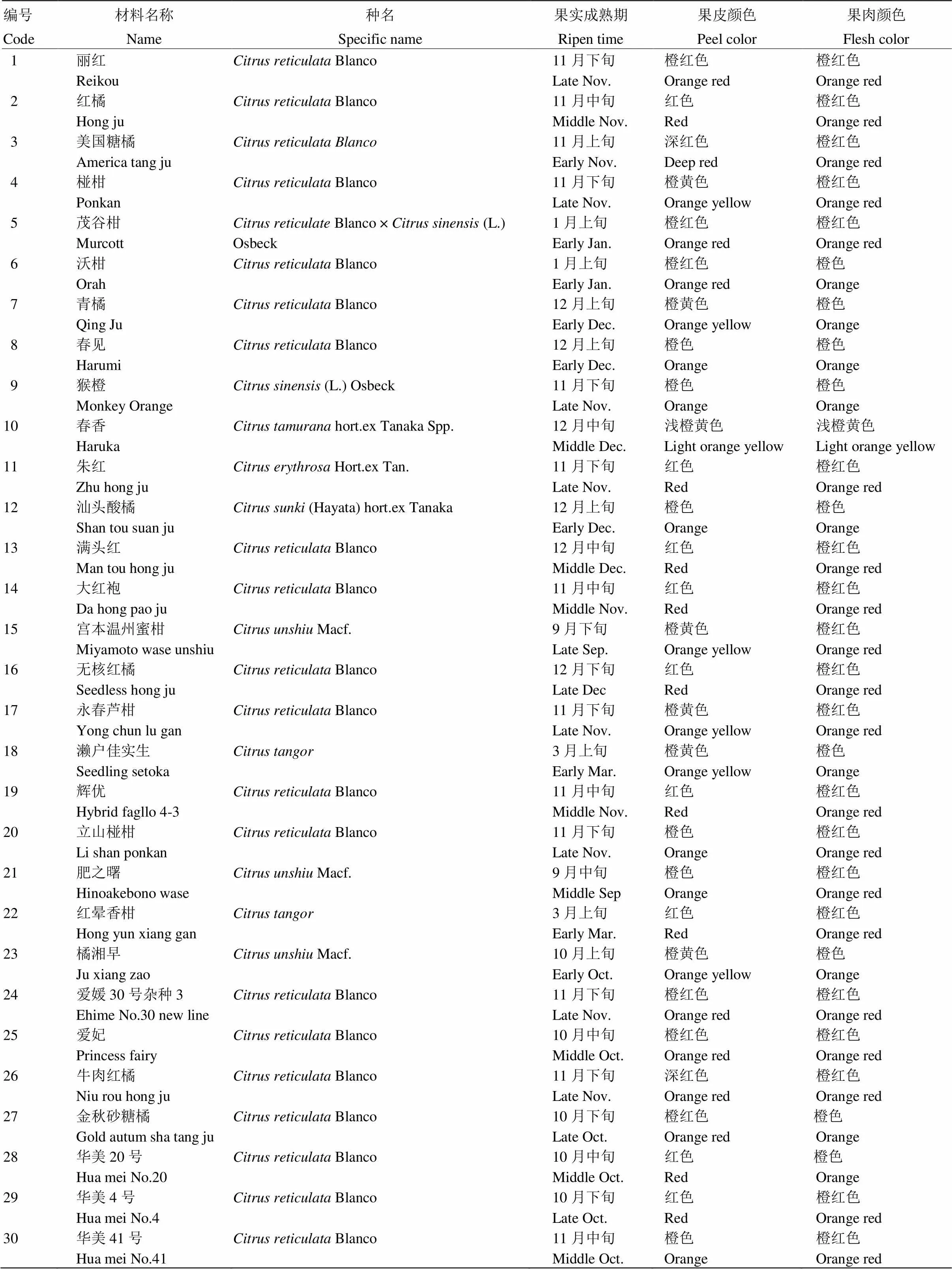
表1 本研究30份柑橘材料
1.6 基因型分析
取30份研磨后的叶片样品用CTAB小量法提取基因组DNA。根据NCBI上公布的克里曼丁橘基因组,使用Prime3设计引物,引物序列见表2。使用DNA小量回收试剂盒(Magen D2111-03)纯化PCR产物。1—10号纯化样品委托深圳华大基因有限公司进行Sanger测序,每个样品重复3次,使用DNAsp(http://www.ub.edu/dnasp/)软件分析核苷酸多态性。另外,所有纯化后的PCR产物稀释到10 ng∙µL-1,放入核酸超声打断仪(宁波新芝)中进行打断处理(10 s超声,5 s间歇;35个循环),使用二代测序建库试剂盒(天津诺禾),构建插入片段为300 bp左右的illumina二代双端测序文库,经稀释、变性后使用Illumina MiniSeq平台测定30个柑橘品种序列。测序结果经BWA(http://bio-bwa.sourceforge. net/)比对到‘克里曼丁’橘基因组,经Samtools(http:// www.htslib.org/)转换为bam文件后,再用Bcftools(http://www.htslib.org/doc/1.0/bcftools.html)检测核苷酸变异生成vcf(Variant call format)文件,vcf文件经Tassel软件(https://www.maizegenetics.net/tassel)分析编码区单倍型。
1.7 数据处理
利用SPSS18软件进行不同品种间基因表达差异的显著性分析,不同品种间色调角h差异显著性分析和色调角h与基因相对表达量的相关性分析。<0.05表示差异显著。
2 结果
2.1 CcCCD基因家族成员信息
通过Blast比对及Hmmer搜索,SMART分析去除不含REP65结构域的序列,从柑橘基因组中共鉴定出14个CCD基因,如表3所示。通过ExPASy工具分析,柑橘中最长的CCD蛋白(CcCCD_like)包含611个氨基酸,分子量为69.18 kD,是14个蛋白质中分子量最大的。最短的CCD蛋白(CcCCD4d)包含412个氨基酸,分子量是14个蛋白中最小的。等电点范围为6.05(CcCCD1b)—8.53(CcCCD4c)。利用MBC软件对CcCCD家族成员进行亚细胞定位分析,结果显示该基因家族成员位于细胞不同位置,其中定位于细胞质,其他成员定位于叶绿体。
2.2 CCD基因家族系统进化分析
为研究CCD基因家族的遗传进化关系,对已鉴定到的CCD家族基因进行系统进化分析,选取柑橘()(14个),拟南芥()(9个),水稻()(9个),番茄()(6个),葡萄()(7个),菊花()、猕猴桃()、藏红花()(各3个),欧洲越橘()、枸杞()、苹果()、突厥蔷薇()(各1个)共56个CCD蛋白(具体信息见附表1)构建系统进化树(图1)。根据亲缘关系可将56个CCD蛋白分为6个亚家族,分别为CCD1、CCD4、CCD7、CCD8、NCED、CCD_like。CCD8亚家族与其他CCD亚家族的遗传距离较远,CCD1、CCD4和NCED亚家族具有更近的遗传距离。

表2 引物信息

图1 CCD家族蛋白系统进化树
由于CcCCD_like序列不完整,系统进化分析不能很好的确定其所归属的亚家族,因此分析了CcCCD家族成员的motif。在CcCCD家族蛋白中使用MEME工具找到了10个motif,如图2所示。CcCCD_like含有5个motif(4、5、6、7、10),CcCCD8亚家族含有6个motif(3、4、5、6、7、10),与CcCCD8亚家族相比,CcCCD_like只缺少第3个motif。
2.3 CcCCD家族基因结构及染色体定位分析
利用GSDS软件对CcCCD家族各成员的基因结构进行分析(图3)。结果显示,CcCCD家族的基因结构存在较大的差异,外显子数目为1—13个,内含子数目为0—12个。对基因结构进一步分析发现,CcCCD4和CcNCED亚家族的基因结构较简单,除含2个内含子外,其他基因均不含内含子;CcCCD7和CcCCD8成员中多数基因含有3—6个内含子;而CcCCD1成员的基因结构较为复杂,内含子数目较多,、含有12个内含子,含有13个内含子。根据CcCCD家族在Scafflod的位置信息,利用MG2C工具获得了14个在柑橘Scafflod上的分布图(图4)。由图可知,CcCCD家族成员在Scafflod上分布不均。1号、4号、6号、8号Scafflod上分布较多,2号、3号、7号、9号Scafflod上,只含有1个CcCCD家族成员,而5号Scafflod上不含CcCCD家族成员。进一步分析发现,CcCCD在Scafflod上呈现区域性分布。

图2 柑橘CCD蛋白motif分析
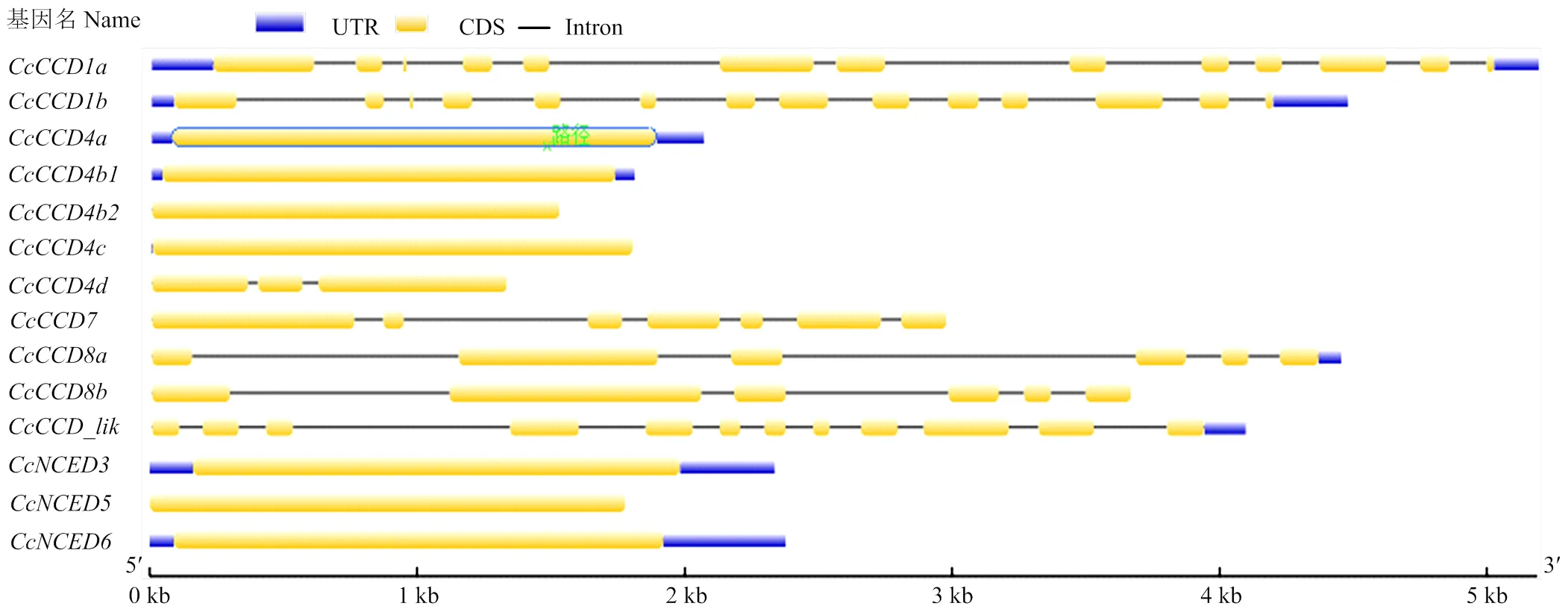
图3 柑橘CCD家族基因结构
2.4 果肉颜色表型分析
本试验将*、*两值换算为h值来表示果肉颜色。10个柑橘品种在4个时期中h值介于77.28°(11月13日,红橘)—100.80°(10月27日,春香),色泽介于橙红色与浅橙黄色(图5、图6),多数品种随着果实的成熟,h值不断下降,在10月27日至11月13日期间下降最明显。4个时期中橙色与浅橙黄色品种h值显著高于橙红色品种(图6)。橙红色品种中红橘色泽更深,在11月13日,其h值显著低于其他橙红色品种,‘丽红’在4个时期中h值下降缓慢,果肉色泽变化较小。橙色品种中‘青橘’的果肉色泽更为浓厚,其h值在最后一个时期也表现为显著低于其他橙色品种,‘春见’与‘猴橙’的h值在4个时期中始终保持较高水平,各时期果肉色泽差异不显著。浅橙黄色的‘春香’h值始终显著高于其他品种,在4个时期中差异不明显。

图4 柑橘CCD基因在 Scafflod 上的相对位置

图5 10个柑橘品种在4个时期的果肉色泽

不同小写字母表示在P<0.05水平差异显著。下同 Different lowercase letters indicate significant difference (P<0.05). The same as below
2.5 果实发育过程中CcCCD4a表达情况
在4个时期检测10个柑橘品种中的表达水平,结果如图7。在10个柑橘品种间的相对表达量差异较大,与9月27日‘红橘’相比,11月13日表达量最高的‘春香’达到52.40,而最低表达的‘丽红’仅为0.04。4个时期橙红色品种中‘茂谷柑’的表达量显著高于其他橙红色品种。橙色品种中‘猴橙’在第一个时期基因表达量显著低于其他橙色品种,而在后3个时期中显著高于其他橙色品种。浅橙黄色品种‘春香’始终保持较高水平表达,表达量显著高于其他品种。
10个品种除‘茂谷柑’外,均表现出在果肉偏红色的品种中趋于中低表达水平,在果肉偏黄色的品种中趋于高表达水平,推测该基因表达水平高低与果肉颜色具有相关性。以色调角h和相对表达量为随机变量进行相关分析,结果显示,随着时间的延长,表达量与色调角h的相关性逐步增强,在最后一个时期相关系数为0.532(<0.01),去除‘茂谷柑’后,相关系数为0.765(<0.01),呈极显著相关。
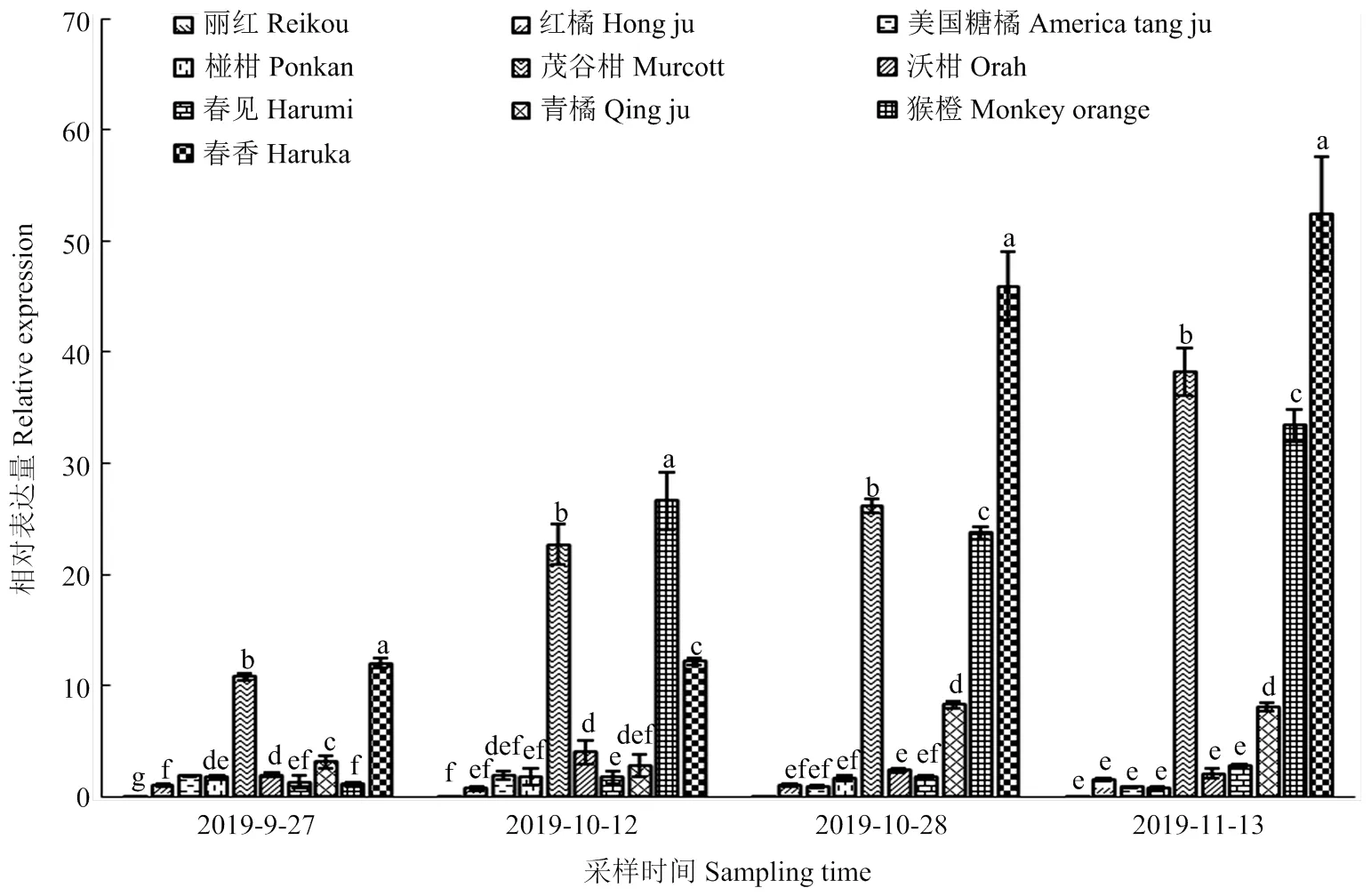
图7 CcCCD4a在10个柑橘品种4个时期的相对表达量
2.6 CcCCD4a核苷酸多态性与单倍型分析
除‘茂谷柑’外,其余品种均符合高表达果肉偏黄色,低表达偏红色的规律,为检测‘茂谷柑’在基因结构上与其他品种的差异,对所选10份材料进行Sanger测序分析其核苷酸多态性。在10个柑橘品种的编码区共鉴定到31个SNP位点(图8),其中同义突变17个,非同义突变14个,共有8个氨基酸突变位于RPE65结构域。‘茂谷柑’与‘克里曼丁’相比,所含有的SNP位点最多为21个,而‘椪柑’‘沃柑’最少。
‘茂谷柑’共有4个特有SNP位点,分别位于第294、913、1 137和1 657 bp。294和1 137 bp处为同义突变,其余两个为非同义突变且位于RPE65结构域上。913 bp变异导致第305位氨基酸由疏水性的丙氨酸突变为亲水性的苏氨酸,第1 657 bp处SNP导致第553位氨基酸由缬氨酸突变为异亮氨酸。
对10份柑橘材料的Sanger测序分析发现橙红色果肉的‘红橘’‘美国糖橘’具有完全相同的核苷酸序列(图8),推测该基因的单倍型可作为柑橘果肉颜色的检测标记。因此,重新采集20份果肉偏红色的材料(表1)与原来的10份材料一起构建二代测序文库,测定序列,用Tassel软件进行单倍型分析,分析结果见表4。30个柑橘品种的具有9种单倍型,其中包含hap-1的12个品种均为宽皮柑橘中典型的橘类品种,且果肉均为橙红色的品种,在这些品种中,个别还包含有hap-4、hap-5单倍型,其中以‘牛肉红橘’和‘美国糖橘’的果肉颜色为最深,这两份材料在162 bp处均为M,在669 bp处均为Y,而在669 bp处为Y的品种均表现为果皮红艳。包含有hap-2单倍型的品种为‘温州蜜柑’或是含有‘温州蜜柑’血缘的杂柑品种,果肉也多为橙色至橙红色。包含有hap-6单倍型的品种为典型杂柑类品种,果肉颜色通常为橙色至橙红色,hap-7和hap-8为橙色至浅橙黄色品种,具有甜橙类基因的渗入,hap-9只包含‘茂谷柑’,该品种也是天然的橘橙杂种,明显具有‘甜橙’基因的渗入。
3 讨论
CCD基因家族是一类具有RPE65结构域的基因家族,其所编码蛋白参与类胡萝卜素代谢途径,通过裂解C40类胡萝卜素产生衍生代谢产物。从酵母到人类,几乎所有真核生物都含有CCD,尤其是植物存在大量该类基因,如拟南芥基因组中存在9个[6],水稻中鉴定出11个[1],番茄中鉴定出9个[16],葡萄中鉴定到19个[17]。本研究从‘克里曼丁’基因组数据库中获得了14个CCD基因家族成员,与其他物种成员数不同,表明不同物种的CCD成员数存在差异,而这一差异主要表现在CCD4亚家族上,在拟南芥、水稻、马铃薯等颜色相对单一的植物中,一般只有1个,而在番茄、葡萄、藏红花、柑橘等颜色丰富且差异较大的植物中数目较多,这表明该基因在进化过程中可能存在基因扩增事件而通过选择得以保留。CcCCD基因家族的蛋白相对分子质量大小在45.86—69.18 kD,但大多数为65 kD左右,pI在5.98—8.53,表明CcCCD家族成员之间的蛋白质大小、pI等特征参数差异不大,这一结果与其他物种相似。motif分析显示与CcCCD8亚家族更为相似,推测属于CcCCD8亚家族。
本研究利用柑橘中的CCD家族成员与其他作物中报道的CCD家族成员进行系统演化分析,由于CCD基因的保守性,具有相似或者相同功能的基因常位于同一组,这为研究该基因家族相关基因的功能提供了重要依据。拟南芥中,与联合将-胡萝卜素转变为独角金内酯的前体己内酯,继而使植物生长发育[25],藏红花中、的表达通过影响独角金内酯的合成进而影响顶芽的分化[18],类似的在猕猴桃[26]、番茄[27]、水稻[28]等植物中,与参与了调控衰老、根的生长、分枝分蘖和花的发育等多种生命活动,由此推测柑橘CcCCD7、CcCCD8亚家族可能具有相同或相似的功能。NCED亚家族成员是ABA生物合成的限速酶,通过调节ABA的代谢,进而影响植物生命过程[29-30]。Kato等[31]曾在2006年通过Race扩增出柑橘与,通过重组蛋白表达发现与能在11'-12'位双键裂解紫黄质生成黄质醛(Xanthoxin),这与拟南芥相似,而本研究鉴定到的6与为同源基因,由此推测与具有相似的功能。
对类胡萝卜素的裂解与果肉、花器官的着色有关。过表达拟南芥的水稻中-胡萝卜素和叶黄素分别降低74%和72%,-紫罗酮增加了2倍[32]。功能的缺失也会造成果实、花器官颜色的改变,比如杜鹃花瓣由黄色褪为白色[33],洋橘梗浅黄色和白色花的形成[34],以及百合花由黄变白[35]等表型的改变和形成均由裂解类胡萝卜素功能改变所造成。不同于其他物种的在9'-10'双键裂解类胡萝卜素,柑橘中较为特殊,其裂解位置为7'-8'双键,产物为柑橘所特有的C30类胡萝卜素(-citraurin,-citraurinene等),其高表达诱导柑橘果皮变红[22]。由于在果实发育过程中表达量极低,在柑橘EST数据库(http://harvest.ucr.edu/)中缺乏EST序列,因此被认为是假基因[21];、多在花瓣中表达,在果皮、果肉中均未检测到[21],而前期的研究发现柑橘果肉颜色性状与附近的SNP位点存在显著的相关性[23],基于此研究结果,选择作为本研究的重点。
本研究结果表明,随着果实的成熟,果肉颜色逐步由浅色调向深色调过渡,h值逐渐降低,颜色逐步加深,涉及的10个品种在11月13日果肉颜色差异最为明显,其后尽管颜色还会趋于加深,但果肉色泽与11月13日相比均没有显著差异,因此,以11月13日作为采样最终时间。本试验测定了10个柑橘品种在4个时期的相对表达量和色调角h,发现在不同品种中的表达量与色调角h显著正相关,说明在一定范围内,高表达使果肉颜色偏向于更淡,低表达使果肉颜色偏向于更红。这一结果与ZHENG等[22]关于的研究相反,该作者认为使果皮表现为红色的色素主要是高含量的C30类胡萝卜素,如-柠乌素(-citraurin)和-香茅素(-citronella)等,而MA[36]和AGÓCS[37]等认为果肉表现的橙红色多由C40类胡萝卜素含量决定,如在橙红色的‘温州蜜柑’和‘丽红’果肉中含有大量的-隐黄质等C40类胡萝卜素。在其他物种中,同源基因功能的研究与本试验更为相似,比如葡萄中的底物为红色的番茄红素,产物为浅橙色的6-甲基-5-庚烯-2-酮[17];西葫芦中在含低类胡萝卜素的种质中高表达,在高类胡萝卜素的种质中低表达[38];RNA干扰(RNAi)菊花中的表达,使白色菊花转变为黄色[18];桃中通过病毒诱导的基因沉默(VIGS)抑制白肉桃表达,结果在白肉桃中诱导出了黄色[39],白色矮牵牛编码区一段226 bp的MITE插入终止了的转录形成黄色突变[40],甘蓝中也有类似报道[41],这些研究结果均表明高表达的会使果肉的颜色偏浅。陶俊[42]的研究也表明果肉偏红色的‘温州蜜柑’类胡萝卜素含量显著高于果肉偏黄色和浅橙色的‘甜橙’,由此进一步推测的高表达降低了柑橘果肉中类胡萝卜素的含量,使果肉颜色偏黄。但‘茂谷柑’并不符合这一推测,因此,本研究对10个柑橘品种进行了测序分析。结果显示,10个柑橘品种中并没有发生结构变异,也没有终止子突变,但‘茂谷柑’编码区中含有较多的变异,其中A305T、V553I为其独有的氨基酸变异,这可能是导致‘茂谷柑’的表达量与果肉颜色之间关系异常的原因,但还需要进一步的验证。对30个柑橘品种进行单倍型分析,发现果肉呈橙红色的品种中单倍型序列均以hap-1、hap-4、hap-5为优势单倍型,而含有hap-4、hap-5的品种果皮均呈现艳丽的红色。由此可见,根据的基因分型结果,不仅能够为果肉颜色育种提供重要的分子标记,而且能够对30份柑橘种质进行清晰的系谱分类。‘美国糖橘’来源较为复杂,至今不清楚其具体亲本信息,在本试验中其两个单倍型分别为hap-1和hap-6,包含hap-1单倍型的种质多为中国系红橘品种,而含有hap-6单倍型的品种为杂柑类品种,由此推测‘美国糖橘’可能为红橘与杂柑类品种杂交而成。另外引人注意的是,hap-5仅有一个品种‘牛肉红橘’,其为‘朱红橘’突变体[43],本试验中鉴定到其包含两种单倍型,相较于其他‘朱红橘’品种,‘牛肉红橘’的果肉为浓郁的橙红色,其果皮颜色也为深红色。结合在中669 bp为Y的基因型均表现为果皮艳丽的红色,果肉为橙红色,669 bp位置的C/T基因型可作为潜在的柑橘颜色育种的分子标记。综合本试验结果,的hap-1、hap-4、hap-5单倍型作为分子标记来预测柑橘果肉颜色,hap-4、hap-5和669 bp的C/T基因型来预测柑橘果皮颜色值得关注,下一步将通过对该单倍型遗传规律的深入研究予以进一步验证。
4 结论
本研究从柑橘全基因组中鉴定出14个CCD基因成员,其蛋白均含有RPE65保守结构域。亚细胞定位显示CcCCD定位于细胞质和叶绿体。的表达水平影响柑橘果肉颜色的表现,高表达的品种果肉颜色普遍较浅,而低表达品种果肉颜色普遍较深。因此,可作为潜在的柑橘果实颜色的辅助育种标记,尤其是单倍型hap-1、hap-4和hap-5与果肉红色的关联度较高,对柑橘颜色育种的早期杂种群体筛选具有一定帮助。
[1] VALLABHANENI R, BRADBURY L M, WURTZEL E T. The carotenoid dioxygenase gene family in maize, sorghum, and rice., 2010, 504(1): 104-111.
[2] Woitsch S, Römer S. Expression of xanthophyll biosynthetic genes during light-dependent chloroplast differentiation., 2003, 132(3): 1508-1517.
[3] WANG C N, QIAO A H, FANG X F, SUN L, GAO P, DAVIS A R, LIU S, LUAN F S. Fine mapping of lycopene content and flesh color related gene and development of molecular marker-assisted selection for flesh color in watermelon ()., 2019, 10: 1240.
[4] ILAHY R, SIDDIQUI M W, TLILI I, MONTEFUSCO A, PIRO G, HDIDER C, LENUCCI M S. When color really matters: horticultural performance and functional quality of high-lycopene tomatoes., 2018, 37(1): 15-53.
[5] MESSING S A J, GABELLI S B, ECHEVERRIA I, VOGEL J T, GUAN J C, TAN B C, KLEE H J, MCCARTY D R, AMZEL L M. Structural insights into maize viviparous14, a key enzyme in the biosynthesis of the phytohormone abscisic acid., 2010, 22(9): 2970-2980.
[6] AULDRIDGE M E, BLOCK A, VOGEL J T, DABNEY-SMITH C, MILA I, BOUZAYEN M, MAGALLANES-LUNDBACK M, DELLAPENNA D, MCCARTY D R, KLEE H J. Characterization of three members of the Arabidopsis carotenoid cleavage dioxygenase family demonstrates the divergent roles of this multifunctional enzyme family., 2006, 45(6): 982-993.
[7] TAN B C, JOSEPH L M, DENG W T, LIU L J, LI Q B, CLINE K, MCCARTY D R. Molecular characterization of the9-cis epoxycarotenoid dioxygenase gene family., 2003, 35(1): 44-56.
[8] YAHYAA M, BAR E, DUBEY N K, MEIR A, DAVIDOVICH R R, HIRSCHBERG J, ALY R, THOLL D, SIMON P W, TADMOR Y, LEWINSOHN E, IBDAH M. Formation of norisoprenoid flavor compounds in carrot (L.) roots: Characterization of a cyclic-specific carotenoid cleavage dioxygenase 1 gene., 2013, 61(50): 12244-12252.
[9] BALDERMANN S, KATO M, KUROSAWA M, KUROBAYASHI Y, FUJITA A, FLEISCHMANN P, WATANABE N. Functional characterization of a carotenoid cleavage dioxygenase 1 and its relation to the carotenoid accumulation and volatile emission during the floral development ofLour., 2010, 61(11): 2967-2977.
[10] SUN Z K, HANS J, WALTER M H, MATUSOVA R, Beekwilder J, Verstappen F W A, Zhao M, van Echtelt E, Strack D, Bisseling T, Bouwmeester H J. Cloning and characterisation of a maize carotenoid cleavage dioxygenase () and its involvement in the biosynthesis of apocarotenoids with various roles in mutualistic and parasitic interactions., 2008, 228(5): 789-807.
[11] ALDER A, JAMIL M, MARZORATI M, BRUNO M, VERMATHEN M, BIGLER P, GHISLA S, BOUWMEESTER H, BEYER P, AL- BABILI S. The path from-carotene to carlactone, a strigolactone- like plant hormone., 2012, 335(6074): 1348-1351.
[12] BOOKER J, AULDRIDGE M, WILLS S, MCCARTY D, KLEE H, LEYSER O./is a carotenoid cleavage dioxygenase required for the synthesis of a novel plant signaling molecule., 2004, 14(14): 1232-1238.
[13] SCHWARTZ S H, TAN B C, MCCARTY D R, WELCH W, ZEEVAART J A D. Substrate specificity and kinetics for, a carotenoid cleavage dioxygenase in the ABA biosynthetic pathway., 2003, 1619(1): 9-14.
[14] 陈唯, 曾晓贤, 谢楚萍, 田长恩, 周玉萍. 植物内源ABA水平的动态调控机制. 植物学报, 2019, 54(6): 677-687.
CHEN W, ZENG X X, XIE C P, TIAN C E, ZHOU Y P. The dynamic regulation mechanism of the Endo-genous ABA in Plant., 2019, 54(6): 677-687. (in Chinese)
[15] VALLABHANENI R, BRADBURY L M T, WURTZEL E T. The carotenoid dioxygenase gene family in maize, sorghum, and rice., 2010, 504(1): 104-111.
[16] WEI Y P, WAN H J, WU Z M, WANG R Q, RUAN M Y, YE Q J, LI Z M, ZHOU G Z, YAO Z P, YANG Y J. A comprehensive analysis of carotenoid cleavage dioxygenases genes in, 2016, 34(2): 512-523.
[17] LASHBROOKE J G, YOUNG P R, DOCKRALL S J, VASANTH K, VIVIER M A. Functional characterisation of three members of theL. carotenoid cleavage dioxygenase gene family., 2013, 13(1): 156.
[18] RUBIO-MORAGA A, AHRAZEM O, PÉREZ-CLEMENTE R M, GÓMEZ-CADENAS A, YONEYAMA K, LÓPEZ-RÁEZ J A, MOLINA R V, GÓMEZ-GÓMEZ L. Apical dominance in saffron and the involvement of the branching enzymesand, 2014, 14(1): 171.
[19] OHMIYA A, KISHIMOTO S, AIDA R, YOSHIOKA S, SUMITOMO K. Carotenoid cleavage dioxygenase () contributes to white color formation in Chrysanthemum petals., 2006, 142(3): 1193-1201.
[20] RODRIGO M J, ALQUÉZAR B, ALÓS E, MEDINA V, CARMONA L, BRUNO M, AL-BABILI S, ZACARÍAS L. A novel carotenoid cleavage activity involved in the biosynthesis of Citrus fruit-specific apocarotenoid pigments., 2013, 64(14): 4461-4478.
[21] 王莎莎, 栾雨婷, 徐昌杰. 柑橘β-柠乌素积累及其调控研究进展. 果树学报, 2018, 35(6): 760-768.
WANG S S, LUAN Y T, XU C J. Research progress in the regulation of β-citraurin accumulation in citrus fruits., 2018, 35(6): 760-768. (in Chinese)
[22] ZHENG X J, ZHU K J, SUN Q, ZHANG W Y, WANG X, CAO H B, TAN M L, XIE Z Z, ZENG Y L, YE J L, CHAI L J, XU Q, PAN Z Y, XIAO S Y, FRASER P D, DENG X X. Natural variation inpromoter underpins species-specific evolution of red coloration in citrus peel., 2019, 12(9): 1294-1307.
[23] MINAMIKAWA M F, NONAKA K, KAMINUMA E, KAJIYA- KANEGAE H, ONOGI A, GOTO S, YOSHIOKA T, IMAI A, HAMADA H, HAYASHI T, MATSUMOTO S, KATAYOSE Y, TOYODA A, FUJIYAMA A, NAKAMURA Y, SHIMIZU T, IWATA H. Genome wide association study and genomic prediction in citrus: potential of genomics-assisted breeding for fruit quality traits., 2017, 7(1): 4721.
[24] GMITTER F G, CHEN C X, MACHADO M A, SOUZA A A, OLLITRAULT P, FROEHLICHER Y, SHIMIZU T. Citrus genomics., 2012, 8(3): 611-626.
[25] BRUNO M, VERMATHEN M, ALDER A, WÜST F, SCHAUB P, van der STEEN R, BEYER P, GHISLA S, AL-BABILI S. Insights into the formation of carlactone from in-depth analysis of thecatalyzed reactions., 2017, 591(5): 792-800.
[26] LEDGER S E, JANSSEN B J, KARUNAIRETNAM S, WANG T, SNOWDEN K C. Modified carotenoid cleavage dioxygenase 8 expression correlates with altered branching in kiwifruit ()., 2010, 188(3): 803-813.
[27] VOGEL J T, WALTER M H, GIAVALISCO P, LYTOVCHENKO A, KOHLEN W, CHARNIKHOVA T, SIMKIN A J, GOULET C, STRACK D, BOUWMEESTER H J, FERNIE A R, KLEE H J.controls strigolactone biosynthesis, shoot branching and mycorrhiza-induced apocarotenoid formation in tomato., 2010, 61(2): 300-311.
[28] KULKARNI K P, VISHWAKARMA C, SAHOO S P, LIMA J M, NATH M, DOKKU P, GACCHE R N, MOHAPATRA T, ROBIN S, SARLA N, SESHASHAYEE M, SINGH A K, SINGH K, SINGH N K, SHARMA R P. A substitution mutation incosegregates with dwarf and increased tillering phenotype in rice., 2014, 93(2): 389-401.
[29] 王小龙, 刘凤之, 史祥宾, 王孝娣, 冀晓昊, 王志强, 王宝亮, 郑晓翠, 王海波. 葡萄NCED基因家族进化及表达分析. 植物学报, 2019, 54(4): 474-485.
WANG X L, LIU F Z, SHI X B, WANG X D, JI X H, WANG Z Q, WANG B L, ZHENG X C, WANG H B. Evolution and expression of NCED family genes in., 2019, 54(4): 474-485. (in Chinese)
[30] 巩檑, 宋继玲, 甘晓燕, 刘璇, 陈虞超, 郭志乾, 宋玉霞. 模拟干旱胁迫下马铃薯表达量及与ABA含量的相关性分析. 植物遗传资源学报, 2018, 19(3): 561-567.
GONG L, SONG J L, GAN X Y, LIU X, CHEN Y C, GUO Z Q, SONG Y X. Correlation analysis ofexpression level and ABA content of potato under simulated drought stress., 2018, 19(3): 561-567. (in Chinese)
[31] KATO M, MATSUMOTO H, IKOMA Y, OKUDA H, YANO M. The role of carotenoid cleavage dioxygenases in the regulation of carotenoid profiles during maturation in citrus fruit., 2006, 57(10): 2153-2164.
[32] SONG M H, LIM S H, KIM J K, JUNG E S, JOHN K M M, YOU M K, AHN S N, LEE C H, HA S H. In planta cleavage of carotenoids bycarotenoid cleavage dioxygenase 4 in transgenic rice plants., 2016, 10(5): 291-300.
[33] URESHINO K, NAKAYAMA M, MIYAJIMA I. Contribution made by the carotenoid cleavage dioxygenase 4 gene to yellow colour fade in azalea petals., 2016, 207(2): 401-417.
[34] LIU H, KISHIMOTO S, YAMAMIZO C, FUKUTA N, OHMIYA A. Carotenoid accumulations and carotenogenic gene expressions in the petals of., 2013, 132(4): 417-422.
[35] HAI N T L, MASUDA J I, MIYAJIMA I, THIEN N Q, MOJTAHEDI N, HIRAMATSU M, KIM J H, OKUBO H. Involvement of carotenoid cleavage dioxygenase 4 gene in tepal color change invar.., 2012, 81(4): 366-373.
[36] MA G, ZHANG L C, IIDA K, MADONO Y, YUNGYUEN W, YAHATA M, YAMAWAKI K, KATO M. Identification and quantitative analysis of β-cryptoxanthin and β-citraurin esters in Satsuma mandarin fruit during the ripening process., 2017, 234(9): 356-364.
[37] AGóCS A, NAGY V, SZABó Z, MáRK L, OHMACHT R, DELI J. Comparative study on the carotenoid composition of the peel and the pulp of different citrus species., 2007, 8(3): 390-394.
[38] GONZáLEZ-VERDEJO C I, OBRERO á, rOMáN B, GóMEZ P. Expression profile of carotenoid cleavage dioxygenase genes in summer squash (. L)., 2015, 70(2): 200-206.
[39] BAI S L, PHAM A T, MIHO T, HIDEAKI Y, AKEMI O, CHIHIRO Y, TAKAYA M. Knockdown of carotenoid cleavage dioxygenase 4 () via virus-induced gene silencing confers yellow coloration in peach fruit: Evaluation of gene function related to fruit traits., 2016, 34(1): 257-264.
[40] PHADUNGSAWAT B, WATANABE K, MIZUNO S, KANEKATSU M, SUZUKI S. Expression ofgene involved in carotenoid degradation in yellow-flowered., 2019: 108916.
[41] ZHANG B, HAN F Q, CUI H L, LI X, REN W J, FANG Z Y, YANG Z Y, ZHUANG M, LU H H, LIU Y M. Insertion of a CACTA-like transposable element disrupts the function of thegene in yellow-petal Chinese kale., 2019, 39(9): 130.
[42] 陶俊. 柑橘果实类胡萝卜素形成及调控的生理机制研究[D]. 杭州: 浙江大学, 2002.
TAO J. Physiological studies on carotenoid formation and regulation in citrus fruit [D]. Hangzhou: Zhejiang University, 2002. (in Chinese)
[43] 谭萍, 谭奋勇, 王祖泽, 杨再英, 谭功亮. 惠水独特优良品种─牛肉红金桔. 江西柑桔科技, 1994(2): 26-27.
TAN P, TAN F Y, WANG Z Z, YANG Z Y, TAN G L. Unique and excellent variety of Hui Shui-Niu rou hong ju., 1994(2): 26-27. (in Chinese)
Genome Wide Identification of CCD Gene Family in Citrus and Effect ofon the Color of Citrus Flesh
ZHANG YaFei1, PENG Jie1, ZHU YanSong1, YANG ShengNan1, WANG Xu1, ZHAO WanTong1, 2, JIANG Dong1, 2
(1Citrus Research Institute, Southwest University, Chongqing 400712;2Citrus Research Institute of Chinese Academy of Agricultural Sciences, Chongqing 400712)
【】To reveal the distribution, structure and evolution of carotenoid cleavage dioxygenas gene family in the citrus genome (CcCCD), this study were performed to develope marker-assisted selection of flesh color in citrus breeding program, bioinformatics predication, expression analysis and genotype ofin flesh color development and different germplasm accessions. 【】The CCD gene family ofgenome were identified by homologous search according to previously reported CCD in other plant species. Phylogenetic analysis, subcellular localization prediction, relative molecular weight, theoretical isoelectric point (PI), conserved motif prediction, and scaffold location were studied by bioinformatics methods. Real-time fluorescence quantitative PCR (qRT-PCR) was used to study the expression ofin 10 citrus accessions during the flesh color development period. Haplotype analysis was performed by Tassel software after sequencing ofin 30 citrus varieties.【】Fourteen CCD family genes were found in thegenome, and these genes could be divided into five subfamily, namely,CcCCD1, CcCCD4, CcCCD7, CcCCD8 and CcNCED. Its theoretical isoelectric point were 6.05 to 8.53 and these CCD family genes encoded 412-611 amino acids. The subcellular localization prediction indicated that CcCCD genes mainly were located in chloroplast and cytoplasm. Phylogenetic analysis showed thatgenes in citrus were also found in other plant species. Obviously, CCD8 subfamily had farther genetic distance with other CCD. Scaffold localization analysis showed that 14 CcCCD members were unevenly distributed in all scaffolds except scaffold 5. The phenotyping of flesh color in 10 citrus varieties demonstrated that the hue angle of flesh color was decreased along with fruit maturing. The relative expression ofin different citrus varieties was significantly different. The expression ofin the flesh color of orange red was significantly lower than that in the flesh color of orange or light orange yellow (<0.05). There was a significant positive correlation between the relative expression ofand the hue angle during fruit ripening. Genotyping ofin 30 citrus varieties revealed that hap-1, hap-4 and hap-5 were dominant haplotype at orange red flesh varieties. 【】The whole genome ofcontained 14 members of CCD gene family.All these CCD gene family members contained RPE65 conserved domain, but they were located in different cell components and unevenly distributed at different scaffolds.was involved in the development of citrus flesh color, and there was a significant positive correlation between its relative expression and the hue angle. Therefore,could be used as potential marker for citrus fruit color breeding. Especially, hap-1, hap-4 and hap-5 had a high correlation with the phenotypes of orange red flesh, which might be helpful for selecting candidate hybrids in early stage of citrus breeding program.
citrus; CCD gene family;; flesh color; gene expression; haplotype

10.3864/j.issn.0578-1752.2020.09.014
2019-01-10;
2020-03-03
国家重点研发计划(2018YFD1000101)、教育部双一流学科建设项目
张亚飞,E-mail:1065120362@qq.com。通信作者江东,E-mail:jiangdong@cric.cn
(责任编辑 赵伶俐)
