杨树ERF11转录因子基因应答渗透胁迫表达分析
2020-06-03吕冠斌姜廷波周博如
刘 悦 赵 凯 吕冠斌 姜廷波 周博如
(东北林业大学林木遗传育种国家重点实验室,哈尔滨 150040)
AP2/ERF基因家族是植物所特有的、最大的转录因子家族之一,该家族转录因子参与植物的多种生物学过程,包括植物的生长、花发育、果实发育、种子发育、损伤、病菌防御、高盐、干旱等环境胁迫响应等[1~4]。根据AP2/ERF结构域的数目和特点,AP2/ERF转录因子家族分为AP2亚家族、EREBP亚家族以及RAV亚家族[5]。ERF类转录因子的AP2/ERF结构域N-端是由高度保守的19~20个碱性YRG基元组成的YRG区,C-端是由含有42~43个氨基酸残基组成的RAYD区。AP2/ERF基因家族可以通过结合脱水应答元件DRE和CRT应答干旱、低温、高盐胁迫[6],通过与GCC-box及诱导元件结合应答胁迫[7]。近年来,越来越多的研究表明AP2/ERF家族基因参与到了植物的生物、非生物胁迫[8~11]。研究表明毛果杨PtrDREB28基因能够增强植物对低温和高温的耐受能力[12]。转录因子ERF76基因能够提高小黑杨的耐盐能力[13]。ERF11转录因子属于EREBP亚家族成员之一,研究表明ERF11基因通过激活赤霉素生物合成、刺激信号传导促进节间生长[14];在拟南芥(Arabidopsis)中,乙烯反应因子ERF6和ERF11对甘露醇诱导的拟南芥生长抑制有抗拮作用[15];在白桦(Betulaplatyphylla)中,ERF11基因响应高盐干旱胁迫[16];ERF11基因激活BT4转录,调节丁香假单胞菌免疫[17],但ERF11基因功能未在杨树中有相关报道。为探明小黑杨ERF11基因应答高盐及干旱两种胁迫的表达特点,本研究用RT-PCR从小黑杨(Populussimonii×P.nigra)叶片中克隆了ERF11基因cDNA片段,对ERF11基因进行生物信息学分析,用RT-qPCR分析了ERF11基因在NaCl、甘露醇模拟干旱胁迫条件下的表达特性,为探明ERF11基因在杨树抗逆中的作用提供参考。
1 材料与方法
1.1 实验材料
植物材料为培养1个月的同一无性系双单倍体小黑杨组培苗。
1.2 试验方法
1.2.1 目的基因的克隆
利用天恩泽柱式植物RNAout试剂盒提取总RNA,用PrimerScriptTMRT reagent Kit with gDNA Eraser(Perfect Real Time)试剂盒反转录成cDNA。设计引物(见表1),对其克隆,按照扩增反应程序:94℃预变性2 min,94℃变性30 s,56℃退火30 s,72℃延伸40 s,35个循环,72℃延伸10 min,4℃保存。1.0%的琼脂糖凝胶电泳回收,与pMD19-T载体连接,42℃热激转化大肠杆菌,挑选阳性克隆送至生工测序,保留测序正确的菌液进行后续实验。
1.2.2 生物信息学分析
ExPasy(http://web.expasy.org/protparam/)在线Protparam软件分析ERF11氨基酸的理化性质。ProtScale(https://web.expasy.org/protscale/)的Kyte and Doolittle算法分析ERF11蛋白的亲水/疏水性。Singa-P(http://www.cbs.dtu.dk/services/SignalP/)的神经网络算法对ERF11

表1 实验引物设计
蛋白进行分析并预测其信号肽。TMPred(https://embnet.vital-it.ch/software/TMPRED_form.html#opennewwindow)预测ERF11蛋白的跨膜结构。SOMPA(npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma)分析ERF11蛋白的二级结构。Swissmode(https://swissmodel.expasy.org/interactive)分析ERF11蛋白的三级结构。利用NCBI数据库Blast(https://blast.ncbi.nlm.nih.gov/Blast.cgi?PROGRAM=blastp&PAGE_TYPE=BlastSearch&LINK_LOC=blasthome)对ERF11基因序列蛋白进行同源序列比对,并利用MEGA(Version 5.2)构建进化树。用在线预测软件Yloc(http://abi.inf.uni-tuebingen.de/Services/YLoc/webloc.cgi)进行亚细胞定位预测分析[13]。
1.2.3PBI121-ERF11-GFP植物表达载体构建
根据载体PBI121-GUS与目的基因ERF11序列设计含SpeⅠ和XbaⅠ酶切位点的酶切引物(见表1),对其克隆,扩增反应程序与目的基因克隆相同。于37℃双酶切反应4 h后琼脂糖凝胶回收,利用T4DNA连接酶将纯化后的PBI121酶切产物和ERF11酶切产物进行连接,将连接产物转至大肠杆菌TOP10感受态中,利用载体引物和ERF11基因特异性引物进行菌液PCR检测,并将阳性克隆菌液送去测序。
1.2.4 基因枪法瞬时转化
利用基因枪法瞬时转化ERF11-GFP融合蛋白,具体操作根据PDS-1000台式基因枪使用说明。暗培养36~72 h后,在激光共聚焦显微镜下进行观察。
1.2.5 胁迫下处理表达分析
将小黑杨组培苗置于相对湿度60%~70%、14 h光/10 h暗、平均温度25℃条件下土培1个月后,将材料分为42组,每3组进行同一处理。分别用水(对照组)、0.15 mol·L-1NaCl和200 mmol·L-1甘露醇处理0、3、6、9、12和24 h后,分别将样本的根、茎、叶保存至-80℃。
利用柱式植物RNA提取试剂盒提取植物总RNA,RT-PCR反转录成cDNA。将cDNA用无菌的ddH2O稀释100倍,作为实时荧光定量PCR的模板,荧光定量试剂盒为SYBR®Premix Ex TaqTMⅡ(Perfect Real Time)。BLAST分析预测该基因保守结构域,并设计实时荧光定量PCR引物(见表1)。PCR在ABI7500荧光PCR仪上进行。以内参基因ACT为对照,用2-ΔΔCT计算法计算其相对表达量。
2 结果
2.1 ERF11基因克隆及氨基酸理化性质分析
从小黑杨模板cDNA中克隆获得ERF11基因,该基因全长732 bp,编码243个氨基酸,含20种氨基酸(见图1),具完整的开放阅读框。ERF11蛋白的化学式为C1132H1757N347O361S9,等电点(PI)为9.01,不稳定系数为50.12,属于不稳定蛋白。ERF11蛋白总平均疏水指数为-0.876,亲水性区域分布均匀,氨基酸数量较多,为亲水蛋白(见图2)。利用在线软件SOPMA对杨树ERF11蛋白的氨基酸序列进行二级结构预测,结果表明该蛋白主要由无规则卷曲、延伸链、α-螺旋、β-折叠组成(见表2)。
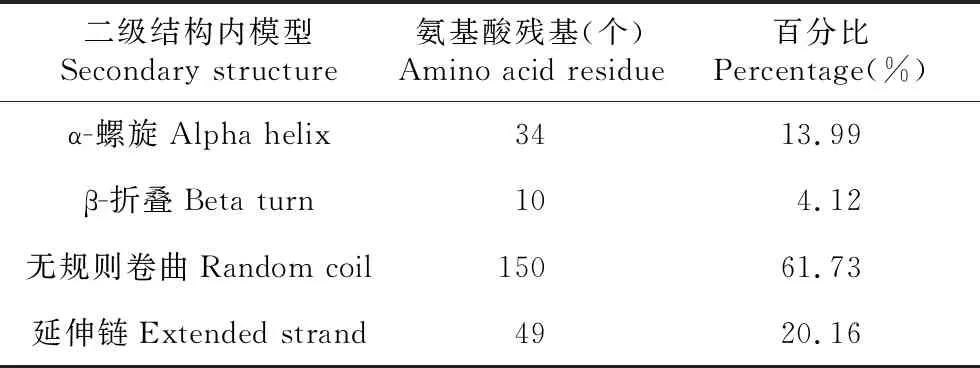
表2 ERF11蛋白的二级结构
2.2 信号肽及跨膜结构域预测
信号肽是N端的引导新合成的蛋白质向分泌通路转移的一段氨基酸序列,通常由20~30个氨基酸残基组成。信号肽预测结果表明,ERF11不存在信号肽(见图3)。跨膜结构是一段一般由20个左右的疏水性氨基酸组成的片段,主要形成ɑ-螺旋。根据在线工具TMPred预测ERF11的跨膜结构,该基因蛋白不存在跨膜结构(见图4)。

图1 ERF11蛋白编码氨基酸含量Fig.1 Secondary structure of ERF11 protein
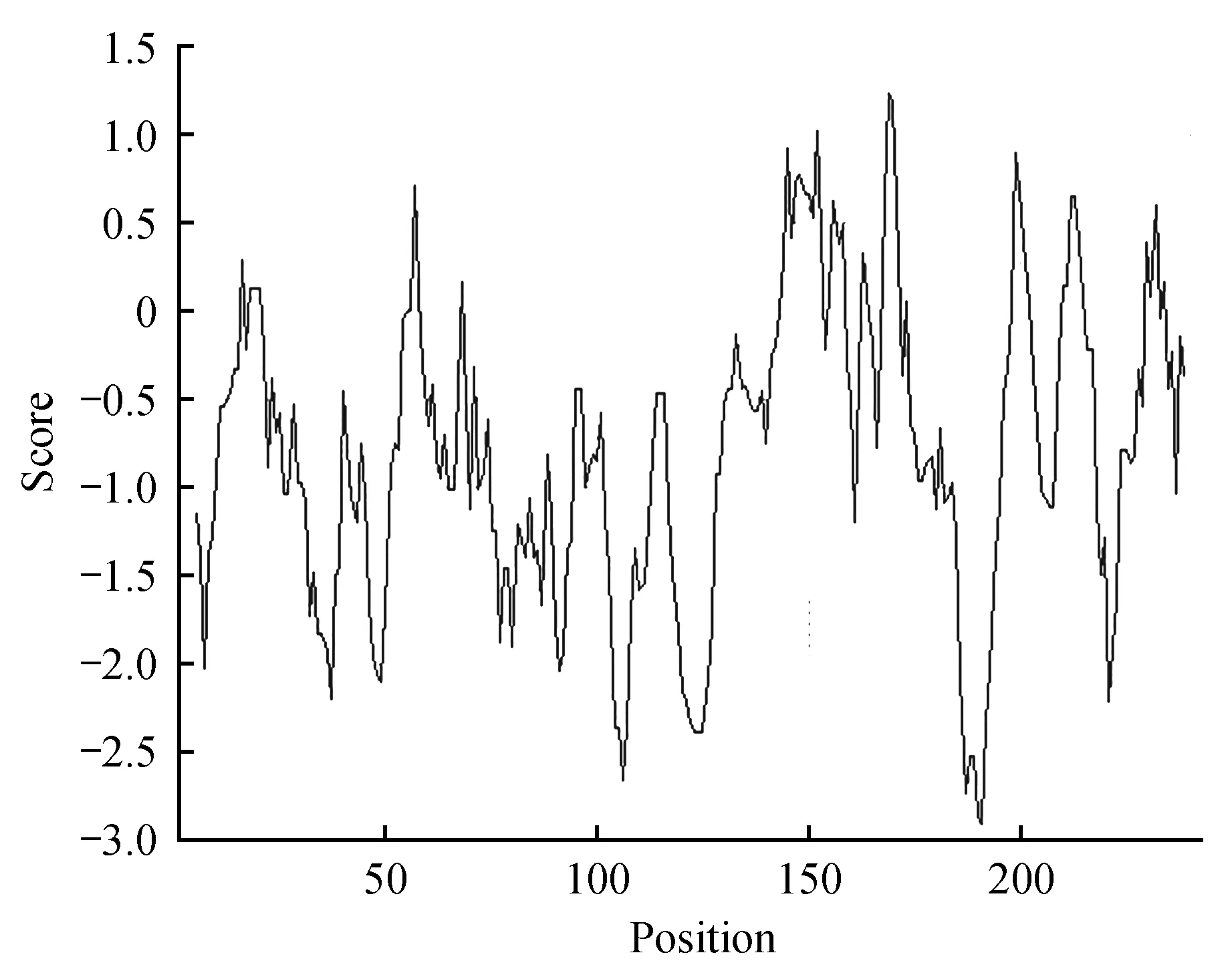
图2 ERF11蛋白氨基酸亲疏水性区域分布图Fig.2 Distribution map of amino acids of ERF11 protein

图3 小黑杨ERF11蛋白信号肽预测Fig.3 Prediction of ERF11 protein signaling peptide in Populus simonii×P.nigra

图4 小黑杨ERF11蛋白跨膜结构预测和分析Fig.4 Prediction and analysis of ERF11 protein transmembrane structure in Populus simonii×P.nigra
2.3 同源性分析
对ERF11氨基酸序列进行同源序列比对,并构建系统进化树(见图5)。结果表明,17条蛋白序列大致可分为两类:其中绿豆(Vignaradiatavar.radiata)、威氏大豆(Glycine)、赤豆(Vignaangularis)、花芸豆(Phaseolusvulgaris)、木瓜(Caricapapaya)、枇杷树(Eriobotryajaponica)、苹果(Malusdomestica)、哥伦比亚锦葵(Herraniaumbratica)、橙子(Citrussinensis)、克莱门柚(Citrusclementina)聚成一个大类,与小黑杨ERF11基因亲缘关系较远;小黑杨(Populussimonii×P.nigra)、毛果杨(Populustrichocarpa)、胡杨(Euphratica)、蓖麻(Ricinuscommunis)、橡胶树(Heveabrasiliensis)、麻疯树(Jatrophacurcas)、木薯(Manihotesculenta)聚成一类,且亲缘关系较近。

图5 小黑杨ERF11系统进化树Fig.5 Evolutionary tree of PsnERF11

图6 ERF11蛋白亚细胞定位结果 A,D.暗场观察;B,E.明场观察;C,F.二者结合效果Fig.6 Subcellular localization of ERF11 protein A,D.Were observed in dark filed for green fluorescence;B,E.Were observed in bright field; C,F.Were observed in combination
2.4 基因在洋葱表皮的瞬时表达
ERF11融合表达载体使用载体引物进行验证,载体引物位于35 s启动子及GFP序列两端,条带为1 800 bp左右,表明载体构建成功。激光共聚焦显微镜下观察(见图6),对照GFP空载体在整个洋葱表皮细胞中均有表达,而ERF11-GFP融合表达载体只能在细胞核中看到绿色荧光,ERF11基因在细胞核中表达,与在线预测软件Yloc预测分析结果一致。
2.5 ERF11基因差异表达分析
ERF11基因表达具有组织特异性,并受胁迫诱导表达。在非胁迫条件下,其在根中表达水平明显比在茎和叶中的表达水平高,约为茎和叶中表达水平的4.7倍,而在茎和叶中的表达水平差异不大(见图7)。甘露醇胁迫下,ERF11基因在根茎叶中的表达量均有先升高再降低的趋势,根中24 h达到最大值,约为非胁迫对照表达水平的163.7倍;茎中12 h达到最大,约为非胁迫对照表达水平的4.9倍;在叶中9 h表达量达到最大值,为非胁迫对照表达水平的6.8倍(见图8)。盐胁迫下,ERF11基因在根茎叶中的表达同样表现出先升高后降低的趋势,根中12 h表达量达到最大,约为非胁迫对照表达水平的59.8倍,茎中9 h达到最大,约为非胁迫对照表达水平的2.4倍,叶中3 h达到最大,约为非胁迫对照表达水平的的4.8倍(见图9)。
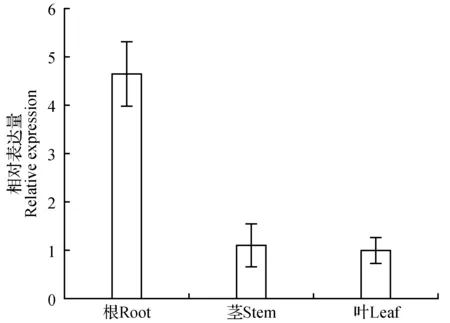
图7 小黑杨ERF11基因0 h时不同部位相对表达量变化Fig.7 Changes of relative expression of ERF11 gene in different parts of Populus simonii×P.nigra at 0 h
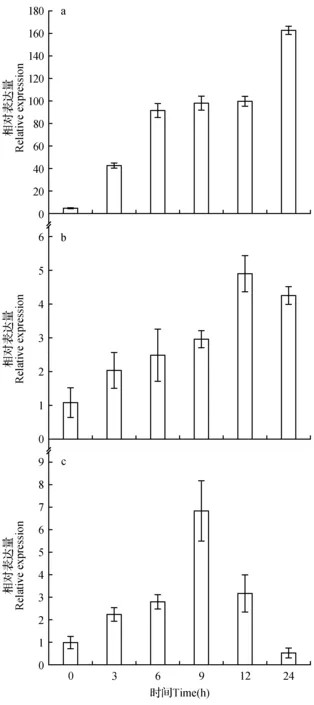
图8 小黑杨ERF11基因甘露醇模拟干旱处理下不同时间下不同部位相对表达量变化 a.根;b.茎;c.叶Fig.8 Changes of relative expression of ERF11 gene in different parts of Populus simonii×P.nigra under simulated drought a.Root; b.Stem; c.Leaf

图9 小黑杨ERF11基因盐胁迫处理下不同时间下不同部位相对表达量变化 a.根;b.茎;c.叶Fig.9 Changes of relative expression of ERF11 gene in different parts of Populus simonii×P.nigra under salt stress at different time a.Root; b.Stem; c.Leaf
3 讨论
转录因子也称反式作用因子,是一种可被真核生物基因启动子序列中的顺式作用元件识别,并能特异性结合的一类蛋白[18]。在植物的生长发育过程中,会受到各种生物、非生物胁迫,通过信号传递促使转录因子与下游顺式作用元件结合,调控下游基因表达,对逆境做出响应,使植物对环境胁迫的适应能力增强。由不同转录因子组成的调控网络在抵御逆境胁迫中发挥了重要的作用[19]。
植物在受到外界逆境环境胁迫时,通过信号传递,使转录因子与下游基因的顺式作用元件相结合调控下游基因,进而调控植物响应外界逆境环境,而转录调控已成为植物对逆境胁迫反应调控中的研究热点[20~21]。渗透胁迫会导致植株水分向外倒流,引起生理干旱、细胞的渗透势增加、气孔导度下降及叶绿体受损,影响植物蒸腾作用,抑制植物生长甚至死亡[22~23]。AP2/ERF家族转录因子在调节植物生物、非生物胁迫中发挥着重要的作用[24~25]。迄今为止,已报道的ERF家族基因多数被低温、干旱、盐碱、病害、机械损伤等逆境或脱落酸(ABA)、乙烯(ET)、茉莉酸(JA)、水杨酸(SA)等内源激素诱导,参与不同的信号调节途径。此外,研究发现,不同逆境环境、不同激素诱导的ERF家族成员也不同。拟南芥ERF1转录因子通过GCC-box和DRE元件结合应答干旱和高盐胁迫[26]。小麦转录因子TaERF3基因的过表达植株抗旱、耐盐能力显著增加[27]。水稻OsEBP-89基因表达受到高盐和2,4-D的调控[28]。番茄TSRF1基因可被乙烯、水杨酸以及病害诱导、SLERF5基因则响应高盐和干旱胁迫[29~31]。AgDREB1和AgDREB2可能作为转录激活因子通过结合相应的DRE来调节下游基因,从而增强芹菜的抗应激能力[32]。
本研究中,从小黑杨叶中克隆出732 bp的ERF11基因,对该基因进行了生物信息学分析、亲缘关系分析、亚细胞定位、时空表达分析。ERF11基因在应答高盐干旱胁迫上具有明显的组织特异性,在根中的相对表达量远高于茎和叶。杨树ERF11基因可能参与植物渗透胁迫,与增强植物抗逆性有关。
