用于三维电镜及X射线显微镜的完整小鼠耳蜗块染方法△
2020-06-03丁旭王方方王皓煜梁雅坤常海双黄治物华云峰2吴皓
丁旭 王方方 王皓煜 梁雅坤 常海双 黄治物 华云峰2, 吴皓,
耳蜗是重要的听觉器官,负责将外界的声音刺激编码成神经电冲动并传导给听神经。对耳蜗开展系统的结构学研究有助于认识各类听力损失的发病机制。作为研究生物样品超微结构的主要手段,电镜技术已被广泛应用于听觉神经科学的诸多领域,其中包括毛细胞静纤毛、带状突触、听神经髓鞘及血管纹。但目前研究集中在使用常规电镜对耳蜗组织的超薄切片进行结构表征[1~4],电镜三维成像也局限于对耳蜗细胞间隙、内毛细胞中的线粒体及带状突触的研究[5~8],尚无大尺寸耳蜗神经组织三维结构的报道。关键技术瓶颈在于耳蜗组织由坚硬的骨质包裹,不采取解剖分离的方法,无法获得染色均一的电镜样品;而前者机械性破坏了耳蜗的三维结构,导致耳蜗超微结构的研究只在极有限的体积内开展,一般为1~2个细胞的跨度[4,6,8]。
使用还原性锇进行块染是目前三维电镜样品制备的首选方法。相对于其它重金属染色,锇元素会高度富集在细胞膜内,可提高图像对比度并缩短成像时间;同时锇的导电性强,可避免扫描电镜成像过程中电荷在样品表面富集造成图像伪迹;此外,由于避免了切片染色,大大降低了由于暴露在空气中以及转移样品所导致的样品污染和机械损伤的风险。然而还原性锇在细胞膜致密的生物样品中扩散缓慢,在有限的时间内传统块染方法在大尺寸生物样品上无法实现均一的染色,而简单延长染色时间会造成样品污染[9~12]。近期有研究突破了这一瓶颈,将还原锇酸染色中的锇酸渗透和还原的步骤进行分析,使可均一制备的脑组织样品的最大厚度从约200微米提高到了1毫米[11]。通过该方法制备的脑组织样品具有优异的导电性和细胞膜对比度,被广泛应用于高通量三维电镜成像[13~17],本研究在此基础上,针对耳蜗样品的结构特殊性,优化了实验条件,包括:①进行低温耳蜗灌注脱钙;②采用短暂脱钙;③调整染色和树脂包埋所需的时间;最终实现了完整小鼠耳蜗样品的电镜制备,所得样品适用于X射线显微镜、扫描及透射电镜多种成像手段,且具有染色均一、细胞膜结构对比度高和结构保存完好的特点,为耳科疾病的研究提供了基础,报告如下。
1 材料与方法
1.1实验动物 采用3只野生型CBA/ca小鼠(4~8周龄),雌雄不限,由上海西普尔-必凯实验动物有限公司提供。动物饲养以及实验方案由所在单位的动物伦理委员会审查和批准通过,并严格按照规范进行 (SH9H-2019-A387-1)。
1.2小鼠耳蜗的取材和固定 动物经腹腔注射麻醉(5%水合氯醛,1毫升/100克体重),颈椎离断处死后,快速解剖分离出两侧耳蜗,在含有0.08 M二甲胂酸钠缓冲液(pH 7.4, Sigma, C0250-100G)、2%多聚甲醛(Sigma, P6148-500G)、2.5%戊二醛(Sigma,G7776-10X10ML)的4 ℃混合固定液中使用显微精细镊暴露出圆窗和卵圆窗,利用微量注射泵(Harvard, 70-3007)以约50微升/分钟的速度灌注,分别从圆窗和卵圆窗灌注0.5毫升预冷的4 ℃混合固定液,完成后将样品转移至装有混合固定液的离心管中,在4 ℃冰箱中静置5小时,接着转移到添加了5%乙二胺四乙酸(Sigma-Aldrich, EDS-500G) 的上述混合固定液中置于4 ℃度冰箱中4小时。此操作先充分固定再脱钙,将最大程度的保留耳蜗的超微结构,同时增加样品的通透性,对样品的后续块染和树脂包埋至关重要。
1.3耳蜗电镜块染 完成固定及脱钙后的样品使用二甲胂酸钠缓冲液(0.15 M,pH 7.2~7.4)清洗两次,各30分钟后,依次浸没于2% 四氧化锇(二甲胂酸钠缓冲液配制,Ted Pella)2小时,2.5%亚铁氰化钾(二甲胂酸钠缓冲液配制,Sigma,P3289-100G)2小时,2%四氧化锇(二甲胂酸钠缓冲液配制)1.5小时。接着使用缓冲液清洗两次,各30分钟,浸没于1%硫代甲肼1小时,之后使用去离子水清洗两次,各30分钟,再次浸没于2%四氧化锇(去离子水配制,Sigma, 223220-5G)2小时,并用去离子水清洗两次各30分钟,置于4 ℃冰箱中过夜。次日,样品转移到新鲜配置的天冬氨酸铅溶液(0.03 M,使用氢氧化钾调节pH至5.00),在50 ℃温度下浸没2小时,之后使用去离子水清洗两次,各30分钟。
1.4脱水及树脂包埋 使用丙酮(上海凌峰化学试剂有限公司)对样品进行脱水,浓度梯度依次为:50% (4 ℃)、75% (4 ℃)、90% (4 ℃) 丙酮溶液, 以及3次100% (室温)无水丙酮,每个梯度脱水时间30~45分钟。脱水后的样品使用Spurr树脂(Sigma-Aldrich, EM0300-1KT)与无水丙酮混合液进行梯度包埋,比例为1∶1和2∶1各6小时,再将样品转移到纯树脂中浸没8~12小时后, 放入烤箱中在70 ℃高温聚合72小时以上。
1.5X射线显微镜成像 完成样品制备后,对耳蜗样品使用X射线显微镜(Xradia 520 Versa)进行成像,成像参数如下:加速电压60 kV,分辨率0.7微米,成像视野1.4毫米,曝光时间10 秒,共收集3 201张。图片数据由商业版软件Dragonfly(Objective Research Systems Inc.)进行处理。
1.6扫描电镜成像 使用Leica-TRIM2修块机对耳蜗样品进行打磨,至显微镜下可以看出暴露的耳蜗内部切面,再用Leica-UC7型超薄切片机抛光表面。耳蜗纵切面喷炭后(型号:208carbon,TED PELLA),使用场发射扫描电镜 (型号: Gemini300, 蔡司),Onpoint背散射探测器(Gantan)对样品表面的形貌进行观察成像,大视野拼图的成像条件为:电压2 kV,像素33纳米,单像素驻留时间2微秒。高分辨率图像成像条件为:电压2 kV,像素11纳米,单像素驻留时间1 微秒。使用Image J软件(NIH)将图片整合成完整的耳蜗切面图,并分析高分辨率图像。
1.7透射电镜成像 对已经抛光的耳蜗切面继续使用超薄切片机(Leica-UC7)切片,切片厚度70纳米,用100目带方华膜铜网捞取3~5张切片,晾干后再经醋酸双氧铀染色7分钟,清洗晾干后拿到透射电镜(FEI TALOS L 120 C)下观察。先在低倍镜下找到目标区域后,再对目标区域进行局部放大,并用4 k×4 k CCD 相机进行拍照(加速电压120 kV)。
2 结果
按照改进后的电镜块染方法制备得到的耳蜗样品在X射线显微镜下表现出良好的均一性和对比度(图1a、b)。亚微米的扫描体素大小(0.7 微米)使外毛细胞可在横断面方向进行自动峰值信号检测,实现细胞的自动计数(图1c)。
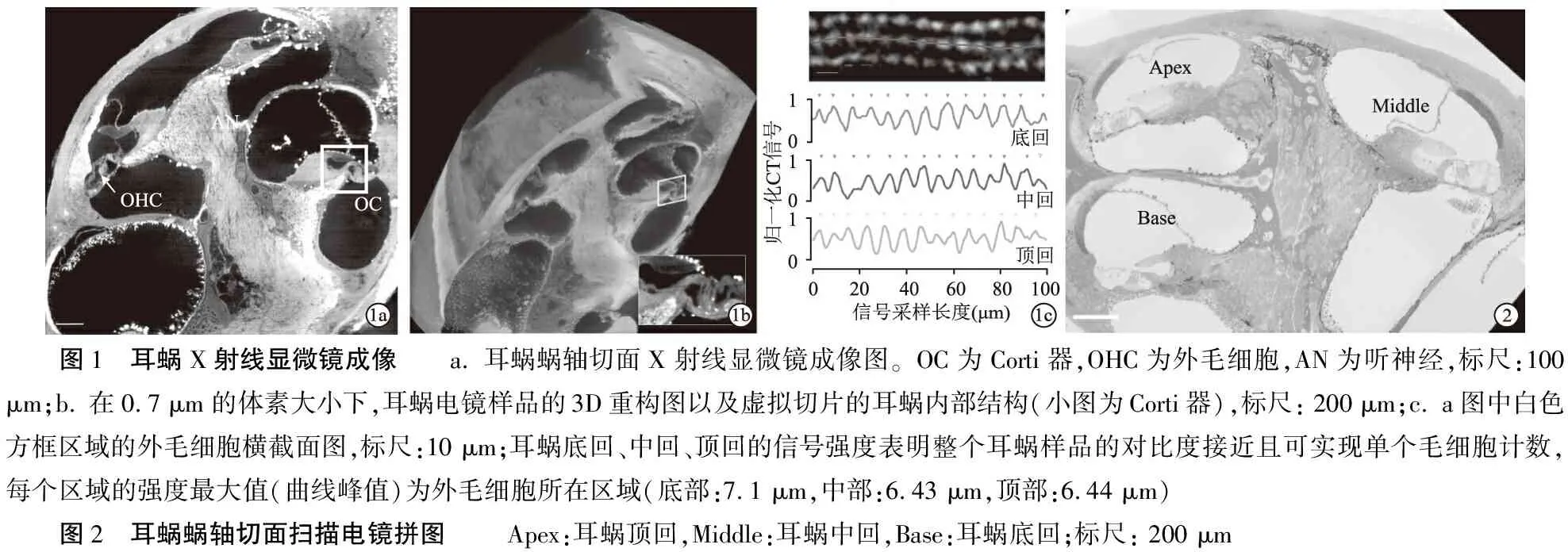
图1 耳蜗X射线显微镜成像 a. 耳蜗蜗轴切面X 射线显微镜成像图。OC为Corti器,OHC为外毛细胞,AN为听神经,标尺:100 μm;b. 在0.7 μm 的体素大小下,耳蜗电镜样品的3D重构图以及虚拟切片的耳蜗内部结构(小图为Corti器),标尺: 200 μm;c. a图中白色方框区域的外毛细胞横截面图,标尺:10 μm;耳蜗底回、中回、顶回的信号强度表明整个耳蜗样品的对比度接近且可实现单个毛细胞计数,每个区域的强度最大值(曲线峰值)为外毛细胞所在区域(底部:7.1 μm,中部:6.43 μm,顶部:6.44 μm) 图2 耳蜗蜗轴切面扫描电镜拼图 Apex:耳蜗顶回,Middle:耳蜗中回,Base:耳蜗底回;标尺: 200 μm
由于X射线显微成像是无损的,然后,样品可使用扫描电镜进行背反射电子成像,拼接后的高分辨大视野图像(图2)再次验证了样品良好的染色均一性。进一步放大局部,听神经上髓鞘(图3a),内毛细胞内带状突触(图3b)以及外毛细胞顶部纤毛(图3c)均清晰可见,且图像具有较好的对比度,可满足形态学分析。
该方法制备的耳蜗样品同样适用于透射电镜成像(图4),可见,样品中听神经髓鞘层状结构(图4a)、传出突触中突触囊泡及线粒体(图4b)以及外毛细胞顶端纤毛结构同样清晰可见(图4c)。
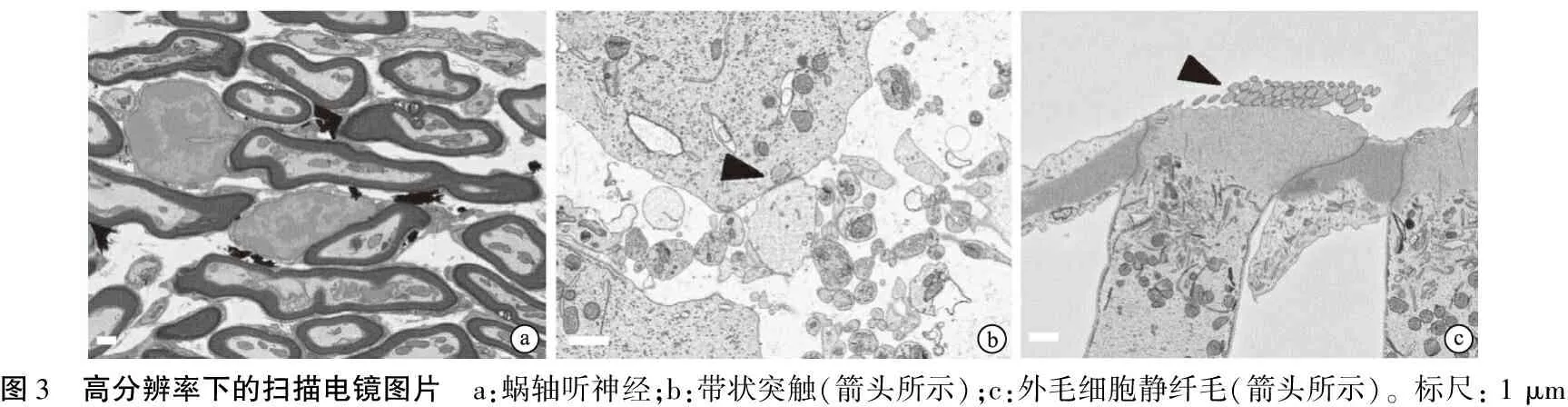
图3 高分辨率下的扫描电镜图片 a:蜗轴听神经;b:带状突触(箭头所示);c:外毛细胞静纤毛(箭头所示)。标尺: 1 μm
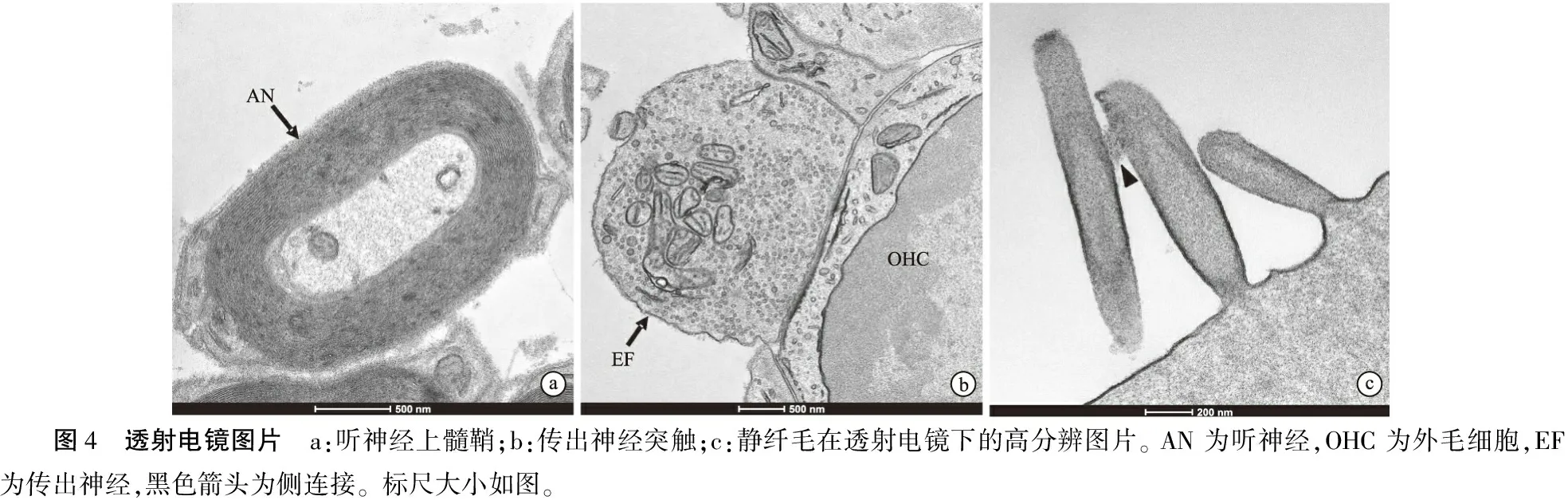
图4 透射电镜图片 a:听神经上髓鞘;b:传出神经突触;c:静纤毛在透射电镜下的高分辨图片。 AN 为听神经,OHC 为外毛细胞,EF 为传出神经,黑色箭头为侧连接。标尺大小如图。
3 讨论
电镜成像广泛运用于生命科学研究,制样的质量直接影响到成像和后期对结构细节的解释。与其它生物样品相比,耳蜗组织的制备难度更大,其主要原因在于其为坚硬的骨质包裹及内部大量的空腔结构,阻碍了染料的渗透和树脂包埋的均一性。虽然长时间脱钙可以增加结构的通透性,但容易导致细胞膜和细胞骨架结构的破坏。而内耳结构的电镜研究需解剖分离出目标组织进行样品制备,增加了样品机械性损伤的风险,且不可避免地破坏了组织的三维结构。
近期高通量三维电镜成像技术[18]的出现,提高了大尺寸脑组织的三维重构的可行性[10,12,19],已应用于模式动物以及临床样品,如视网膜、大脑、脊椎等[13,16,20,21],但耳蜗神经回路相关的三维电镜研究目前还是空白。本研究在总结前期工作的基础上[3,11,22~26],根据耳蜗的结构特点进行了一系列改进和优化:首先,在低温下通过圆窗和卵圆窗对耳蜗进行混合固定剂的灌注,固定过程中最大程度的降低细胞活性;其次,耳蜗在经过4小时的充分固定后再进行脱钙,这样在增加样品通透性的同时减少了细胞膜结构的破坏[22]。另外,还针对小鼠耳蜗的尺寸,相应延长块染、脱水以及树脂包埋的时间,确保样品染色和树脂包埋的均一性[7]。通过上述改进方法所制备的样品具有优异的染色对比度,利用小型X射线显微镜,实现了毛细胞分辨率的全耳蜗三维成像,获得了过去需要借助更强大的同步辐射器光源才能得到的类似实验结果[27,28],显著降低了实验成本。同时X射线显微镜可以对样品进行无损的快速预扫,从而评估样品的质量以及立体定位目标区域[29]。
本研究采用扫描和透射电镜对得到的样品中各个特征部位进行了观察,图像质量均达到超微结构解析的要求。后期将尝试利用三维电镜对耳蜗组织进行重构,获取包括各类听神经的连接方式、带状突触形态、线粒体分布等一系列结构信息,用于声音编码机制的研究。前期研究表明,水杨酸盐诱导的耳鸣[30]以及噪声暴露造成的隐性听力损失都和耳蜗神经回路中的突触可塑性有着密切的关系。耳蜗神经回路的三维结构解析将帮助人们进一步揭示能量及代谢相关结构可能存在的改变,如线粒体[15]、自噬小体[31]和多泡体,来锁定相关信号通路。
