改进TRIzol法提取不同发育时期海葵的总RNA
2020-06-03代亚坤高炳淼
袁 琳, 代亚坤, 高炳淼
(海南医学院 药学院/热带转化医学教育部重点实验室/海南省热带药用植物研究开发重点实验室, 海南 海口 571199)
海葵(Sea anemone)又名海菊花,属腔肠动物门珊瑚虫纲六放珊瑚亚纲海葵目[1],是原始海洋生物。现代药理研究表明,海葵毒素具有免疫调节、抗菌、降血压[2]、强心[3]、抗寄生虫[4]和抗肿瘤[5]等药理活性。海葵资源的研究前景广阔,不仅可食用、药用,还可向化工、饲料、农药、化妆品等方向转化和应用[6]。获得纯度高、完整性好的高质量RNA是南海海葵进行分子生物学研究的重要前提[7],对c DNA文库构建和转录组测序等的深入研究具有重要意义,提高RNA纯度及经济快捷获得足量的RNA是当前受到关注的问题。
目前,传统提取RNA的方法有热酚法[8]、Trizol法[9]、异硫氰酸胍法[10]、氯化胍法[11]、CTAB法、SDS法等,但没有一种RNA提取方法适用于所有的生物。对海葵的研究主要集中在海葵毒素的提取分离、化学合成、药理活性等方面,国内少见关于海葵RNA提取分离方面的报道。因此,以南海海葵为研究对象,采用改进TRIzol法[12]提取海葵不同发育时期的总RNA,经琼脂糖电泳和Agilent 2100生物分析仪检测 RNA的完整性和纯度,获得海葵纯度高、完整性好的高质量RNA,以期为海葵高通量转录组测序等分子生物学的深入研究提供基础,也为其他海洋生物RNA的提取提供参考。
1材料与方法
1.1材料
1.1.1样品材料不同发育期的海葵,采自南海海域,经鉴定为套膜海葵(Aiptasiapallida),选择早中晚3个发育时期的海葵各1只,样品名称分别为海葵-小、海葵-中和海葵-大。海葵样品经去离子水冲洗干净,于-80℃冰箱冷冻储存备用。
1.1.2试剂DEPC和TRIzol试剂盒(赛百盛公司),RNA locker和RNA down(天泽基因工程有限公司),RNase Inhibitor(TaKaRa公司),其他试剂均为分析纯。
1.1.3仪器Agilent 2100生物分析仪(美国安捷伦公司),Nano Drop TM 2000分光光度计(Thermo Fisher,USA),电泳仪(凝胶成像仪为美国伯乐公司)。
1.2方法
1.2.1海葵总RNA的提取采用改进TRIzol一步法提取不同发育期海葵的总RNA[12]。具体步骤:将海葵放入冷的600 μL RNA locker中,静置1 min后匀浆;将匀浆液充分震荡,室温静置10 min;加入300 μL氯仿,充分震荡,室温静置后离心;异丙醇沉淀 RNA时,加入5 μL的RNA down,再加入500 μL的异丙醇,振荡后于20℃静置 30~60 min后离心;75%乙醇洗涤,室温干燥RNA沉淀;加入适量DEPC处理水(含RNase Inhibitor,终浓度为0.2 U/μL),4℃下溶解2~6 h后于-70℃保存。
1.2.2总RNA的初步检测分别取海葵-小、海葵-中、海葵-大RNA样品与溴酚蓝上样缓冲液混合,加入含Goldview的1.0%琼脂糖凝胶,180V电泳16 min,然后用凝胶成像仪拍照保存。
1.2.3总 RNA的质量检测将RNA样品在冰上融化,混匀后4℃离心。分别取RNA提取液各1 μL,稀释100倍后,Nano Drop TM 2000分光光度计检测总RNA的纯度(OD260/280)和浓度[13]。Agilent 2100生物分析仪对RNA完整性的质量评估参数,能准确而直观地评估RNA样品的质量[13],并筛选出高质量样本,因此,采用Agilent 2100生物分析仪自动检测不同发育时期海葵的总RNA的完整性(RIN值)。质检等级分为A、B、C 3个等级, A级指质量满足建库测序要求,且总量可满足2次或2次以上建库需要的样品;B级指质量满足建库测序要求,且总量满足1次但不足2次建库需要的样品;C级指质量/总量不完全满足建库测序要求,可以风险建库,但不保证测序样品的质量。28S/18S为衡量提取的RNA降解情况及完整性的指标,28S/18S在1.8~2.0则表明所提取RNA基本无降解发生,且完整性较好。
2结果与分析
2.1改进TRIzol法提取海葵总RNA的效果
由图 1可知,3个发育时期的海葵总RNA的28S和18S条带清晰,5S条带模糊。28S条带较18S条带更明亮。28S条带与点样孔间无明显亮带,说明无DNA污染条带[14]。初步检测说明,采用改进TRIzol法提取海葵总RNA的琼脂糖电泳结果较好,改进TRIzol法能有效提取海葵不同发育时期的总RNA。
注:M为低分子量蛋白Marker;1、2和3分别表示海葵-大、海葵-中和海葵-小的总RNA条带。
Note: M, Marker; 1, 2 and 3 indicate total RNA bands in large, medium and small sea anemones respectively.
图1 改进TRIzol法提取海葵总RNA的效果
Fig.1 Total RNA extraction from sea anemone by improved TRIzol method
2.2海葵总RNA的质量
从表1可看出改进TRIzol法提取不同发育时期海葵总RNA的质量。
2.2.1浓度改进TRIzol法提取不同发育时期海葵总RNA的浓度以海葵-中最大,为357 ng/μL;海葵-大其次,为335 ng/μL;海葵-小最低,为232 ng/μL。
2.2.2 纯度海葵-小、海葵-中和海葵-大总RNA的OD260/280值分别为2.071、1.983和1.981,依据纯RNA的标准(1.9 2.2.3完整性海葵-小的RIN值较小,为6.4;28S/18S为1,与1.8~2.0相差较大;质检等级为C。说明海葵-小的完整性不合格,纯度较低,有轻微杂质污染,其质量或总量不完全满足建库测序要求,可以风险建库,但不能保证测序样品的质量。海葵-中与海葵-大的RIN值分别为7.3和8.8,均大于7;28S/18S分别为2.4和1.9,均大于1.8;质检等级均为A。说明,海葵-中和海葵-大的总RNA完整性较高,总RNA的质量满足建库测序要求,且总量可满足2次或2次以上建库需要的样品,可用于进行后续试验。 表1 改进TRIzol法提取不同发育时期海葵总RNA的质量 随着分子生物技术在生物学、医学等方面的广泛应用,RNA提取已成为研究基因表达、克隆目的基因等的一项基本试验技术。高质量RNA的提取,是后续RT-PCR、Northern blot、c DNA文库构建等正常进行的必要前提[15]。动物组织RNA的提取技术已非常成熟,已有大量研究者利用各种方法和商业化试剂成功提取高质量的RNA[16-17]。由于RNA非常不稳定,易降解,且RNA酶的存在使得提取完整性好、质量高的RNA变得尤其重要[18]。因此,有效抑制RNA酶活性及去除蛋白质和DNA的污染是获得高质量RNA的关键[19]。热酚、TRIzol等传统提取RNA的方法可很好地提取微生物和动物组织的RNA[20],其中,TRIzol法是用于提取少量组织总RNA的经典方法,但传统TRIzol法提取总RNA效果较差,RNA易降解,改进TRIzol法能有效提高RNA产率,减少RNA降解,延长RNA储存时间[12]。 采用改进TRIzol法提取不同发育时期海葵的总RNA,并对其质量进行检测。结果表明,中晚期海葵总RNA的OD260/280值约为2.0,纯度较高,是高质量RNA的标志[17]。采用改进TRIzol法所提取的海葵RNA条带整齐、清晰,海葵-大与海葵-中的总RNA完整性较好,RIN值分别为8.8和7.3,海葵-大与海葵-中的带型呈现28S∶18S约为2∶1,说明RNA基本无降解,且完整性好[21]。采用Nano Drop TM 2000分光光度计对总RNA纯度(OD260/280)的检测、Agilent 2100生物分析仪质量检测与电泳检测均强有力地支持以上结果。 综上,采用改进TRIzol法提取不同发育期海葵总RNA的浓度高、纯度和完整性较好,改进TRIzol法能有效提取海葵不同发育时期的总RNA,满足转录组测序等分子生物学试验要求,可为海葵进行高通量转录组测序等分子生物学试验提供基础,同时也可为海洋动物RNA的提取提供参考。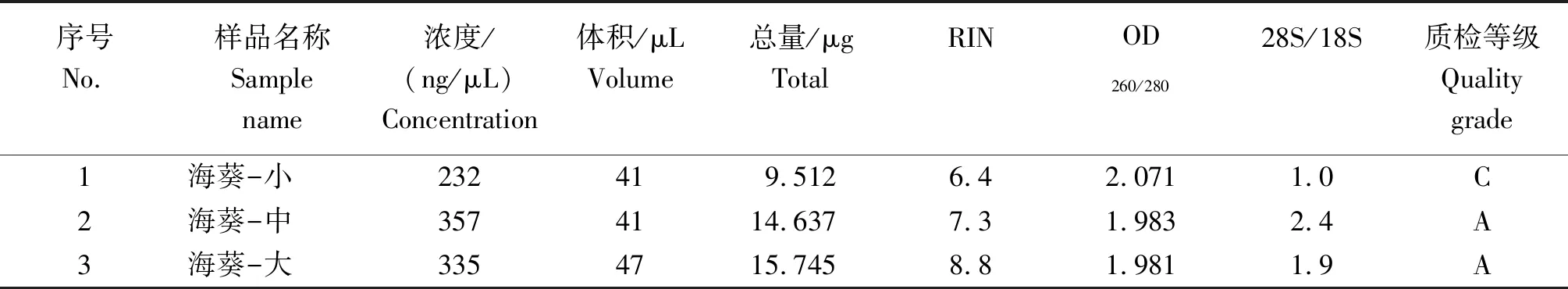
3结论与讨论
