白果壳遗态Fe2O3/Fe3O4/C复合材料的制备及其对Sb(Ⅲ)的去除性能
2020-06-02刘桂凤朱宗强朱义年高莹莹张立浩
刘桂凤,莫 超,朱宗强,朱义年,高莹莹,张立浩
(桂林理工大学 a.岩溶地区水污染控制与用水安全保障协同创新中心; b.广西环境污染控制理论与技术重点实验室,广西 桂林 541006)
0 引 言
我国每年的锑产量超过世界总产量的90%,采矿业等发展造成的锑污染受到广泛关注[1-2]。大部分含锑化合物对人类健康和生态系统具有不良影响[3],美国国家环保署(EPA)和欧盟(EU)已将其列为优先控制污染物[4-6]。 锑在还原条件的水环境中主要以Sb(OH)3、Sb(OH)4-、Sb(OH)2+等Sb(Ⅲ)的形式存在[7],其毒性约为Sb(Ⅴ)的10倍; Sb(Ⅲ)对人体红细胞具有很强的亲和性,而Sb(Ⅴ)几乎不进入红细胞[8-10]。去除水中锑的方法有吸附法、化学沉淀法、离子交换法、膜分离法、反渗透法等,吸附法因效果佳、速度快而被广泛应用,但吸附剂的制备与性能是制约其应用的关键[11-12]。
以植物为模板制得具有水质净化功能的植物遗态材料国内外均有文献报道。Islam等[13]以棕榈为模板,通过NaOH水热改性和600 ℃绝氧焙烧处理制得棕榈遗态材料,考察了其对亚甲基蓝的吸附行为;Wang等[14]以山核桃木为模板,通过KMnO4改性制备获得山核桃木遗态材料,探讨了其对水中铅、铜和镉的吸附行为;高欢等[15]以小麦秸秆为模板,通过乙酰化改性制备获得麦秆遗态材料,并研究了其对水中六价铬的吸附行为;Li等[16]以甘蔗叶为模板,制备甘蔗遗态结构/LDH复合材料,应用于水中磷酸盐的去除;何昭菊等[17]利用柚子皮制备活性炭,对刚果红表现出了良好快速的吸附效果。
白果壳是白果加工过程中的废弃物,每年约有3万t直接丢弃,造成环境污染和资源浪费[18]。 白果壳质地坚硬,是天然的介孔材料模板,白果壳炭孔隙发达、比表面积大、化学稳定性和热稳定性好,是植物遗态材料结构原材料的良好选择[19]。 同时在结构上有—COOH、—OH等能与重金属络合的基团,是一种优良的重金属吸附剂[20-21]。 本文以白果壳为遗态结构模板,以硝酸铁为改性剂,制备了一种具有白果壳天然分级多孔结构的铁改性吸附材料,并探究其对水中Sb(Ⅲ)的净化机理,以期为控制水中锑污染提供技术应用参考。
1 材料与方法
1.1 试验材料
Sb(Ⅲ)储备液用酒石酸锑钾(优级纯)配制,氨水、硝酸铁、乙醇、盐酸、砷酸钠、抗坏血酸、硫脲、氢氧化钾和硼氢化钾为分析纯,以上均购自国药集团化学试剂有限公司。试验用水均为超纯水。
1.2 吸附剂制备
开孔白果壳经硝酸铁循环浸渍、干燥和焙烧等工序获得吸附剂Fe/C-G, 具体制备方法: ① 准确称取246.1 g硝酸铁溶于1 L乙醇-超纯水(体积比为1∶1)中,得到0.6 mol/L的硝酸铁前驱液; ② 将抽提后的白果壳浸渍于前驱液中,在60 ℃的恒温水浴中浸泡5 d,然后用超纯水洗净,60 ℃下干燥24 h,浸泡、清洗、干燥循环3次;③ 将最终干燥后的产物置于马弗炉中,于300 ℃下焙烧2 h,冷却至室温,对炭化后产物研磨,过150 μm (100目)筛,即获得吸附剂Fe/C-G。
1.3 材料表征
使用比表面积及孔隙度自动分析仪(NOVAe1000,Quantachrome,USA)测定Fe/C-G的比表面积与孔径分布; XRD图谱利用荷兰帕纳公司的X射线衍射仪(X’Pert PRO)获得; 表面形貌及元素利用日本日立公司的扫面电子显微镜及能谱仪(JSM-6380LV)进行检测; 采用傅里叶红外光谱仪(470 FT-IR)测定所制备样品的红外光谱,采集范围为4 000~400 cm-1,用ESCALAB 250 XI光电子能谱仪(Thermo,USA)进行X射线光电子能谱分析。
1.4 吸附锑试验
向100 mL的离心管中加入50 mL一定初始浓度的Sb(Ⅲ)溶液,用NaOH或HNO3溶液调节pH,吸附剂粒径<150 μm,投加量为4 g/L,在25 ℃、150 r/min的恒温振荡器中振荡24 h。 水样过0.22 μm的滤膜,使用原子荧光分析仪测定滤液中的Sb(Ⅲ)浓度,依据吸附前后污染物的浓度差值计算Fe/C-G对Sb(Ⅲ)的吸附量。
2 结果与分析
2.1 吸附材料的表征分析
2.1.1 比表面积及孔结构分析 用压汞法测定改性前后白果壳炭的比表面积及孔径分布,结果见表1。
Fe/C-G的比表面积、孔容和平均孔径分别为46.42 m2/g、0.38 cm3/g和40.20 nm,均小于白果壳炭。 结合SEM图(图1)分析,由于大量的Fe及其化合物覆盖在白果壳的表面和孔隙内,堵住了白果壳本身的一些微孔,从而使其比表面积、比孔容和平均孔径减小。 此外,相关研究表明,二价铁氧化物能扩散到炭纤维的内孔中,对炭纤维的比表面积、孔体积及孔隙率有一定的影响[22]。
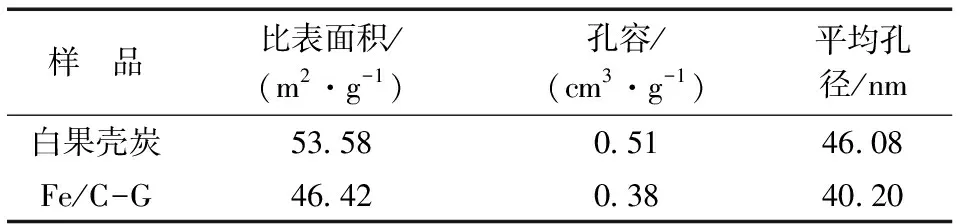
表1 白果壳改性前后孔隙结构参数Table 1 Pore structure parameters before and after modification of ginkgo shell

图1 白果壳炭(a)和Fe/C-G(b、c)的SEM图Fig.1 SEM photographs of charred ginkgo shell(a)and Fe/C-G(b,c)
采用BET法对粒径小于150 μm的Fe/C-G材料的孔径分布进行分析,测出Fe/C-G的比表面积为66.63 m2/g,孔容为0.15 cm3/g,平均孔径为9.26 nm。从图2中可看出,Fe/C-G的孔径主要分布在3~14.1 nm,属于介孔范围(2~50 nm),约占91%,表明Fe/C-G是一种介孔材料。
2.1.2 XRD分析 白果壳炭改性前后的XRD图谱见图3,改性前后的白果壳均在23°、43°附近出现了较宽的C衍射峰[23]; 改性后的白果壳在30.34°、35.60°、43.23°、54.12°、57.38°、62.76°处的特征峰分别对应Fe3O4的(220)、(311)、(400)、(422)、(511)和(440)特征峰,Fe3O4属尖晶石结构,比表面积大、表面的原子配位不足、化学反应活性较高,表面具有络合重金属和阴离子的

图2 Fe/C-G的孔径分布Fig.2 Pore size distribution of Fe/C-G

图3 白果壳炭和Fe/C-G的XRD图Fig.3 XRD spectrograms of charred ginkgo shell and Fe/C-G
亲和力[24-25]。 24.19°、33.23°、35.60°、40.73°、49.48°、54.12°、57.38°、62.76°和63.88°处的衍射峰均属于α-Fe2O3的特征峰,这与JCPDS 33-664标准卡片的谱峰吻合[26]。
2.1.3 SEM/EDS分析 由白果壳炭(图1a)和Fe/C-G(图1b、c)的扫描电镜图可见,Fe/C-G未出现明显的孔隙堵塞、皱缩和形态畸变的情况,很好地保留了白果壳的遗态结构[27]。同时,Fe/C-G材料的孔壁及周围均覆盖有一层Fe及其化合物,结合图1c中的立方晶体及XRD表征结果,说明该类物质为α-Fe2O3和Fe3O4。 Fe/C-G具有丰富的孔结构,可提供活性点位的构架,提升α-Fe2O3和Fe3O4的比表面积。 孔内和表面的铁氧化物具有高的比表面积和表面电荷,有利于提高其对金属离子的吸附性能[28-30]。
通过能谱仪在Fe/C-G上选取测试点(图4)可看出, 在图谱所选的3个位置均检测到了C、Fe和O元素,说明Fe成功附着在白果壳上。 Fe/C-G表面元素的含量见表2。 铁氧化合物在白果壳表面及其孔内均匀分布,有利于吸附性能的提高。
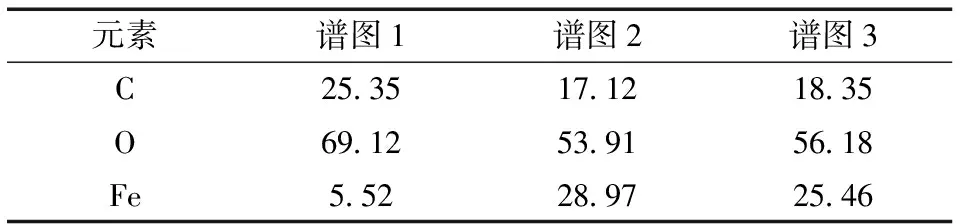
表2 Fe/C-G表面元素含量Table 2 Percentage of chemical elements of the Fe/C-G surface wB/%


图4 Fe/C-G扫描能谱图Fig.4 EDS photographs of Fe/C-G

图5 白果壳炭改性前后FT-IR图Fig.5 FT-IR spectrum of charred ginkgo shell before and after modified
所暴露的活性官能团和吸附位点也更多,从而更有利于对重金属的吸附[38-39]。
2.2 Fe/C-G的锑吸附性能
2.2.1 时间对吸附的影响 采用浓度分别为5、10和50 mg/L,pH调为7的Sb(Ⅲ)溶液为目标水样。在25 ℃、150 r/min,Fe/C-G投加量为4 g/L的条件下反应,于5~1 440 min取样,过滤膜后测定上层清液中Sb(Ⅲ)的浓度,研究时间对Fe/C-G吸附效果的影响。
图6显示了Fe/C-G对锑的吸附量随时间的变化。 锑的初始浓度为5和10 mg/L时,时间对吸附量无明显影响,吸附剂在60 min内即达到吸附平衡,平衡吸附浓度分别为1.23和2.41 mg/g。 锑浓度为50 mg/L时,吸附量在前120 min迅速增加,随后变缓,在300 min后达到吸附平衡,平衡吸附量为9.40 mg/g。 吸附初始阶段吸附量的快速增长可归为吸附质与吸附剂之间范德华力作用。
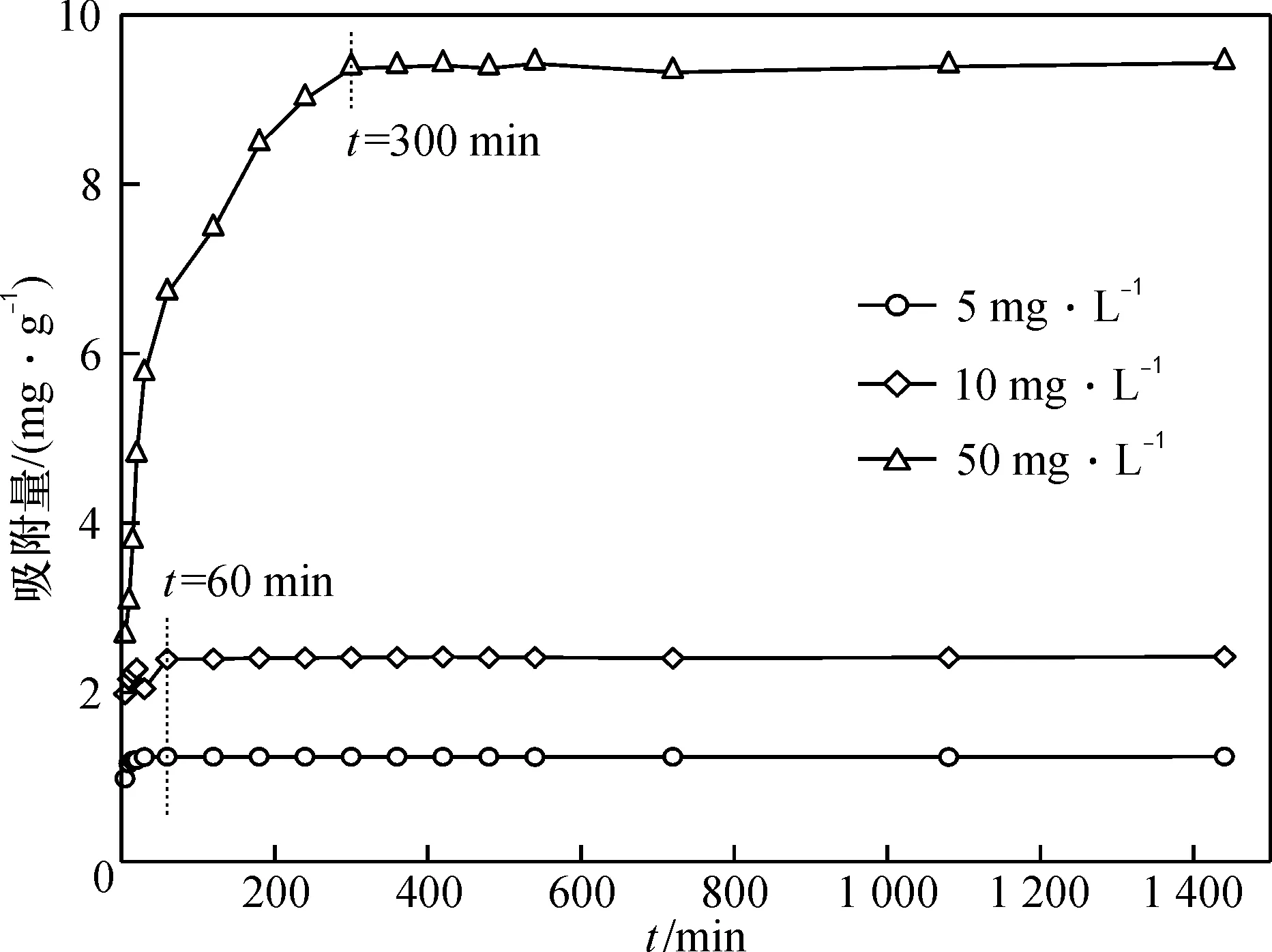
图6 反应时间对Fe/C-G吸附Sb(Ⅲ)的影响Fig.6 Effect of time on the adsorption of Sb(Ⅲ) by Fe/C-G
初始浓度不同导致吸附量随时间变化的不同,其原因可能是: 当锑浓度较低时,Fe/C-G中大量的含氧官能团及铁氧化物与锑迅速发生络合作用将其捕获在材料表面; 而锑浓度较高时,大量的金属离子快速将吸附剂表面的位点占满后,逐渐向Fe/C-G孔内迁移,直至吸附剂孔内管道吸附达到平衡。
2.2.2 溶液初始pH对吸附的影响 向一系列100 mL离心管中加入浓度分别为5、10和50 mg/L的50 mL含Sb(Ⅲ)模拟水样,先将3组浓度下的溶液初始pH均调至1、2、3、4、5、6、7、8、9和10, 然后分别投加0.2 g Fe/C-G吸附剂, 最后置于25 ℃、150 r/min的振荡器中振荡至吸附平衡,取样过滤,分别测定滤液中的Sb(Ⅲ)浓度。 相同条件下,不投加吸附剂设置空白试验进行对照,考察不同pH 条件下Sb(Ⅲ)自身的沉淀情况。 对于空白试验,各pH值下的Sb(Ⅲ)浓度与其对应的原始溶液中Sb(Ⅲ)浓度几乎相等,结果如图7所示,说明模拟废液中Sb(Ⅲ)浓度的降低完全由Fe/C-G吸附引起,而非其自身沉淀导致。

图7 不同pH条件下Fe/C-G吸附剂对Sb(Ⅲ)的沉淀效果Fig.7 Precipitation effect of Sb(Ⅲ) under different pH conditions
溶液初始pH值对Sb(Ⅲ)去除效果的影响如图8所示。 Fe/C-G对5、10 mg/L的Sb(Ⅲ)溶液的吸附量和去除率变化不大,吸附量和去除率分别稳定在1.24 mg/g、96.78%和2.4 mg/g、74.95%。 当Sb(Ⅲ)的初始浓度为50 mg/L,初始pH值为7时,Fe/C-G对Sb(Ⅲ)的吸附量和去除率均达最大值。 但总体上, 随着pH值增加,吸附量和去除率趋于平稳。

图8 溶液初始pH对Fe/C-G吸附Sb(Ⅲ)的影响Fig.8 Effect of pH on the adsorption of Sb(Ⅲ)by Fe/C-G
pH为3~10的区域,Sb(Ⅲ)主要以中性分子HSbO2和Sb(OH)3存在,占溶液中总锑的99%以上。 在该pH范围内,水环境中氧化阴离子在氧化物表面上的吸附主要由氧化物的带正电荷的表面和带负电荷的含氧阴离子之间的库仑吸引力驱动[40]。 因此,pH变化对Sb(Ⅲ) 在Fe/C-G上的的吸附效果无影响。
2.2.3 初始浓度对吸附的影响 取一系列50 mL初始浓度为5、10、20、30、40、50、75、100、125、150 mg/L、pH=7的Sb(Ⅲ)水样装入离心管中,同时加入0.2 g Fe/C-G吸附剂, 密封后分别于25、35和45 ℃下水浴恒温振荡(150 r/min), 取样过滤,测定滤液中残余Sb(Ⅲ)的质量浓度。
如图9所示,随着温度、Sb(Ⅲ)初始浓度的升高,Fe/C-G对Sb(Ⅲ)吸附量逐渐升高,去除率却逐渐降低。 在试验浓度范围内,污染物浓度越高,吸附剂活性位点接触金属离子的概率越大,吸附量越大。温度对吸附效果的影响较大,45 ℃时Fe/C-G对Sb(Ⅲ)的吸附量和去除率均高于25、35 ℃的,说明适当的升高温度有利于Fe/C-G对Sb(Ⅲ)的去除。
2.2.4 吸附剂粒径和种类对吸附的影响 将50 mL浓度分别为5、10和50 mg/L的含锑水样加入离心管中,pH调至7,不同浓度的水样依次加入0.2 g不同粒径的Fe/C-G(830~380 μm、380~250 μm、250~185 μm、185~150 μm、<150 μm及块状Fe/C-G)、未改性的白果壳炭(<150 μm)和活性炭,分析等量条件下Fe/C-G吸附剂粒径大小对Sb(Ⅲ)吸附效果的影响。

图9 初始浓度对Fe/C-G吸附Sb(Ⅲ)的影响Fig.9 Effect of initial concentration on the adsorption of Sb(Ⅲ) by Fe/C-G
从图10中可看出,Fe/C-G的粒径大小对50 mg/L的Sb(Ⅲ)的去除效果具有较为显著的影响,而对5、10 mg/L的Sb(Ⅲ)的去除效果无明显影响; 同时,块状Fe/C-G对Sb(Ⅲ)的去除效果均低于粉末状Fe/C-G的。 等量吸附剂下,Fe/C-G的粒径变小,Sb(Ⅲ)去除率提高; 但当粒径减小到一定范围后,随着吸附剂粒径减小,其对高浓度Sb(Ⅲ)的去除效果呈降低趋势。 因此,适当地减小Fe/C-G的粒径有助于增加材料的比表面积,但当粒径过小,颗粒间可能是由于发生团聚导致材料孔隙堵塞,比表面积减小,从而减弱其对Sb(Ⅲ)的吸附。
相同条件下,将改性前后的材料以及活性炭对Sb(Ⅲ)的吸附效果进行对比,试验表明,Fe/C-G(<150 μm)复合材料的吸附效果远优于未改性粒径相当的白果壳炭粉(<150 μm),由于Fe/C-G
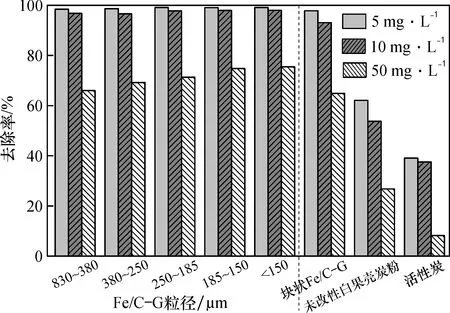
图10 吸附剂种类及粒径对Fe/C-G吸附Sb(Ⅲ)的影响Fig.10 Effect of adsorbent and particle size on the adsorption of Sb(Ⅲ) by Fe/C-G
表面铁氧化物的负载引入,其去除率和吸附量约提高了3倍。 Fe/C-G对5、10和50 mg/L的Sb(Ⅲ)的去除率分别从62.11%、53.73%和26.78%上升到99.17%、98.03%和75.49%。 3种材料去除Sb(Ⅲ)的能力大小顺序为: Fe/C-G>未改性白果壳炭粉>活性炭,说明Fe/C-G是一种去除Sb(Ⅲ)的优良吸附剂,复合材料中铁氧化物主要起吸附作用,白果壳炭主要起材料结构支撑作用、增大复合材料中铁氧化物的比表面积,从而提升其吸附性能。
2.2.5 吸附动力学模型 采用准一级动力学模型和准二级动力学模型拟合吸附动力学数据。
准一级动力学模型
ln(qe-qt)=lnqe-K1·t,
(1)
准二级动力学模型
t/qt=1/(K2qe2)+t/qe,
(2)
式中:qe为平衡吸附量,mg/g;qt为t时刻的吸附量,mg/g;K1为准一级动力学速率常数,min-1;K2为准二级动力学速率常数,g/(mg·min)。
表3为准一级和准二级动力学模型对Fe/C-G(<150 μm)去除Sb(Ⅲ)的拟合结果。 可见,准二级动力学模型能更好地描述Fe/C-G对Sb(Ⅲ)的去除,3种浓度下R2分别为1.000、1.000和0.999, 拟合饱和吸附量分别为1.24、2.42和9.60 mg/g,与实验结果接近,说明Fe/C-G对Sb(Ⅲ)的吸附为表面不均匀的多步吸附,吸附主要被化学反应控制。
2.2.6 吸附等温线模型 通过改变Sb(Ⅲ)溶液的初始质量浓度为5、10、20、30、40、50、75、100、125、150 mg/L,pH调为7,在25、35和45 ℃下研究Fe/C-G(<150 μm)去除锑的吸附等温线变化规律。利用Langmuir和Freundlich吸附模型拟合Fe/C-G的吸附等温线。
Langmuir吸附模型
qe=(qmKLCe)/(1+KLCe),
(3)
Freundlich吸附模型
qe=KFCe1/n,
(4)
式中:qe为平衡吸附量,mg/g;qm为最大吸附量,mg/g;Ce为平衡时的溶液质量浓度,mg/L;KL是与吸附能有关的Langmuir吸附常数;KF和1/n为Freundlich吸附常数。
Langmuir和Freundlich等温吸附模型拟合参数如表4所示。

表3 Fe/C-G吸附动力学拟合参数Table 3 Kinetics parameters for adsorption of Fe/C-G

表4 Fe/C-G的吸附等温线拟合参数Table 4 Isotherm modeling parameters for adsorption of Fe/C-G
3种温度下Langmuir吸附模型线性相关系数R2分别为0.993、0.988和0.988,均高于Freundlich拟合的R2值,说明Fe/C-G对锑的静态吸附更符合Langmuir等温方程,推测该吸附行为以单分子层物理吸附为主,吸附过程主要发生在材料的表面活性区位。同时,3种温度下Freundlich等温吸附方程参数1/n分别为0.309 2、0.278 8及0.287 6,均在0.1~0.5,表明吸附容易进行,且发生了化学吸附[41-42]。
2.2.7 Fe/C-G与同类材料吸附效果对比 将Fe/C-G对Sb(Ⅲ)的吸附能力与文献中报道的同类型材料进行对比。从表5中可看出,虽然pH、吸附剂投加量等试验条件存在一定差异,但相比其他吸附剂,Fe/C-G对Sb(Ⅲ)具有相对较高的吸附量,同时可达到以废治废的目的,对处理含Sb(Ⅲ)废水具有一定的应用前景。
2.2.8 Fe/C-G对Sb(Ⅲ)的吸附机制 图11为Fe/C-G吸附浓度为150 mg/L的Sb(Ⅲ)溶液前后的XRD谱图,没有发现有新的衍射峰,说明在吸附过程中,Sb(Ⅲ)没有进入氧化铁(Fe3O4/Fe2O3)晶体内部,也没有与Fe/C-G生成新的物相,Fe/C-G对Sb(Ⅲ)的吸附主要是以表面吸附为主。 而Fe3O4和Fe2O3的主峰强度有所降低,这可能是因为部分Fe3O4和Fe2O3溶于水后发生了水合反应,造成铁组分的流失。 所以,可以推断Fe/C-G去除Sb(Ⅲ)有化学吸附作用。
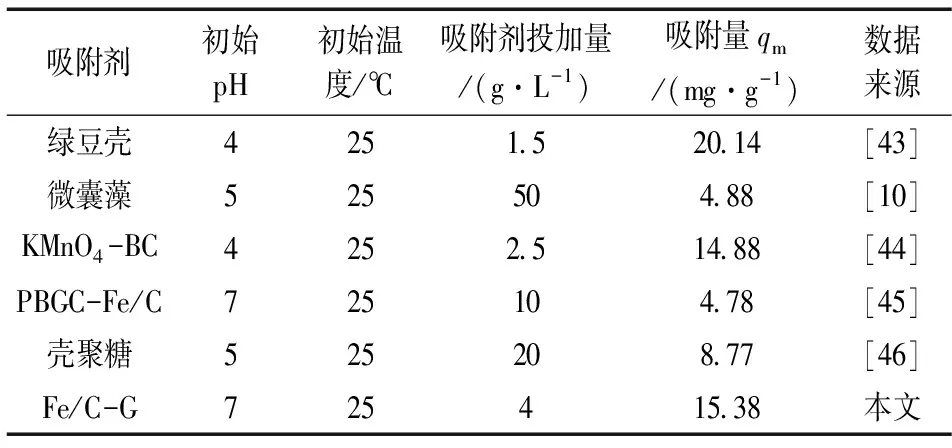
表5 不同吸附剂对Sb(Ⅲ)吸附量对比Table 5 Comparison of adsorption capacity of different adsorbents for Sb(Ⅲ)

图11 Fe/C-G吸附Sb(Ⅲ)前后的XRD图Fig.11 XRD spectrogram of Fe/C-G before and after adsorption of Sb(Ⅲ)


图12 Fe/C-G吸附Sb(Ⅲ)前后的FT-IR图Fig.12 FT-IR spectrum of Fe/C-G before and after adsorption of Sb(Ⅲ)
从Fe/C-G吸附Sb(Ⅲ)前后的XPS全谱图图13可看出,Fe/C-G在吸附Sb(Ⅲ)后结构没有发生变化,只是表面多了Sb3d峰,且与O1s峰重叠,使得O1s峰的强度明显加强。 为了更准确地分析Fe/C-G吸附Sb(Ⅲ)后的化学形态,用XPS PEAK软件对吸附前后的C、O、Fe及Sb元素进行分峰拟合,参照NIST XPS数据库中元素存在的电子形态结合能,得出各元素的存在形态及价态。从图13c中可看出,Fe/C-G在吸附Sb(Ⅲ)后氧化铁中的O1s产生了位移,结合能从527.58 eV增加到529.2 eV,表明吸附Sb(Ⅲ)的过程O发生了化学反应。 根据O1s发生的位移和强度变化式(5)得出,O1s的平均电荷从-1.036 esu上升到-0.930 esu,上升了0.106 esu,说明O在Fe/C-G吸附Sb(Ⅲ)过程中提供电子,使外围的电子密度变小,起Lewis碱作用[48]。 530.12和538.70 eV分别对应Sb 3d5/2和Sb 3d3/2,根据XPS化学状态数据库,Fe/C-G表面的锑以Sb2O5的形式存在,说明Sb(Ⅲ)跟Fe/C-G表面的铁氧化物发生络合反应,同时伴随着Sb(Ⅲ)转化成Sb(V)的氧化还原反应[49-50]。氧的平均负荷电荷数为
Q=-4.372+[385.023-8.976(545.509-EB)]1/2/4.488,
(5)
式中:Q为氧的平均负荷电荷数,esu;EB为实验获得的结合能强度,eV。
Fe/C-G吸附Sb(Ⅲ)前后Fe2p的XPS峰形未发生明显红移,吸附前后结合能只轻微变化1.63 eV,根据式(6)Fe2p的电荷与该结合能的关系

图13 Fe/C-G吸附Sb(Ⅲ)前后的XPS图Fig.13 XPS spectra of Fe/C-G before and after adsorption of Sb(Ⅲ)
得出,Fe/C-G吸附Sb(Ⅲ)后,Fe2p的平均电荷从1.059 esu提高到1.027 esu,只提升了0.032 esu,表面电荷几乎没有变化。宏观上,Fe的价态没有明显的改变,进一步证明Fe/C-G在吸附锑的过程中没有发生明显的电子转移[48],此结果与XRD表征分析的结果一致。
Q=0.323 3X-228.51,
(6)
式中:Q为对应Fe2p能级的平均负荷电荷数,esu;X为实验获得的对应Fe2p结合能强度,eV。
综上,推测复合材料Fe/C-G对Sb(Ⅲ)的吸附过程如下: 在弱碱性条件下,Sb(OH)3跟Fe/C-G表面上的羟基发生反应,有单齿表面配位聚合物生成; 之后,单齿表面配位聚合物进一步和表面的羟基发生反应,生成双齿表面配合物,即Sb(Ⅲ)进一步跟表面的配合物发生氧化还原反应,生成Sb(Ⅴ)[51]。
3 结 论
(1)以白果壳为植物模板、稀氨水为浸煮剂、硝酸铁为前驱体溶液,制备了Fe/C-G属介孔材料,比表面积、孔容和平均孔径分别为46.42 m2/g、0.38 cm2/g和40.2 nm,主要由α-Fe2O3、Fe3O4和C组成,有利于重金属吸附。
(2)pH值对吸附效果无显著影响;Fe/C-G对Sb(Ⅲ)的吸附量随Sb(Ⅲ)初始浓度的增大而增大,而去除率随浓度增大逐渐降低; 升高温度有利于吸附效果的提升; 适当减小吸附剂粒径有利于Fe/C-G对Sb(Ⅲ)的吸附,相比于活性炭,Fe/C-G对Sb(Ⅲ)的去除效果更好。
(3)Fe/C-G对Sb(Ⅲ)的吸附过程符合准二级动力学模型,吸附等温线能很好地用Langmuir方程描述; 在初始Sb(Ⅲ)浓度为5、10和50 mg/L时,计算得到的吸附量分别为1.23、2.41和9.23 mg/g,接近于实验结果。 低浓度的Sb(Ⅲ)(5、10 mg/L)和高浓度的Sb(Ⅲ)(50 mg/L)分别在60 和300 min后达到吸附平衡。
(4)Fe/C-G对Sb(Ⅲ)的吸附包括两部分: Fe/C-G对Sb(Ⅲ)的物理吸附;Fe/C-G表面的氧化铁与锑发生氧化还原反应的化学吸附。
