江南小窖宣酒酿造微生态系统中高产四甲基吡嗪功能微生物的筛选与鉴定
2020-06-02张温清司冠儒汪家胜李井雷周慧佳夏少东郭志忠
张温清 ,司冠儒,梅 婕,汪家胜,李井雷,周慧佳,叶 明,夏少东,程 凡,郭志忠,周 萍
(1.合肥工业大学食品与生物工程学院,安徽合肥 230009;2.安徽宣酒集团股份有限公司科研中心,安徽宣城 242000;3.江南小窖酿造工艺研究所,安徽宣城 242000)
白酒是中国的传统文化饮品,开放式的传统操作工艺是产生其独特风格不可或缺的。研究表明,环境微生物对白酒的酿造具有非常重要的贡献[1]。不同地域环境中酿造微生物产生不同酒的风格。这不但造就了中国白酒目前百花齐放、各美其美的格局,而且也赋予了不同地域的白酒具有不可复制性。同样地,白酒的传统发酵剂——大曲也是在开放性的环境中,通过富集、培养产区环境中的微生物制作而成。
四甲基吡嗪(TTMP),又名川穹嗪,是白酒中重要的风味化合物,也是白酒中的健康功能因子[2]。白酒中TTMP 是酿造微生物在发酵过程中产生的铵和乙偶姻(ACT)经过缩合反应生成。芽孢杆菌是产生白酒中TTMP 的主要一类酿造微生物[3]。筛选产区酿造微生态系统中优质高产TTMP 的功能菌株,制作功能麸曲或直接以强化菌液的形式定向扰动传统的酿造微生物菌群,提高酒体中TTMP 的含量,有利于提高产品品质[4]。
本文以宣酒大曲为研究材料,以高产蛋白酶和TTMP 前体ACT 为筛选标记,分离、筛选、鉴定江南小窖宣酒酿造微生态系统中高产TTMP 的芽孢杆菌,并对其应用进行了初步的研究。
1 材料和方法
1.1 材料、试剂与仪器
菌株分离材料:宣酒高温曲与中高温包包曲。
试剂与耗材:TTMP 和ACT 标准物质,美国西格玛-奥德里奇公司;甲酸(色谱纯)、乙醇(色谱纯)、乙腈(色谱纯)、有机滤膜(0.22 μm),上海安谱科学仪器有限公司;细菌基因组DNA 快速提取试剂盒,上海捷瑞生物公司。其他试剂均为分析纯,购于国药试剂有限公司。
仪器设备:液相色谱-质谱联用仪(HPLC-MS/MS 1260-6460)、色谱柱(ZORBAX Eclipse Plus C18Rapid Resolution 4.6×100 mm 3.5-Micron),美国安捷伦公司;气相色谱-质谱联用仪(GC-MS 7890B-5977A)、毛细管色谱柱J&W VF-WAX(0.25 mm×25 m×0.20 μm),美国安捷伦公司;超纯水仪(A2S-10-CE),美国艾科浦国际有限公司。
1.2 培养基
营养肉汤培养基:牛肉膏5 g,蛋白胨10 g,氯化钠5 g,加水至1000 mL,pH 调至7.2,于115 ℃灭菌25 min。
Voges-Proskauer(V-P)培养基:葡萄糖5 g,蛋白胨5 g,氯化钠5 g,加水至1000 mL,pH 值调至7.2,于115 ℃灭菌25 min。
脱脂牛奶培养基:A 液:牛肉膏3 g/L,蛋白胨10 g/L,NaCl 15 g/L,pH7.2。B 液:脱脂纯牛奶。A液和B 液单独灭菌,115 ℃灭菌25 min,9∶1 混合均匀后使用。
YPG 培养基:葡萄糖70 g,蛋白胨30 g,酵母膏10 g,磷酸氢二铵30 g,加水至1000 mL,pH 值调至7.5,于115 ℃灭菌20 min。
LB 培养基:蛋白胨10 g,酵母浸粉5 g,NaCl 10 g,加水至1000 mL,以115 ℃灭菌20 min。
麸曲培养基:麸皮700 g,豆粕粉300 g,NaOH 4 g,水1 L,115 ℃灭菌25 min。
1.3 实验方法
1.3.1 高产蛋白酶芽孢杆菌的筛选
分别称取5 g 破碎后的高温曲和中高温包包曲粉末,加入装有50 mL 无菌水的250 mL 三角瓶中,振荡1 h。样品悬浮液80 ℃水浴30 min,灭活营养细胞,得到芽孢悬液。吸取上述1 mL 悬液加入到装有50 mL 营养肉汤培养基的250 mL 摇瓶中,37 ℃、160 r/min 培养24 h。将培养液梯度稀释10-1、10-2、10-3、10-4、10-5、10-6后,取0.5 mL 稀释倍数为10-4、10-5、10-6的培养液涂布于固体营养肉汤培养基平板,37 ℃培养48 h。根据平板上菌落的形态差异,挑取具有不同特征的菌落于营养肉汤琼脂培养基平板上划线分离纯化,得到的单菌落分别接种于脱脂牛奶培养基和营养肉汤琼脂斜面,37 ℃培养24 h 后,培养好的斜面4 ℃保存备用。根据脱脂牛奶培养基菌种透明圈直径和菌落直径比值的大小,初步判断产蛋白酶能力的高低。
1.3.2 高产TTMP菌株的初筛
挑选脱脂牛奶培养基上菌株透明圈直径和菌落直径比值较大的菌株接种于V-P 培养基中,30 ℃培养48 h。向装有2 mL 培养液的试管中加入2 mL O’Meara 试剂(含0.3%肌酸的40%NaOH 水溶液),振荡1~2 min,于30 ℃培养箱静置15 min,反应液呈伊红色,表明有乙偶姻或双乙酰产生,分光光度计560 nm 处测定其吸光值。将具有较高A560 的菌株接种于含10 mL YPG 培养基的35 mL试管中,37 ℃恒温培养48 h。取3 mL 培养液于10 mL 离心管中,8000 r/min 离心5 min,收集上清液过0.22 μm水相滤膜,取1 mL左右过滤样品于样品瓶中,HPLC-MS/MS[3-5]测定菌株TTMP 含量,选出产TTMP较高的菌株进行验证及复筛。
1.3.3 高产TTMP菌株的复筛
为了验证各菌株产TTMP 的能力,将初筛的纯化菌株进行YPG 培养基发酵实验。初筛菌株接种至装有10 mL LB 培养基的50 mL 摇瓶中,37 ℃恒温培养24 h。将培养后的培养液作为种子以2%的接种量接入至装有50 mL YPG 发酵培养基的250 mL 摇瓶中,37 ℃,160 r/min 恒温培养120 h。取3 mL 培养液于10 mL 离心管中,8000 r/min 离心20 min,收集上清液,以12%的乙醇稀释1000 倍后,过0.22 μm 有机相滤膜,取1 mL 左右滤液于样品瓶中,HPLC-MS/MS测定各菌株TTMP含量。
1.4 高产TTMP菌株麸曲固态发酵
功能菌株接种至装有10 mL YPG 培养基的50 mL 摇瓶中,37 ℃培养24 h。将培养后的培养液作为种子液以2%的接种量接入装有50 g 麸皮培养基的250 mL摇瓶中,37 ℃培养2.5 d。
适量培养物称重,95 ℃烘干至恒重,计算其含水量。称取固态培养物约5 g,加入12%乙醇50 mL,超声1 h,静置过夜。取上清液10 mL 8000 r/min 离心20 min,过0.22 μm 有机滤膜,供HPLC-MS/MS检测。
1.5 产物分析
样品中TTMP 的测定采用HPLC-MS/MS法[3-5]。样品中ACT 的测定采用GC-MS 法[6]。培养物中酸性蛋白酶测定按GB/T 28715—2012 所述进行[7]。
1.6 菌株鉴定
试剂盒法提取菌株的染色体DNA 送至上海生物工程有限公司进行16s rDNA 和gyrB测序,NCBI比对,确定菌株的种属类别。16S rDNA正向引物5-AGAGTTTGATCCTGGCTCAG-3′,反向引物5′-TACGGCTACCTTGTTACGAC TT-3’。gyrB基因正向引物5′-GAAGTCATCATGACCGTTCTGCAYGCNGGNG GNAARTTYGA-3′,反向引 物5′-AGCAGGGTACGGATGTGCGAGCCRTCNACRTCNGCRTCNGTCAT-3’。
2 结果与讨论
2.1 高产TTMP功能菌株初筛
乙偶姻和铵是TTMP 的前体物质。铵的生成与蛋白酶活力的高低有关,而且蛋白酶也是曲粉的重要质量指标。所以,本研究筛选高产TTMP功能菌株是以蛋白酶和乙偶姻为筛选指标。曲粉中获得的典型特征单细胞菌落接种于脱脂牛奶培养基,挑选透明圈直径与菌落直径比较大的410株菌株,作为下一步V-P 反应的菌株。将产蛋白酶能力较高的410 株菌株接种于V-P 培养基,进行V-P 反应,分光光度计检测。根据A560nm大小,选取40 株较高菌株,接种于YPG 培养基试管中液态发酵,48 h 后,发酵液处理后进行TTMP 的测定。结果见表1,TTMP 产量最高的10 株菌编号分别为XJG-021 43.79 mg/L,XJG-076 38.43 mg/L,XJB-007 30.58 mg/L,XJG-068 28.82 mg/L,XJZ-015 27.37 mg/L,XJB-012 25.82 mg/L,XJZ-042 20.57 mg/L,XJX-011 4.59 mg/L,XJB-104 3.21 mg/L,XJG-015 0.65 mg/L。

表1 各菌株初筛TTMP的产量
2.2 TTMP功能菌复筛——YPG摇瓶发酵
将初筛产量较高的10 株进行YPG 摇瓶水平发酵实验,发酵5 d,结果如表2 所示。产量最高的菌株为XJG-076,TTMP 产量为214.22 mg/L。后续试验证明,将种子培养基LB 换为YPG 时,YPG 摇瓶发酵产TTMP 更高,例如种子培养基为YPG 时,XJB-104 YPG 摇瓶 发酵5 d 产量由146.08 mg/L 提高到0.81 g/L(表3)。ACT 是微生物糖代谢途径上的产物,种子培养基中葡萄糖的添加有利于微生物代谢产生、积累TTMP 的前体ACT,对提高TTMP的产量有益。后续麸曲固态发酵实验种子培养基换为YPG 培养基。TTMP 是ACT 和铵发生自发缩合反应生成的,高温可以加速这一反应生成更多的TTMP[4]。由表3 可知,发酵结束的培养液,95 ℃水浴2 h,可加速培养液中ACT 和铵生成TTMP,如菌株XJB-104 加热后TTMP 产量由0.81 g/L 提高到2.03 g/L。由表2、表3 可知,培养基配方的改变会影响菌株TTMP 的产量,同时不同菌株产生TTMP及其前体的能力是不同的。
2.3 TTMP功能菌株麸曲固态发酵试验
将上述10 株菌株接种于麸曲固态培养基,培养2.5 d,结果见图1,固态发酵条件下TTMP 产量最高的是XJB-104,202.54 mg/kg,达到已报道的出发菌株的较高水平。结合表2 和表3,发现菌株在不同培养基质中产TTMP 的能力是不同的。而且通过图1 还可以得出,蛋白酶和ACT 单独产量高,TTMP 产量不一定高,只有二者均较高时,TTMP 产量才会达到较理想的水平,这也验证了通过蛋白酶和ACT 来筛选TTMP 高产菌株策略的正确性。同时也能反映出表3 中XJB-104 与其他菌株相比,经加热后TTMP 产量增加较多,是因为其具有较强的ACT和铵的生产能力。
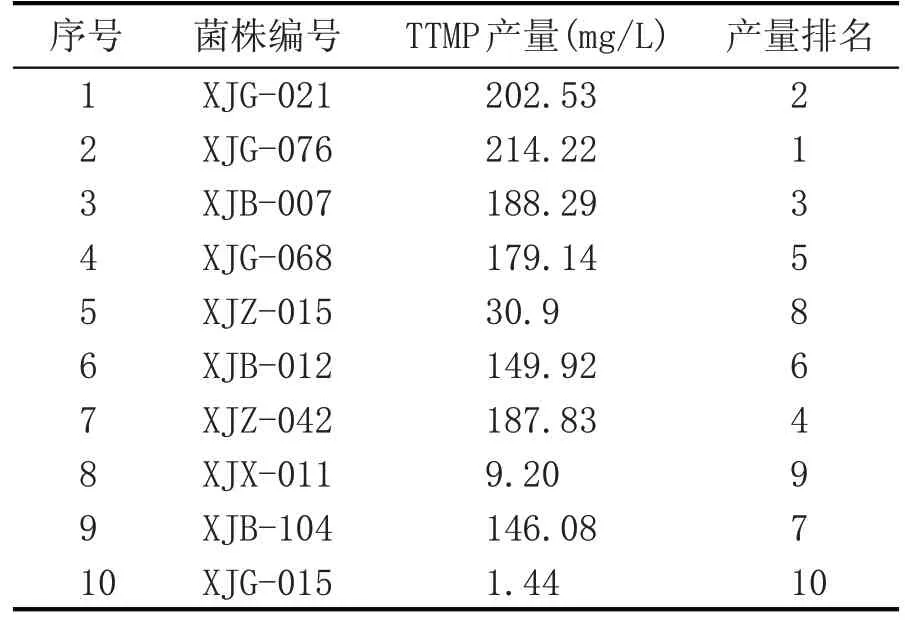
表2 菌株YPG摇瓶水平产TTMP

表3 各菌株YPG摇瓶水平产TTMP(种子培养基为YPG)
2.4 菌株鉴定
将XJB-104 接种于LB 培养基,过夜,试剂盒法快速提取菌株的染色体DNA,送上海生工进行16S rDNA 测序,得到的序列在NCBI 上比对,确定菌株的种属,XJB-104 16S rDNA比对结果见表4。
由表4 可知,XJB-104 与解淀粉芽孢杆菌和枯草芽孢杆菌的相似度都是100%,16s rDNA 的比对结果并不能准确的判定该菌的种属。gyrB 基因是分类及鉴别细菌的新靶标,其结果可以区分XJB-104 是枯草芽孢杆菌还是解淀粉芽孢杆菌,所以XJB-104 gyrB 基因被测序。gyrB 基因的比对结果见表5,根据比对结果,确定该菌株为解淀粉芽孢杆菌,该菌株进而命名为解淀粉芽孢杆菌Bacillus amyloliquefaciensXJB-104。同样的方法对其他高产TTMP的9株菌进行鉴定,结果见表6。
3 结论
本研究以蛋白酶活力和TTMP 前体ACT 为筛选标记,以宣酒大曲为分离材料,筛选了江南小窖宣酒酿造微生态系统中10 株高产TTMP 功能微生物,通过分子生物学进行了种属鉴定,并应用于固态发酵麸曲培养基生产麸曲。解淀粉芽孢杆菌Bacillus amyloliquefaciens XJB-104 麸曲中TTMP 的含量达202.54 mg/kg,可以作为产业化的潜力菌株。

表4 菌株XJB-104 16S rDNA NCBI比对结果

表5 菌株XJB-104 gyrB NCBI比对结果
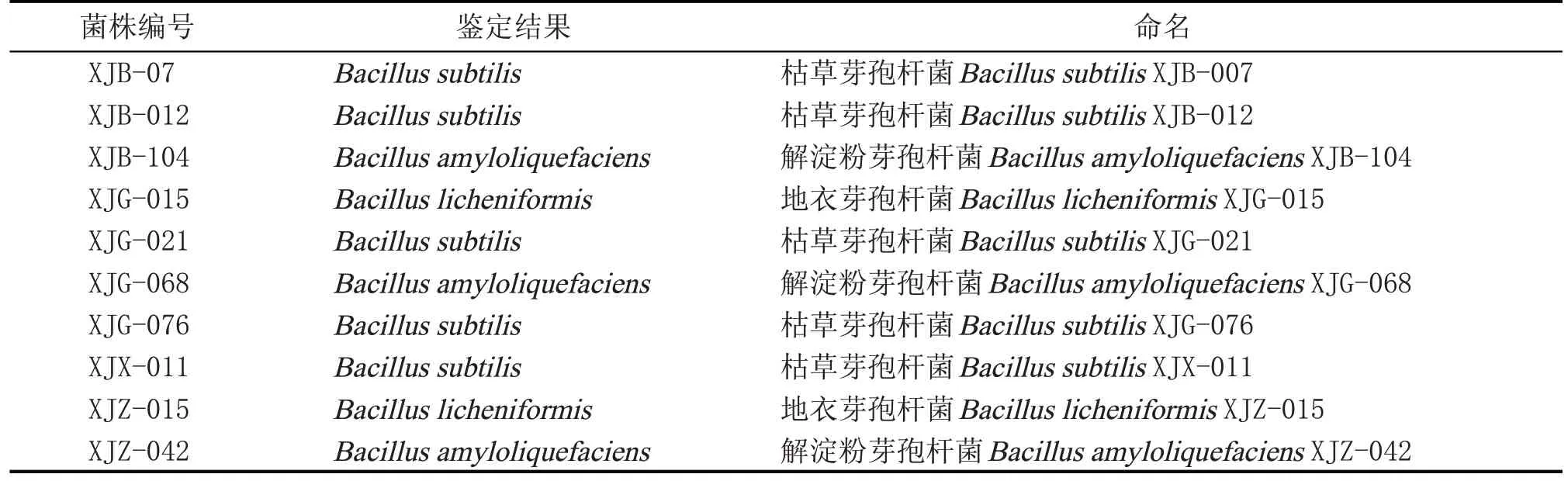
表6 10株TTMP功能菌鉴定结果
