恩替卡韦联合美常安对乙型肝炎肝硬化患者肠道菌群及肠黏膜通透性的影响
2020-06-01裴冬梅沙楠楠黄明星
戚 励,裴冬梅,杨 惠,沙楠楠,黄明星
(1.中国医科大学附属盛京医院 内科,辽宁 沈阳,110004;2.中山大学附属第五医院 感染科,广东 珠海,519000)
乙型肝炎病毒(HBV)是引起乙型肝炎(简称乙肝)的病原体,慢性乙肝在转变为肝硬化的过程中会经历肝纤维化这一阶段,而肝纤维化又是影响患者预后的重要因素[1]。恩替卡韦是一种强效的选择性鸟嘌呤核苷类似物,其在慢性乙肝的治疗中有较好的抗HBV效用[2]。体内外研究[3-4]均已证实,恩替卡韦的抗HBV活性较常用的拉米夫定更强,而且不易产生病毒耐药突变的问题。研究[5]发现,在常规综合治疗的基础上,早期联合应用恩替卡韦能明显抑制肝纤维化的发生和进展,改善患者肝功能,降低病死率。近年来研究[6-8]发现,乙肝患者肝硬化进程中往往因为HBV的持续存在而合并肠道菌群紊乱和肠黏膜屏障功能受损,导致内毒素在体内不断积累,导致肝脏损伤严重,应多考虑应用能改善肠道菌群紊乱和肠黏膜屏障功能的微生态制剂辅助治疗。本研究探讨恩替卡韦联合美常安(枯草杆菌二联活菌肠溶胶囊)对乙肝肝硬化患者肠道菌群和肠黏膜通透性的影响,现将结果报告如下。
1 资料与方法
1.1 一般资料
本研究获得医院伦理委员会审核通过,选取本院2017年4月—2019年6月接受治疗的乙肝肝硬化患者126例作为研究对象。纳入标准:① 乙肝肝硬化的诊断标准符合2010年中华医学会肝病学分会及中华医学会传染病学分会制定的《慢性乙型肝炎防治指南》[9]中的相关标准;② 年龄18~65岁;③ HBV-DNA超过104/mL;④ 丙氨酸氨基转移酶(ALT)水平超过70 U/L,总胆红素(TBIL)水平超过34.2 μmol/L;⑤ 经胃镜检查确定为食管胃底静脉曲张;⑥ 大便培养结果提示肠道菌群失调。排除标准:① 合并心、肺、肾和胃肠道严重疾病者;② 精神病患者;③ 非HBV感染引起的肝硬化患者;④ 合并Ⅱ度以上肝性脑病、肝肾综合征和/或消化道出血的患者;⑤ 对本研究使用药物过敏者;⑥ 入组前2周应用抗生素的患者;⑦ 孕妇或哺乳期妇女。剔除标准:① 由于病情加重需应用其他治疗方法者;② 无法坚持完成治疗者;③ 停药1周以上者。应用随机数字表法将所有患者分为对照组与研究组各63例。对照组中男38例,女25例;年龄23~59岁,平均(36.28±4.75)岁;肝功能Child-pugh分级为A级11例,B级35例,C级17例;腹水Rivalta试验阴性23例,阳性29例,弱阳性11例。研究组中男41例,女22例;年龄24~62岁,平均(37.10±4.79)岁;肝功能Child-pugh分级为A级13例,B级34例,C级16例;腹水Rivalta试验阴性20例,阳性26例,弱阳性7例。2组患者性别、年龄、肝功能分级、腹水Rivalta试验结果等一般资料比较,差异无统计学意义(P>0.05)。所有入选患者均对本研究内容知情,自愿参与本研究并签署知情同意书。
1.2 治疗方法
2组患者入院后均常规给予综合治疗,包括利尿、保肝和对症支持治疗,同时应用恩替卡韦片(博路定,中美上海施贵宝制药有限公司,国药准字H20052237)治疗,0.5 mg/次,1次/d,空腹服用(至少餐前、餐后2 h服用)。研究组患者在上述治疗基础上联合应用枯草杆菌二联活菌肠溶胶囊(美常安,北京韩美药品有限公司,国药准字S20030087)治疗,1~2粒/次,2~3次/d。2组患者总疗程为6个月。
1.3 观察指标
① 统计2组治疗前后临床症状(乏力、厌食、腹胀)改善情况,计算改善率。② 比较2组治疗前后肝功能状况。治疗前后抽取患者清晨空腹静脉血5 mL,离心机上3 000转/min离心10 min,取上层血清置于-20 ℃冰箱中保存待测。用贝克曼AU-680全自动生化分析仪检测血浆ALT、天冬氨酸氨基转移酶(AST)和TBIL水平;采用定量PCR法检测血清HBV-DNA水平,计算治疗后血清HBV-DNA转阴率;采用化学发光法检测血清透明质酸(HA)、层粘连蛋白(LN)、Ⅲ型前胶原(PCⅢ)和Ⅳ型胶原(Ⅳ-C)水平,试剂盒均由南京建成生物工程研究所提供,严格按照试剂盒说明书进行操作。③ 比较2组腹部彩超结果。分别于治疗前后应用美国GE公司的Voluson730彩色多普勒超声诊断仪对患者进行腹部彩超检测,记录门静脉内径和脾脏厚度。④ 比较2组肠道菌群检测结果。治疗前后收集患者的新鲜粪便,稀释后在37 ℃湿箱中进行需氧菌(大肠杆菌、肠球菌)和厌氧菌(乳酸杆菌、双歧杆菌、拟杆菌)培养,厌氧菌培养应用日本株式会社Gaspak厌氧盒法进行培养,时间为24、48 h,观察结果并进行计数,肠道菌群检测结果用每克粪便湿重中菌落形成单位的对数值表示(lg CFU/g)。⑤ 比较2组肠黏膜通透性。治疗前后对患者进行乳果糖、甘露醇吸收试验,嘱患者排空尿液,口服含有10 g乳果糖和5 g甘露醇的试液50 mL,禁食5 h,同时收集5 h内患者的尿液,保存在-20 ℃冰箱中待测。采用高效液相色谱法检测尿液中乳果糖和甘露醇含量,计算尿液甘露醇和乳果糖的排出率,并计算二者比值。
1.4 统计学分析
采用SPSS 23.0统计学软件进行数据处理。采用频数和率(%)表示计数资料,比较行χ2检验;采用均数±标准差表示计量资料,比较行t检验,P<0.05为差异有统计学意义。
2 结 果
2.1 2组患者治疗后症状改善情况比较
治疗后,研究组患者乏力症状改善率为95.24%(60/63),腹胀改善率为95.24%(60/63),厌食改善率为87.30%(55/63),均高于对照组乏力改善率68.25%(43/63)、腹胀改善率58.73%(37/63)和厌食改善率55.56%(35/63),差异有统计学意义(P<0.05)。
2.2 2组患者治疗前后肝功能指标比较
治疗前,2组患者的肝纤维化指标ALT、AST和TBIL比较,差异均无统计学意义(P>0.05);治疗后,2组患者的上述肝功能指标均较治疗前显著降低,且研究组显著低于对照组(P<0.05)。见表1。
2.3 2组患者治疗前后肝纤维化指标比较
治疗前,2组患者的HA、LN、PCⅢ和Ⅳ-C4等肝纤维化指标比较,差异均无统计学意义(P>0.05);治疗后,2组患者的上述肝纤维化指标均较治疗前显著降低,且研究组显著低于对照组(P<0.05)。见表2。
2.4 2组患者治疗前后腹部彩超门静脉内径与脾脏厚度检测结果比较
2组患者治疗前的门静脉内径和脾脏厚度比较,差异均无统计学意义(P>0.05);治疗后,2组患者的门静脉内径、脾脏厚度均显著减小,且研究组显著小于对照组(P<0.05)。见表3。
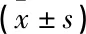
表1 治疗前后肝功能指标比较
ALT:丙氨酸氨基转移酶;
AST:天冬氨酸氨基转移酶;TBIL:总胆红素。
与治疗前比较,*P<0.05;与对照组比较,#P<0.05。
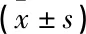
表2 治疗前后肝纤维化指标比较 ng/mL
HA:透明质酸;LN:层粘连蛋白;
PCⅢ:Ⅲ型前胶原;Ⅳ-C:Ⅳ型胶原。
与治疗前比较,*P<0.05;与对照组比较,#P<0.05。
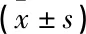
表3 治疗前后腹部彩超检测比较 mm
与治疗前比较,*P<0.05;与对照组比较,#P<0.05。
2.5 2组患者治疗后HBV-DNA转阴率比较
治疗后,研究组HBV-DNA转阴率为85.71%(54/63),高于对照组的79.37%(50/63),但差异无统计学意义(P>0.05)。
2.6 患者治疗前后肠道菌群和肠黏膜通透性比较
治疗前,2组患者的肠道各菌群数量无显著差异(P>0.05);治疗后,研究组患者的大肠杆菌数量较治疗前显著降低,拟杆菌、双歧杆菌、乳酸杆菌、肠球菌数量较治疗前显著升高,且2组肠道菌群数量比较有显著差异(P<0.05)。治疗前,对照组和研究组尿液乳果糖排除率与甘露醇排除率比值分别为(0.078±0.014)、(0.076±0.009),差异无统计学意义(P>0.05);治疗后,对照组和研究组尿液乳果糖排除率与甘露醇排除率比值分别为(0.049±0.010)、(0.039±0.005),均较治疗前显著降低,且研究组显著低于对照组(P<0.05)。见表4。
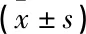
表4 治疗前后肠道菌群数量比较 lg CFU/g
与治疗前比较,*P<0.05;与对照组比较,#P<0.05。
3 讨 论
HBV感染是全球性的公共卫生问题,即便乙肝疫苗的应用在一定程度上能对HBV感染产生预防性的作用,但总体而言,包括中国在内的很多国家,乙肝患病率仍然很高[10]。HBV并不直接对肝细胞产生损伤,其在体内会通过长期不断地复制对人体的免疫系统造成很大的损害,还会不断攻击和损伤肝细胞。肝细胞损伤后,在各种损伤和慢性炎症反应的持续刺激下会出现纤维结缔组织异常增生,表现为肝脏内以胶原蛋白为主的细胞外基质(ECM)合成分泌增加,同时降解相对不足,并聚集于肝内窦周围间隙,进而引起肝纤维化的发生、发展[2]。
恩替卡韦是目前广泛应用于慢性乙肝和乙肝肝硬化患者的治疗药物,其抗病毒作用主要是通过体内转化为有抑制HBV聚合酶活性的三磷酸苷类似物来发挥的,此外其还能通过抑制肝脏局部细胞外基质的合成和缓解肝内炎症反应的程度来抑制肝脏纤维化。研究[11]显示,恩替卡韦治疗乙肝肝硬化不仅能获得病毒性、组织学、生物化学应答和血清学方面的效果,还能改善肝功能指标,延缓病情进展,降低晚期患者病情严重程度,减少肝移植手术需求或延长患者等待肝移植手术的生存时间,提高生存率。
研究[12]显示,乙肝肝硬化患者的病情会随着血液内毒素水平的升高、肠道通透性的增加、肠道菌群的紊乱和肝脏储备能力的变差而不断加重,甚至会引起严重并发症。肠道菌群是一个包含多个种类且不断发生变化的微生物群体。既往研究[13]指出,慢性乙肝患者肝细胞损伤后,会进一步造成肠道菌群失衡和肠道黏膜的破坏,而这主要是通过减少肠道血供、降低肠道蠕动速度和引起胆汁分泌改变等实现的。肝硬化患者肠道菌群失衡主要表现为大肠杆菌的过度生长,而大肠杆菌的数量又与患者血清内毒素含量密切相关。大量繁殖的大肠杆菌会分泌释放大量能抑制上皮细胞合成蛋白质的内毒素,损伤肠道屏障,引起肠道菌群失调。而肠道菌群失调又会使外周血和肝脏中对内毒素有清除和灭活功能的吞噬细胞功能减退,加之患者免疫功能降低,又会加重肠道菌群紊乱,造成内毒素大量移位,形成恶性循环。
在健康个体中,乳果糖主要是通过肠腺细胞间紧密且完整连接的孔径被吸收进入血液,当这种连接的完整性受到损害时,肠道对乳果糖的通透性就会发生变化;少部分的甘露醇主要是由小肠黏膜绒毛经细胞和细胞旁途径被吸收,因此其吸收率会受到小肠吸收总面积变化的影响。吸收的甘露醇和乳果糖都会以原型从尿液中排出,无法在体内被代谢掉,因此二者的比值能够判断肠黏膜通透性的变化[14]。美常安是一种含有枯草杆菌和屎肠球菌的微生态制剂,其能短暂存在于肠道中,有利于肠道局部氧化还原电位和氧浓度的降低,营造出一个有利于厌氧菌群生长和不利于需氧革兰阳性杆菌生长的环境,从而能减少细菌和内毒素易位的发生[15]。本研究结果显示,恩替卡韦联合美常安治疗的研究组患者各项指标均优于对照组,提示联合用药对改善患者预后具有重要意义。
综上所述,恩替卡韦联合美常安治疗乙肝肝硬化的临床效果显著,能明显改善患者的临床症状和肝功能、肝纤维化及脾门厚度等指标,还能有效促进患者肠道菌群的恢复,改善患者肠道屏障功能,提高疗效。
