双能量CT 对急性缺血性脑卒中支架取栓术后颅内出血的早期诊断及预测
2020-05-31王震汕陈婉琪林海韬罗世炜黄伟鹏刘源
王震汕 陈婉琪 林海韬 罗世炜 黄伟鹏 刘源
急性缺血性脑卒中(acute ischemic stroke,AIS)占全部脑卒中的80%,其治疗的首要目标是实现阻塞血管的再通和缺血区域的再灌注。支架机械取栓作为一种快速有效的血管内治疗方法,在AIS 的临床治疗中得到越来越广泛的应用。支架机械取栓后判断是否存在并发颅内出血,后者有较高的发生率并直接影响到患者的预后及后续抗栓治疗[1]。但常规CT 难以鉴别同为高密度的术后碘对比剂外渗和颅内出血,难以早期准确评估术后是否并发颅内出血[2]。双能量CT(dualenergy CT,DECT)可以利用不同物质在不同能量X 射线下的衰减差异性,实现对物质的定性分辨和定量分析[3,4]。利用双能量三物质分离技术对碘进行识别,可获得碘图(iodine overlay maps,IOM)和不含碘对比剂的虚拟平扫(virtual noncontrast,VNC)图像[5,6],从而实现对碘对比剂外渗及出血的鉴别。本研究旨在探讨DECT 在急性缺血性脑卒中Solitaire 支架取栓术后早期颅内出血与碘对比剂外渗鉴别的价值,同时分析碘渗出对出血转化风险的预测。
资料与方法
1.一般资料
2017 年1 月~2019 年7 月,按以下纳入标准收集揭阳市人民医院急性缺血脑卒中患者:(1)诊断为急性缺血性脑卒中者;(2)经Solitaire 支架取栓术治疗,术中碘对比剂采用优维显370(370 mg I/ml碘普罗胺注射液,拜耳医药);(3)术后1 h 内行DECT 检查者;(4)术后超过24 h 行常规CT 检查随访;(5)后续随访时间超过7 d。排除标准:(1)随访资料不全者;(2)患者无法配合检查或图像质量较差。(3)术后CT 颅内未出现高密度影。
2.扫描方法与参数
双能CT 平扫检查应用第二代双源CT(Somatom Definition Flash,Siemens Healthcare,Forchheim,Germany),扫描范围自颅底至颅顶,管电压为80 kV(球管A)和Sn150 kV(球管B),采用自动管电流,准直器宽度分别为64×0.6 mm,矩阵为512×512,螺距分别为0.7,机架旋转时间分别为1.0 s/r,完成扫描后,以卷积核为J30f,自动重组出80 kV、Sn150 kV 图像,层厚及层间距均为1 mm。
3.图像后处理分析
将原始图像传输至Siemens Syngo Via 后处理工作站,采用双能量软件Brain Hemorrhage 后处理,生成线性融合图像(mixed energy images,MIX,相当于120 kV 的CT 平扫图像),VNC 及IOM。由2 名从事神经放射影像的高年资医师对图像进行解析,综合VNC 及IOM 图像,判断MIX 图像中颅内高密度区域为单纯碘对比剂外渗或合并出血,并出具诊断报告,意见不一致时共同协商决定。
诊断标准:(1)单纯碘对比剂外渗:MIX 图上高密度,VNC 图上无高密度,IOM 图像相应区域高密度。(2)碘对比剂外渗合并颅内出血:MIX 图上高密度,VNC 图上亦见高密度区域,但范围较MIX图像缩小,缩小区域的IOM 图像为高密度。术后24 h 复查常规CT,判断有无出血并记录出血部位。诊断标准:若颅内高密度灶完全或基本消失则为碘对比剂外渗,若持续存在或范围较强扩大则认为存在出血。
将IOM 图像上存在高密度的病例纳入进一步分析,测量IOM 图像上高密度区的碘浓度,采用固定兴趣区(region of interest,ROI),直径5 mm,选取密度最高区域。由2 名高年资影像医师分别测量3 次,取其平均值进行统计学分析。后随访患者直至出院。根据出院前多次CT 或MR 检查,判断兴趣区病灶的变化,并将结果分为两组:(1)出血转化/出血增多:即DECT 诊断为单纯碘对比剂外渗的区域出现出血转化,或诊断为术后出血的区域出血增多。(2)无出血转化/出血增多:即DECT诊断为单纯碘对比剂外渗的区域未出现出血转化,或诊断为术后出血的区域出血量不变或减少。
4.统计学方法
应用SPSS 23.0 软件对数据进行统计学分析,以三线表对比DECT 检查与随访确诊结果,计算DECT 诊断术后碘对比剂外渗和继发出血的敏感度、特异度、阳性预测值、阴性预测值和符合率。计算出血转化/出血增多与无出血转化/出血增多两组的外渗碘浓度平均值,组间差异性通过独立样本t 检验比较,以P<0.05 为差异具有统计学意义。使用受试者工作特征曲线(receiver operating characteristic,ROC),分析碘浓度预测病灶是否发生出血转化/出血增多的界值(Cut-off 值)、灵敏度、特异度以及曲线下面积(area under curve,AUC),以P<0.05 为差异有统计学意义。
结果
44 例因急性缺血性脑卒中行Solitaire 支架取栓术治疗的患者纳入本研究,年龄42~83 岁,平均(66.3±9.6)岁,中位年龄66 岁,男28 例,女16例。术后行DECT 检查,MIX 图像中均见高密度。依据前述诊断标准,DECT 综合分析诊断单纯碘对比剂外渗25 例,碘对比剂外渗合并颅内出血19例(其中脑出血3 例,蛛网膜下腔出血11 例,脑内出血并蛛网膜下腔出血5 例)。
1.DECT 诊断术后早期颅内出血

图1 男,61 岁,左侧大脑中动脉机械取栓术后。a)MIX;b)IOM;c)VNC 综合分析,左豆状核高密度灶考虑为单纯碘对比剂外渗;d)24 h 随访CT 高密度消失,为单纯碘对比剂外渗 图2 女,72 岁,右大脑中动脉机械取栓术后。a)MIX;b)IOM;c)VNC 综合分析,右颞叶及外侧裂高密度灶考虑碘对比剂外渗合并脑出血及蛛网膜下腔出血;d)24 h 随访CT 病灶高密度大致同前,为脑出血及蛛网膜下腔出血 图3 男,69 岁,左大脑中动脉机械取栓术后。a)MIX;b)IOM;c)VNC 综合分析,左外侧裂池及颞枕脑沟高密度灶考虑为碘对比剂外渗合并少量蛛网膜出血;d)24 h 随访CT 外侧裂少许高密度存留,为少量蛛网膜下腔出血
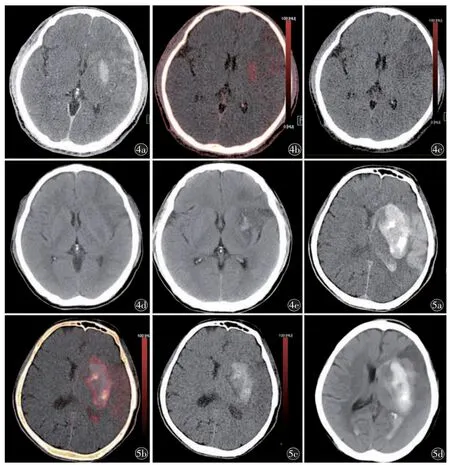
图4 男,69 岁,左大脑中动脉机械取栓术后。a)MIX;b)IOM;c)VNC 综合分析,左豆状核及额叶高密度灶考虑为单纯碘对比剂外渗;d)术后24 h CT 高密度消失,证实为碘对比剂外渗;e)术后10 d CT 左豆状核高碘对比剂外渗区域(碘浓度为3.4 mg I/ml)出现出血转化,而左额叶低碘浓度区域(碘浓度为2.1 mg I/ml)未出现出血转化 图5 男,69 岁,左大脑中动脉机械取栓术后。a)MIX;b)IOM;c)VNC 综合分析,左基底节区高密度灶考虑为碘对比剂外渗合并脑出血,左颞叶及左侧侧脑室内高密度考虑为单纯碘对比剂外渗。IOM 提示左基底节区病灶内局部碘对比剂外渗明显,碘浓度为5.9 mg I/ml;d)24 h随诊CT 左基底节区脑出血灶较前增大并破入侧脑室
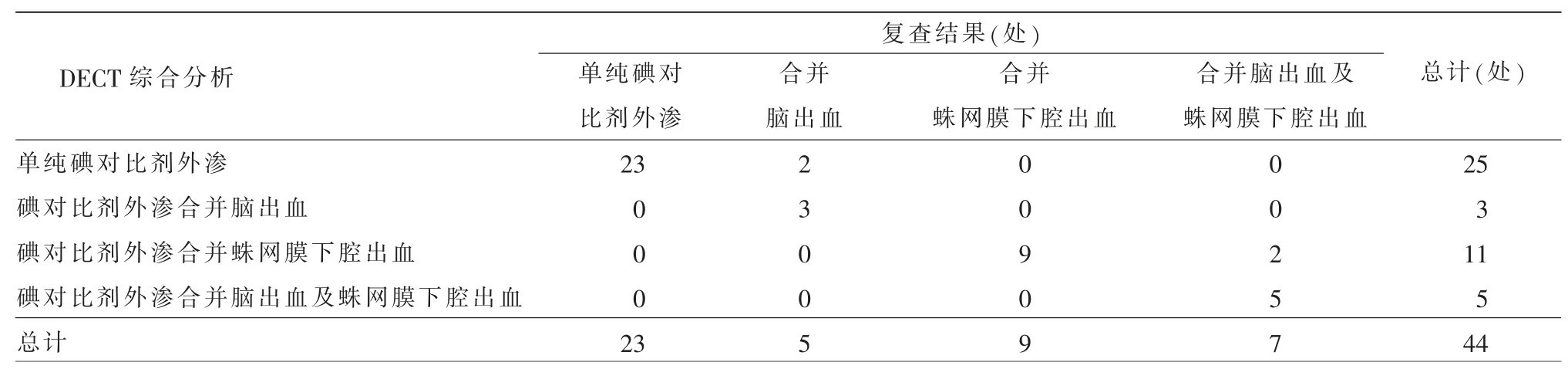
表1 DECT 综合分析结果与复查结果对比
术后24 h 常规CT 随访,DECT 诊断为单纯碘对比剂的25 例患者中,23 例均得到证实(图1),2 例出现脑出血。19 例DECT 诊断为碘对比剂外渗合并颅内出血的患者均得到了证实(图2、3),但其中2 例诊断为合并蛛网膜下腔出血的患者出现脑出血(表1)。DECT 早期诊断术后颅内出血的敏感度90.5%、特异度100%、阳性预测率100%、阴性预测率92.0%、符合率95.5%。
2.碘对比剂外渗浓度与出血转化/出血增多

图6 出血转化/出血增多与碘浓度的ROC 曲线
44 例患者共86 个病灶中,DECT 诊断单纯碘对比剂外渗的59 处,24 h 后复查和7 d 内随诊中出现出血转化共10 处(图4),另49 处未出现出血转化;DECT 诊断为脑出血或蛛网膜下腔出血 27 处病灶中,其中9 处出血量出现增多(图5),18处出血量未见增多。有出血转化或出血增多的病灶(n=10+9)术后1 h 双能CT 扫描平均碘浓度为(3.5±1.6) mg I/ml,无出血转化或出血增多的病灶(n=49+18)的平均碘浓度为(1.4±0.9)mg I/ml,经独立样本t 检验分析两组具有显著差异(P<0.0001)。ROC 分析显示两组鉴别的最佳Cut-off值为2.7 mg/ml,依据此界值,应用碘浓度测量预测病灶有无出血转化/出血增多风险的曲线下面积为0.899(95%CI:0.820~0.979),其敏感度、特异度分别为73.7%、92.5%,差异有统计学意义(P<0.0001)(图6)。
讨论
颅内出血为AIS 机械取栓的严重并发症之一,其中症状性颅内出血尤其提示预后不良[7]。一旦发生颅内出血,需停用抗栓(抗凝、抗血小板)治疗等致出血药物[8],以避免患者病情进一步恶化。因此,术后早期诊断及预测颅内出血对监测病情发展及调整后续治疗方案具有重要意义。
缺血和再灌注损伤导致血脑屏障损害、破坏[9,10],机械取栓过程中造影的碘对比剂渗出到脑组织间隙并滞留,即碘对比剂外渗。虽然碘对比剂外渗同样提示血管损伤,存在出血转化的可能[10],但无需按对待出血那样停止抗凝、抗血小板治疗,以避免取栓后血管再闭塞。传统单能量CT 在术后24 h 内,诊断碘对比剂外渗内是否并发颅内出血存在困难,因为二者均表现为高密度影。需待24 h后碘对比剂快速清除后[11],方可明确是否有持续存在的颅内出血的高密度,可能失去并发出血的最早干预时机。
本研究表明,DECT 基于物质分离技术所获得的VNC 及IOM 图像,可早期鉴别碘对比剂外渗及颅内出血,其敏感度90.5%、特异度100%、阳性预测率100%、阴性预测率92.0%、符合率95.5%,与文献相近[12,13],但本组病例术后均见碘对比剂外渗而无单纯颅内出血,可能与支架取栓术碘对比剂的用量相比动脉溶栓较多,以及术后较早行DECT 检查有关。其中VNC 可剔除碘对比剂外渗对颅内出血的干扰,对早期诊断颅内出血最具实用性,虽然其信噪比不如传统CT 平扫[14],但足以检测颅内出血。
本组2 例DECT 诊断为单纯碘对比剂外渗及2 例诊断为蛛网膜下腔出血的患者在术后24 h 的CT 复查中出现了脑出血,说明术后早期DECT 诊断无合并脑出血者,无法排除后期出血转化的可能。因为脑梗死的出血转化时间不定,从数小时、2周内到1 个月内均有报道,差异较大[15,16]。
出血转化发生的病例生理机制复杂,目前公认的机制包括血脑屏障破坏[10,17]、脑梗死后缺血使内皮细胞损伤及基底膜降解[18]。Jang 等[19]发现AIS 血管内治疗后颅内碘对比剂外渗区域存在出血风险,且病灶密度越高出血几率越大。相对传统CT,DECT 重组获得的碘图可以直接测量碘对比剂外渗区域的碘浓度,对碘外渗程度进行量化,从而间接反映了病灶血脑屏障破坏以及血管内皮细胞损伤的程度,且不受钙化等高密度灶的干扰。本研究有出血转化/出血增多与无出血转化/出血增多的病灶的最大碘浓度有较大的差别,采用ROC分析,以2.7 mg I/ml 为阈值预测是否出血转化/出血增多的敏感度为73.7%,特异度92.5%,提示机械取栓术后颅内高碘浓度区域其血脑屏障破坏及血管内皮细胞损伤较为严重,存在出血转化或出血增多的可能性较低碘浓度区域大,类似的研究如Tan 等[20]则报道了碘图可预测脑出血患者血肿扩张。但碘外渗的浓度是否与手术中对比剂的用量有关,尚需进一步研究。
综上所述,DECT 不仅可以早期准确诊断AIS机械取栓术后是否合并颅内出血,而且对预测出血转化或出血增多有一定的价值,有助于临床治疗方案的选择以及预后的评估。
