高通量测序在非小细胞肺癌基因突变研究中的应用*
2020-05-30杨静丽张海伟林昌海唐万燕辇伟奇
杨静丽,葛 闯,易 琳,张海伟,林昌海,唐万燕,陈 霞,辇伟奇
(1.重庆医科大学附属儿童医院新生儿诊治中心/儿童发育疾病研究教育部重点实验室/国家儿童健康与疾病临床医学研究中心/儿童发育重大疾病国家国际科技合作基地/儿童感染免疫重庆市重点实验室,重庆 400014;2.重庆大学附属肿瘤医院肿瘤转移与个体化诊治转化研究重庆市重点实验室,重庆 400030)
肺癌的发病率和病死率均居我国恶性肿瘤的首位。非小细胞肺癌(NSCLC)占肺癌的80%~85%[1]。人们对NSCLC的分型认知已经迈入分子水平,越来越多的肿瘤靶向基因从基础研究走向临床应用,如吉非替尼、埃克替尼、奥希替尼等酪氨酸激酶抑制剂(TKI)的靶点基因表皮生长因子受体(EGFR)[2],克唑替尼、色瑞替尼、劳拉替尼等的靶点基因间变性淋巴瘤激酶(ALK),达拉非尼联合曲美替尼的靶点基因BRAF、MEK等。
高通量测序是一种大规模平行测序技术,可用作基因点突变、插入缺失突变、基因重排和基因拷贝数突变等多种突变类型的分析。临床上,高通量测序可以针对药物的特定靶向基因进行深度测序,从而为肿瘤患者提供更多的治疗选项[3]。本研究对396例NSCLC患者的外周血循环肿瘤DNA(ctDNA)进行高通量测序,以分析不同类型基因突变与临床病理资料的关系,旨在为疾病的精准化诊疗提供基因水平的参考。
1 资料与方法
1.1一般资料 收集重庆大学附属肿瘤医院2017年1月至2018年10月396例NSCLC患者的标本。标本类型为外周血。男性患者255例,女性患者141例,年龄30~86岁。所有病例均经组织病理学检查确诊,其中腺癌患者293例,鳞状细胞癌患者103例。本研究获得该院医学伦理学委员会批准,临床资料及标本采集均获患者知情同意。
1.2仪器与试剂 无水乙醇(分析纯)、血浆游离DNA提取试剂盒购自中国天根公司;高速冷冻离心机购自韩国Genespeed公司;混匀仪、涡旋振荡器购自中国其林贝尔公司;恒温金属浴购自德国Eppendorf公司;Qubit荧光计、磁力架购自美国Thermo Fisher Scientific公司;生物安全柜购自中国海尔公司;超微量分光光度计购自美国NanoDrop公司;7500荧光定量PCR仪、数字PCR仪购自美国Thermo Fisher Scientific公司;Bioruptor®Pico超声波破碎仪购自比利时Diagenode公司;真空浓缩仪购自中国北京吉艾姆公司;生物分析仪购自中国Bioptic公司;NextSeq 550基因测序仪购自美国Illumina公司。
1.3方法
1.3.1核酸提取 吸取500 μL Proteinase K于50 mL离心管底,加入5 mL制备血浆(10 mL全血,2 000 r/min离心10 min,取上清;8 000 r/min离心10 min,收集上清血浆),加入Buffer 1 Mix,混匀30 s,瞬离;60 ℃水浴,30 min;加入Buffer 2,混匀15~30 s,冰浴5 min。将冰浴后溶液加入真空泵抽提吸附柱中进行抽吸;然后加入600 μL Buffer 3,真空抽吸;加入750 μL Buffer 4,真空抽吸;加入750 μL无水乙醇,真空抽吸;将吸附柱放入干净套管,14 000 r/min离心3 min,丢弃套管。将吸附柱装入洁净的1.5 mL收集管中,开盖,室温静置10 min;56 ℃烘干,1 min;悬空滴加80 μL NF-Water,室温静置5 min;14 000 r/min离心1 min,保留约75 μL DNA溶液;再次滴加50 μL NF-Water,室温静置5 min;14 000 r/min离心1 min,保留约120 μL DNA溶液。取3 μL DNA原液以Qubit 荧光计评估核酸质量及水平。剩余DNA原液如不立即使用可冻存于-80 ℃冰箱。
1.3.2文库构建及测序 将400 ng的DNA原液转移至DNA剪切专用Covaris管中进行剪切后,转移至新的1.5 mL离心管中并纯化;进行DNA末端修复,加“A”操作;连接接头序列并用AMPure XP磁珠纯化连接后的DNA标本;在0.2 mL低吸附PCR管中配制PCR扩增体系,混匀、PCR扩增,用AMPure XP磁珠纯化扩增后的DNA文库;Qubit荧光计测定文库DNA水平,吸取600 ng文库DNA至新的0.2 mL 的PCR管。≤45 ℃环境下,将文库浓缩至5 μL,加入配制好的Block Mix溶液、P5 Blocker、P7 Blocker各1 μL,PCR扩增;捕获和洗脱杂交的文库DNA;PCR扩增上一步得到的文库DNA,并用AMPure XP磁珠进行纯化;Qubit荧光计测定文库DNA水平,文库DNA水平应≥1 ng/μL。根据文库DNA水平进行稀释,稀释液的终水平为1.5 ng/μL;qPCR精确定量文库DNA有效水平。使用NextSeq 550基因测序仪进行高通量测序。
1.3.3生物信息学分析 使用测序数据质控软件pk_qc_new2去除下机数据中质量较低的数据;使用序列比对软件BWA(版本V0.7.12)将原始数据与人类参考基因组(GRCh37)进行比对;使用Samblaster_V0.1.22标记测序数据中的重复reads并进行去重;使用samtools_V0.1.19将比对文件SAM格式转换为BAM格式,并用Sambamba_V0.5.8对BAM文件进行排序,用GenomeAnalysisTK_V3.8局部重比对及碱基质量重校正,过滤掉突变频率0.5%以上的位点。分别使用 VarScan2.3、Mysv_V2.6.pl、ExomeCNV_V2进行SNV/Indel、SV及CNV的分析。根据dbSNP数据库(Avsnp150)、千人基因组(1000g2015aug_all)、外显子聚合数据库(Exac03_EAS)、癌症体细胞突变数据库(Cosmic83)、Clinvar_20170905和SAOdbSNP150对基因突变位点进行注释。
1.4统计学处理 采用SPSS17.0 进行统计学分析。计数资料以例数和率表示,组间比较采用χ2检验。所有比较均为双侧检验,P<0.05表示差异有统计学意义。
2 结 果
2.1Panel设计及数据质量评估 本Panel设计检测EGFR、KRAS、HRAS、NRAS、PIK3CA、ALK、ROS1、BRAF、HER2、RET、TP53、MET、MAP2K1、FGFR1、FGFR2、AKT1、PTEN、SMO、KIT、PDGFRA、DDR2、RB1、TSC1、MEK1、BRCA、TET2、DNMT3A、GNA11共28种肿瘤驱动基因的点突变、短片段缺失突变和短片段插入突变等基因突变类型,其中ALK、ROS1、RET 3个基因额外检测基因重排;EGFR、FGFR1、FGFR2、MET、KIT 5个基因额外检测基因拷贝数突变。
每例标本产生的数据量约为3 G,测序区域覆盖度为100%,比对率>99%;高通量测序区域去重后平均测序深度大于2 000 X,最低测序深度1 200 X。100%测序标本的测序质量值为Q20≥90%,Q30≥85%,比对质量值≥95%。99.50%的标本文库复杂度>25%,测序数据质量可靠。经生物信息学分析比对,排除非目标区突变、低质量突变、胚系突变及同义突变。
2.2NSCLC患者外周血基因突变分布 396例NSCLC患者的28种ctDNA基因谱表明,67.42%的标本至少检出1个基因突变类型,其中EGFR基因突变所占比例最高为35.35%,其余的主要突变基因包括KRAS(9.85%)、ROS1(7.58%)、PIK3CA(5.56%)、ALK(5.56%)、RET(4.80%)、TSC1(4.04%)、PTEN(3.79%)、HER2(3.28%)、BRAF(2.78%)、DDR2(2.78%)、MET(2.27%)。基因突变检出率最高的前5个基因占比为63.89%,前10个基因占比为82.58%,表现出明显的主基因突变聚集现象。见图1。
EGFR基因亚型同样呈现出明显的主次分布规律,其中最常见的突变亚型是19del、L858R,分别占45.00%、41.43%,剩余依次是T790M(22.86%)、G719X(3.57%)、S768I(2.14%)、L861Q(2.14%)、20ins(1.43%),其他(17.14%)。在63例19del突变标本中共发现15种亚型,占比最高的前5位依次是:c.2235_2249del GGA ATT AAG AGA AGC(23.81%)、c.2236_2250del(20.63%)、c.2235_2249del(12.70%)、c.2239_2248 TTA AGA GAA G>C(9.52%)、c.2240_2257del TAA GAG AAG CAA CAT CTC(9.52%),其余少见亚型占23.81%,同样表现出明显的主亚型聚集现象。见表1。
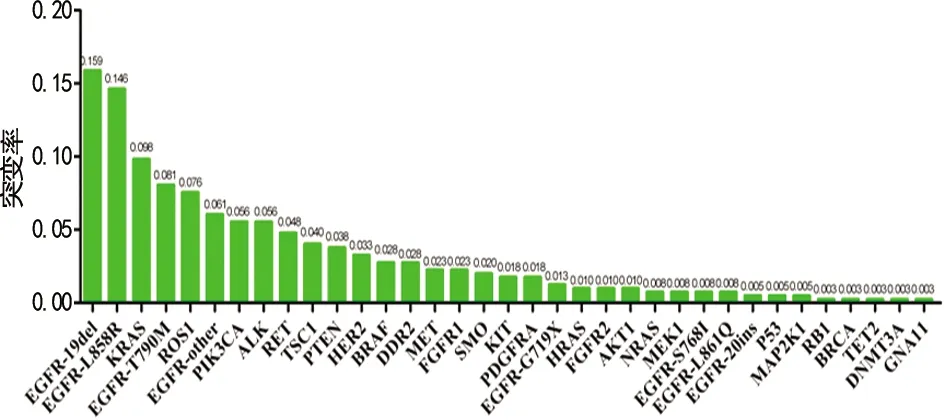
图1 NSCLC患者外周血28种基因突变谱

表1 EGFR19号外显子缺失突变亚型分布

续表1 EGFR19号外显子缺失突变亚型分布
2.3NSCLC患者28种基因突变的关系 本研究结果表明,EGFR突变亚型存在明显的互斥突变与伴随突变现象。19del缺失突变、L858R点突变和20ins 3个亚型常表现为互斥突变。在63例19del突变病例中,仅有2例分别携带G719X和L861Q,其余均为单亚型突变;58例L858R突变病例中,也仅有1例携带S768I共突变;2例20ins病例同样为单突变。伴随突变则多表现在罕见突变亚型上,如32例T790M突变全部都伴随其他突变位点;5例G719X突变病例中,发现有2例携带S768I突变,1例携带L861Q突变。
T790M突变总是伴随EGFR敏感突变,主要是19del与L858R 2个亚型,且两种伴随突变形式与患者的靶向治疗密切相关。32例T790M突变标本中,18例患者经靶向治疗并出现一代EGFR-TKI耐药现象,其伴随突变是19del;14例患者未经靶向治疗,其伴随突变是L858R。获得性T790M突变的患者发生基因突变的概率大于原发性T790M突变的患者统计分析结果,可能是因为NSCLC患者在靶向治疗过程中,肿瘤细胞会在靶向药物的打击下进一步发生克隆演进,导致更多基因发生突变,形成旁路激活效应,最终导致靶向药物耐药。见图2。
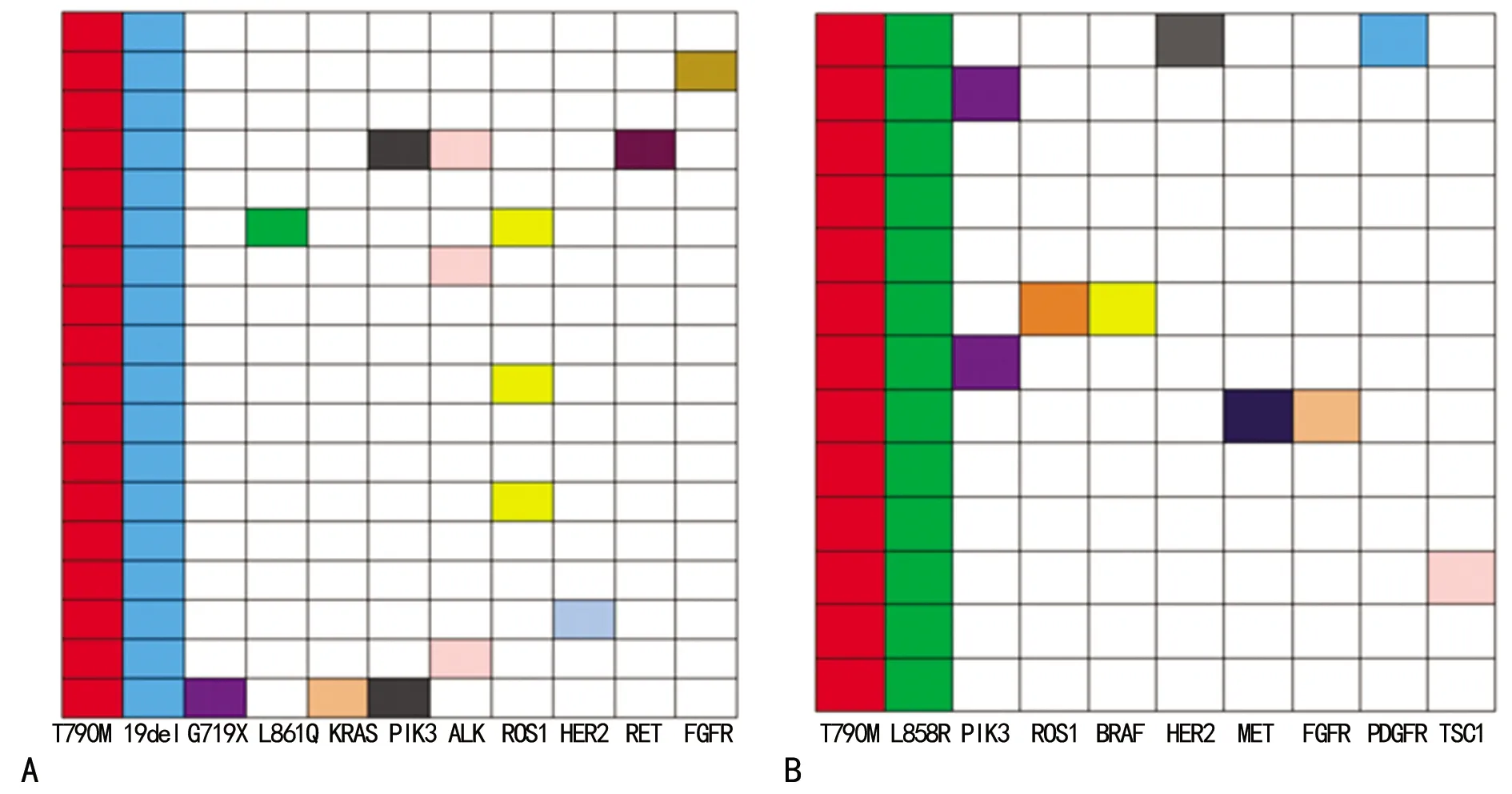
注:A表示T790M获得性突变;B表示T790M原发性突变。
图2 T790M突变状态下的多基因突变分布
2.4阳性标本基因突变分析 140例EGFR突变标本中,检测出存在其他基因突变类型的占36.43%;256例无EGFR突变标本中,检出其他基因突变类型的占47.27%,提示NSCLC患者的不同基因间同样存在强烈的基因突变互斥现象(χ2=4.33,P=0.038)。具体分析发现,EGFR突变标本发生其他类型基因突变的概率显著低于无EGFR突变的标本,如KRAS、ALK、RET、PTEN、DDR2、MET等基因突变在EGFR突变患者中的检出率分别为9.80%、13.73%、5.88%、3.92%、0.00%、3.92%,明显小于无EGFR突变患者中的检出率(分别为27.27%、12.40%、13.22%、10.74%、8.26%、5.79%),可能是EGFR基因突变抑制了其他基因发生突变。见图3。
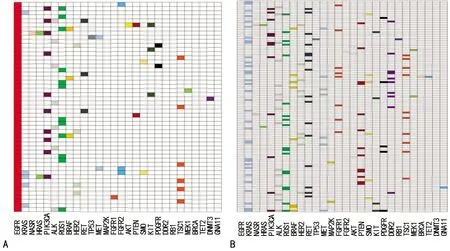
注:A表示EGFR突变标本中多基因突变分布;B表示无EGFR突变标本中多基因突变分布。
图3 EGFR突变及未突变状态下的多基因突变分布
2.5基因突变与临床病理特征的关系 考察常见驱动基因突变与患者组织类型、组织分期、性别、年龄、吸烟史的关系。腺癌标本EGFR突变检出率(40.96%),显著高于鳞状细胞癌(19.42%),差异有统计学意义(P<0.05);女性患者EGFR突变检出率(51.77%)显著高于男性(26.27%),差异有统计学意义(P<0.05);无吸烟史的患者EGFR突变检出率(46.73%),明显高于有吸烟史的患者(23.86%),差异有统计学意义(P<0.05);晚期患者(不低于3B期)的EGFR突变检出率(36.53%),高于早期(低于3B期)患者(14.29%),差异有统计学意义(P<0.05);<65岁与≥65岁的患者比较,EGFR突变检出率差异无统计学意义(P=0.97)。KRAS基因突变的特征人群同样为无吸烟史的女性晚期腺癌患者,但因为统计人群的规模有限,差异无统计学意义(P>0.05),需继续扩大样本量。见表2。
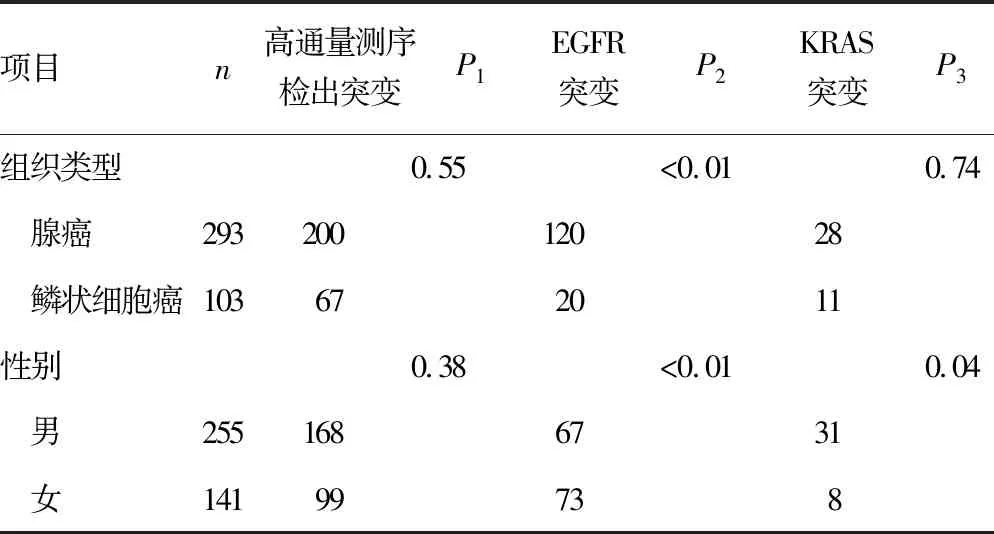
表2 主要基因突变与临床病理特征(n)
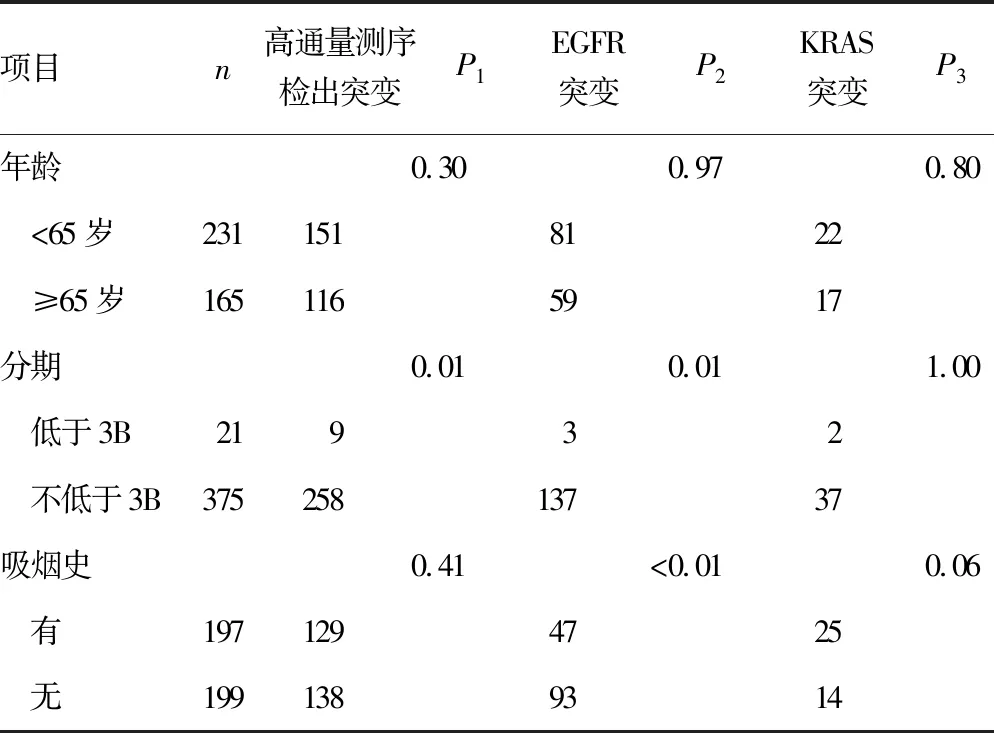
续表2 主要基因突变与临床病理特征(n)
注:P1表示高通量测序检出突变统计值;P2表示EGFR突变统计值;P3表示KRAS突变统计值。
3 讨 论
随着全球生物医药技术的飞速发展,以肺癌为代表的恶性肿瘤的诊治已进入了以生物信息大数据为基础的精准医疗时代[4]。高通量测序技术可以对标本的核酸序列进行大规模的检测,快速得到患者个体化的全景式基因信息谱,为恶性肿瘤的精准化诊治提供支撑,并以其检测通量大、信息全面、灵敏度高的优势逐步从实验室研究阶段迈入临床应用阶段[5]。在高通量测序临床应用方面,以美国纪念斯隆凯特琳癌症研究中心的MSK-IMPACT和美国Foundation Medicin公司的FoundationOne CDx最为引人关注。2018年,中国国家药品监督管理局先后批准燃石医学、诺禾致源、世和基因及艾德生物的4款肿瘤高通量测序检测试剂盒,有效地规范了肿瘤诊断领域的临床选择。本研究对美国国立综合癌症网络推荐的8个基因及20个NSCLC常见的驱动基因进行高通量测序,研究了患者中这些基因突变的特征。
根据396例NSCLC患者的测序结果绘制基因突变图谱,发现EGFR的突变检出率为35.35%,与东亚人群中NSCLC人群30%~40%的EGFR突变检出率一致[6]。从组织类型看,EGFR基因突变在肺腺癌患者中的检出率为40.96%;肺鳞状细胞癌患者中的检出率为19.42%,高于目前研究报道关于肺鳞状细胞癌EGFR突变的检出率,也反映出高通量测序技术相对于传统检测方法的灵敏度优势[6]。同时发现,无论是NSCLC患者的多基因之间,还是EGFR亚型之间,均有明显的突变聚集现象,主要表现是基因突变检出率最高的前10个基因占高通量测序检出突变总数的82.58%,EGFR基因的19del与L858R突变2个亚型占据EGFR突变的86.43%。同时,EGFR基因的19del缺失突变、L858R点突变和20ins 3个亚型上大多为单突变,很少有与其他基因亚型发生共突变的现象,表现出明显的互斥突变效应。T790M、G719X、S768I、L861Q等亚型则常常有共突变现象,表现出显著的伴随突变效应。本研究进一步丰富了程亚楠等[7]关于EGFR 19del与L858R呈现出明显的互斥现象的理论,而所有T790M突变都与上述2个突变位点伴随出现。
T790M是第一代EGFR-TKI药物的耐药突变[8],但ZHENG等[9]研究表明,在影像学检查显示病情有发展前的2.2个月即可在血浆中检测到T790M突变。本研究表明,T790M伴随L858R突变常常是原发性突变,T790M与19del共突变则常是获得性突变。获得性T790M突变的患者发生基因突变的概率大于原发性T790M突变的患者,可能是因为NSCLC患者靶向治疗过程中,肿瘤细胞会在靶向药物的打击下进一步克隆演进,导致更多基因发生突变,最终形成旁路激活。EGFR突变标本发生多基因突变的频率显著低于无EGFR突变标本,如KRAS、ALK、RET等基因突变在EGFR突变患者中的检出率分别为9.80%、13.73%、5.88%,明显小于无EGFR突变患者中的27.27%、12.40%、13.22%,可能是因为EGFR基因突变抑制了其他基因发生突变。
本研究中的ALK在NSCLC中的突变检出率为5.56%,与张绪超等[10]报道的3%~7%的中国肺癌人群ALK突变检出率相一致。SOLOMON等[11]研究证实了第一代ALK抑制剂克唑替尼在ALK阳性晚期NSCLC一线治疗中的作用。在对克唑替尼的耐药机制研究中发现,ALK酪氨酸激酶结构域获得性突变约占 20%,ALK扩增占8%[12]。ASCEND-4研究中第二代ALK抑制剂色瑞替尼一线治疗ALK阳性NSCLC的无进展生存期长达16.6个月,显著优于化疗组的8.1个月。无论有无ALK基因激酶区域的2次突变现象,患者都能从色瑞替尼治疗中获益[13]。目前第三代ALK抑制剂劳拉替尼已在欧洲获批上市,第四代靶向药物已处于临床试验阶段。
BRAF在恶性肿瘤中的突变检出率约为8%,主要见于黑色素瘤(50%)、甲状腺乳头状癌(30%~70%),而在NSCLC中的突变检出率为3%~5%[14]。本研究中BRAF突变检出率为2.78%,与张海燕等[15]报道的中国人群4.4%的突变检出率基本一致。BRAF基因突变类型中,约90%的BRAF突变是第15号外显子的密码子600处的缬氨酸被谷氨酸替代,即V600E突变。KRON等[16]认为在无针对性的治疗时,非 V600E突变型肺癌患者的预后优于V600E突变型肺癌患者,提示V600E可能是NSCLC预后不良的独立影响因素。JOSHI等[17]认为联合使用BRAF和MEK靶点抑制剂达拉非尼、曲美替尼对携带V600E的NSCLC具有良好治疗效果。
近年来,间质-上皮细胞转化在NSCLC中的临床应用是研究的热点,其中MET基因第14号外显子跳跃突变可作为NSCLC患者治疗的新靶点已经得到越来越广泛的证实[18]。MET基因第14号外显子跳跃突变总发生率为3%~6%,多发于肺肉瘤样癌(22%)和肺腺癌(3%~4%)[19-20]。但LIU等[21]分析了968例中国NSCLC患者的基因信息,发现MET基因第14号外显子跳跃突变仅占腺癌患者的0.9%。MET基因的靶向药物多为腺苷三磷酸的选择性竞争抑制剂,通过抑制MET的活性进而阻止下游相关激酶的磷酸化,从而实现对肿瘤细胞增殖、转移的调控。YAP等[22]研究了21例MET基因第14号外显子突变的晚期NSCLC患者,经克唑替尼靶向治疗,部分缓解率为44%,疾病控制率为50%,显示了良好的临床疗效。
4 结 论
本研究采用高通量测序技术对NSCLC患者28种靶向治疗相关驱动基因的突变信息进行全景检测,证实EGFR基因亚型间的分布规律及EGFR基因对其他基因突变的抑制作用,为临床医生制订NSCLC患者的精准诊疗方案提供了有力的保障。从更高层面上看,高通量测序技术的临床应用可以加快对未知病因或病因复杂的家族性肿瘤的研究与评估,也有利于发现新的致病基因,使肿瘤的预防更精准、有效。
