大鼠骨髓间充质干细胞培养鉴定及复方扶芳藤合剂含药血清对细胞增殖的影响
2020-05-29周倍伊吴亚姗谢金玲钟卫干杨力强黄正团黄铠琴
周倍伊,吴亚姗,周 围,谢金玲,钟卫干,杨力强,黄正团,黄铠琴
(广西中医药大学,广西 南宁 530200)
大鼠骨髓间充质干细胞(BMSCs)是存在于骨髓中的一种具有多向分化潜能的干细胞[1],是理想的组织工程种子细胞[2]。BMSCs来源于骨髓组织,其在所有的骨髓细胞中仅占0.01‱~0.1‱,数量极少[3]。而且BMSCs的数量随机体年龄增加而逐渐减少,所以仅从骨髓组织中提取收集的间充质干细胞难以满足组织工程实验的需要[4]。因此,寻找稳定有效的扩增BMSCs及促进BMSCs增殖的方法是临床亟待解决的重要问题。
复方扶芳藤合剂是广西中医药大学制药厂的产品,由扶芳藤、黄芪、人参等组成,临床用于治疗心脾两虚,气血不足[5]。有研究表明,人参中的有效成分人参皂苷Rg1和黄芪的有效成分黄芪甲苷均可促进BMSCs的体外增殖[6-7]。本实验采用全骨髓贴壁法分离、培养BMSCs,用不同浓度的复方扶芳藤合剂含药血清干预BMSCs,观察不同浓度的复方扶芳藤合剂含药血清对BMSCs增殖的影响。
1 实验材料
1.1 动物 健康雄性4周龄SD大鼠120只,SPF级,由广西医科大学动物实验中心提供,动物许可证号:SYXK桂2010-0001。试验过程中对动物的处置符合中华人民共和国科学技术部2006年颁布的《关于善待实验动物的指导性意见》标准[7]。
1.2 主要试剂 eBioscience™CD45 APC抗体(赛默飞世尔科技中国有限公司,lot:4322388);Invitrogen CD29 PE-Cyanine7(赛默飞世尔科技中国有限公司,lot:1989069);Invitrogen CD44 PE抗体(赛默飞世尔科技中国有限公司,lot:TG2605458);Novus CD34 Alexa Fluor®488抗体(美国Novus Biologicals公司,lot:E-3-07231-AF);Flow Cytometry Staining Buffer(赛默飞世尔科技中国有限公司,lot:1945430);Cell cycle staining KIT(中国联科生物有限公司,lot:LK811);Gibco低糖液体培养基(L-DMEM)、PBS、胎牛血清、胰蛋白酶(美国Gibco公司);Cyagen SD大鼠骨髓间充质干细胞成脂诱导分化培养基试剂盒、SD大鼠骨髓间充质干细胞成骨诱导分化培养基试剂盒均购自苏州赛业生物科技有限公司。
1.3 仪器 Attune Nxt流式细胞仪(赛默飞世尔科技中国有限公司);CKX53倒置相差显微镜(奥林巴斯中国有限公司);EnVision高通量酶标仪筛选系统(美国铂金埃尔默有限公司);Bio-Rad TC20全自动细胞计数仪(美国伯乐生命医学产品有限公司)。
2 方法
2.1 BMSCs的原代分离培养 取4周龄雄性SPF级健康SD大鼠,颈椎脱臼处死,75%乙醇全身浸泡1 min,无菌条件下快速去除肌肉等软组织,取出股骨及胫骨,75%乙醇浸泡清洗1次,胎牛血清(FBS)浸泡清洗2次。无菌条件下剪去长骨的骨骺端,露出骨髓腔[8],用含有10%FBS的低糖液体培养基(L-DMEM)冲洗骨髓腔,直至骨质发白;将冲出的骨髓内容物制成单细胞悬液,静置后,移取上清液至新离心管中,沉淀物用完全培养基重悬后种瓶,置于37℃、5%CO2的细胞培养箱中培养。
2.2 BMSCs的培养、纯化及传代 在原代细胞培养过程中,24 h后换液更换半数培养基,48 h后换液更换全量培养基。此后每2~3 d全量更换1次完全培养基,待细胞铺满培养瓶底约90%时,使用胰酶-EDTA(乙二胺四乙酸)溶液消化,按1∶2的比例进行传代培养[9]。每日用倒置相差显微镜观察细胞形态变化及生长状况[10]。
2.3 BMSCs生长曲线测定(包含标准曲线制作) 将生长状况良好的BMSCs传至第3代,消化重悬后制成细胞悬液,用全自动细胞计数仪计数其中细胞数量。接种细胞,选择3 000/孔细胞浓度种板,CO2培养箱培养24 h后每孔加入CCK-8试剂10µl,继续培养1 h、2 h、3 h、4 h后进行检测,选择450 nm波长,在酶标仪上测定各孔吸光度值,记录结果。以孵育时间为横坐标,吸光度为纵坐标,绘制标准曲线。接种细胞,设置5 个浓度梯度,分别为 10 000/孔、7 500/孔、5 000/孔、2 500/孔和1 250/孔,使用96孔板,每组6个复孔,每组加入完全培养基100µl。将培养板移入37℃、5%CO2培养箱中培养[11],定时进行CCK-8检测。在酶标仪上测定各孔吸光度值,以细胞数量为横轴,吸光度为纵轴,绘制标准曲线。选择3 000/孔细胞浓度种板,连续7 d,每日取1板进行CCK-8检测,记录结果。以接种时间为横轴,吸光度为纵轴,绘制细胞生长曲线。
2.4 成骨诱导分化及茜素红染色 按试剂盒说明书配置成骨诱导分化完全培养基,将P3代BMSCs按2×104cells/cm2细胞密度接种在事先包被0.1%明胶的6孔板中,每孔加入2 ml L-DMEM完全培养基培养,细胞贴壁后更换成骨诱导分化完全培养基[12],之后每3 d更换1次,各自诱导7 d,14 d,21 d后,吸走培养基,用PBS冲洗2次,每孔加入2 ml 4%中性甲醛溶液,固定30 min。吸走中性甲醛溶液,PBS冲洗2次,每孔加入1 ml茜素红染液染5 min。吸走茜素红染液,PBS冲洗3次[13]。置于显微镜下观察拍照。
2.5 成脂诱导分化及油红O染色 按试剂盒说明书配置成脂诱导分化完全培养基A液与B液,将P3代BMSCs按2×104cells/cm2细胞密度接种6孔板中,每孔加入2ml L-DMEM完全培养基培养,细胞贴壁后更换成脂诱导分化完全培养基A液,诱导3 d后,吸走A液,加入2 ml B液,1 d后,吸走B液,换回A液进行诱导。A液和B液交替作用15 d后,继续用B液维持培养7 d直到脂滴变得足够大、圆[14]。诱导结束后,吸走培养基,PBS冲洗2次,每孔加入2 ml 4%中性甲醛溶液,固定30 min。吸走中性甲醛溶液,PBS冲洗2次,每孔加入1 ml油红O工作液染色30 min。吸走油红O染液,PBS冲洗3次。置于显微镜下观察拍照。
2.6 BMSCs细胞周期的检测 收集P3代生长良好的细胞,0.25%胰酶消化,调整细胞浓度1×106cells/ml,离心弃上清液,PBS洗涤1次,离心弃上清液。加入1ml DNA染色液和10µl Permeabilization溶液,旋涡振荡10 s混匀,室温避光孵育30 min,流式细胞仪检测。
2.7 BMSCs表面标记物的表达鉴定 收集P3代生长良好的细胞,0.25%胰酶消化,4℃离心,1 000 r/min,3 min,PBS清洗细胞3次,细胞计数[15],调整浓度为1×106cells/ml,各管加入100µl细胞悬液,各管依次加入单克隆抗体CD29、CD34、CD44、CD45和四染管,同时每管单染管设立阴性对照组,避光孵育15 min,每管加入2 ml流式缓冲液清洗3次,除去未结合抗体,300 g/min,5 min,离心弃上清液,500 µl流式缓冲液重悬细胞,流式细胞仪进行检测分析。
2.8 不同浓度含药血清干预与生长曲线测定 收集P3代生长良好的细胞,按3×104cells/ml接种于96孔培养板,每孔100µl。总共分为3个大组,7个小组,即空白对照组,空白血清组,含药血清组。空白对照组使用L-DMEM培养基;空白血清组使用空白大鼠血清+L-DMEM培养基,空白大鼠血清分3个浓度组,即分别为5%、10%、20%组;含药血清组使用含药大鼠血清+L-DMEM培养基,含药大鼠血清分3个浓度组,分别为5%、10%、20%组。空白血清与含药血清均用0.22µm滤膜过滤灭菌。各组干预培养后,每组每天取细胞6孔,连续7 d采用CCK-8比色法检测各孔450 nm波长处吸光度(A)值,绘制生长曲线。
3 结果
3.1 BMSCs形态学观察结果 使用全骨髓贴壁培养法接种骨髓细胞于培养瓶后观察发现,镜下检查细胞数量多,种类杂,圆形透亮的为红细胞且占大多数。24 h后观察发现存在部分细胞已经贴壁分散生长,通过半换液去除未贴壁的细胞。48 h后观察发现,培养瓶底出现多个细胞集落,呈放射状,伸出长短不一、粗细不均的突起,未出现融合生长,单个细胞形态呈梭形(图1A)。继续培养,细胞集落面积不断增大,且与周边集落逐渐融合生长,培养7 d后长梭形细胞集落呈漩涡状或放射状,同向排列(图1B)。传代前记录发现,细胞排列紧密,均匀铺满培养瓶底,约占据90%瓶底空间,部分细胞没有生长空间,出现重叠或漂浮情况(图1C)。传代培养:1∶2消化传代后,传代细胞24 h即完全贴壁生长。细胞形态均一,呈典型梭形,旋涡状或放射状排列生长,细胞生长旺盛,每5 d即可传代1次。
3.2 BMSCs生长曲线 BMSCs细胞数量与吸光度的关系基本呈线性关系,R2=0.9914(图2A)。CCK-8的最佳孵育时间为2 h(图2B)。BMSCs在接种第1~2 d细胞缓慢生长,为细胞潜伏适应期;第3~5 d细胞迅速增殖,生长曲线基本为线性曲线,表明这段时间是细胞的对数生长期;第6~7 d后生长速度逐渐减慢至平稳,曲线变得平缓,表明进入平台期(图2C)。

图1 BMSCs形态学特征

图2 BMSCs生长曲线
3.3 BMSCs成骨分化及茜素红染色结果 BMSCs经成骨诱导培养基诱导14 d后,显微镜下观察到细胞由梭形变为多角形细胞,细胞之间界限模糊,重叠生长且逐渐聚集成多个分散致密的岛状细胞结构,堆积排列形成散在的细胞结节,结节中含大量矿盐沉积的钙化结节,茜素红染色表现为黑色的致密结节(图3)。
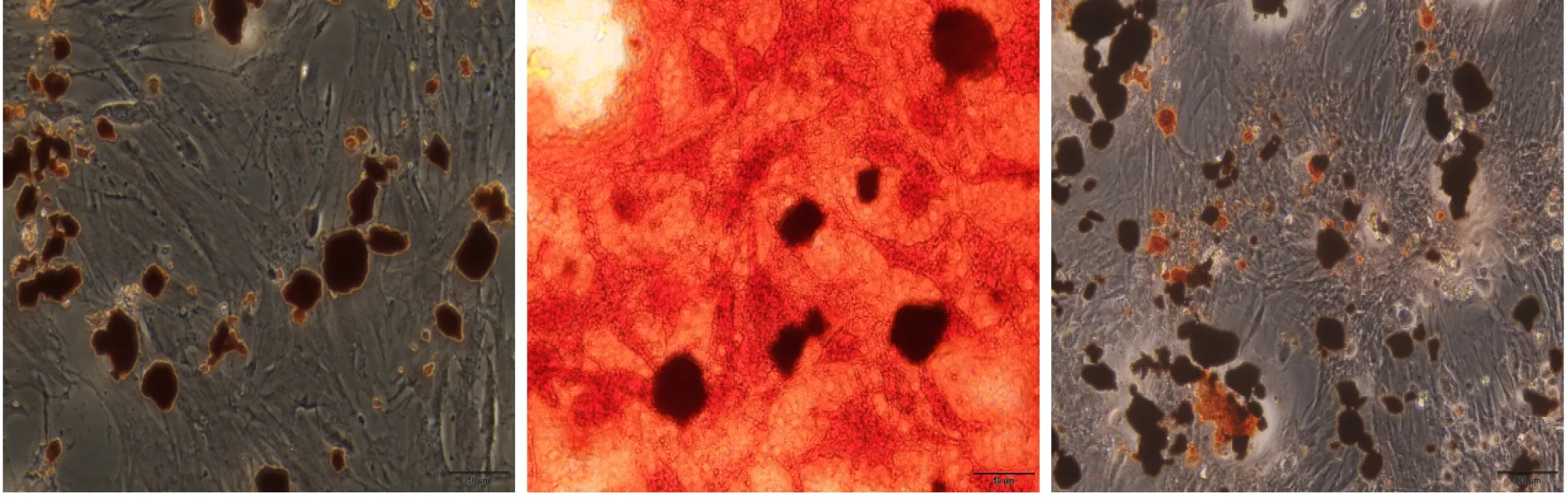
图3 BMSCs成骨分化及茜素红染色(×400)
3.4 BMSCs成脂分化及油红O染色结果 成脂诱导22 d后,诱导而成的脂肪细胞累积脂质,脂滴变大变圆,部分联结后呈鱼籽状,经油红O染色呈鲜红色(图4)。
3.5 BMSCs细胞周期 流式细胞术细胞周期分析结果显示,85.14%BMSCs细胞处于G0/G1期,6.48%处于G2/M期,8.38%处于S期(图5),表明BMSCs具有较强的分裂增殖能力,符合干细胞的一般特征。
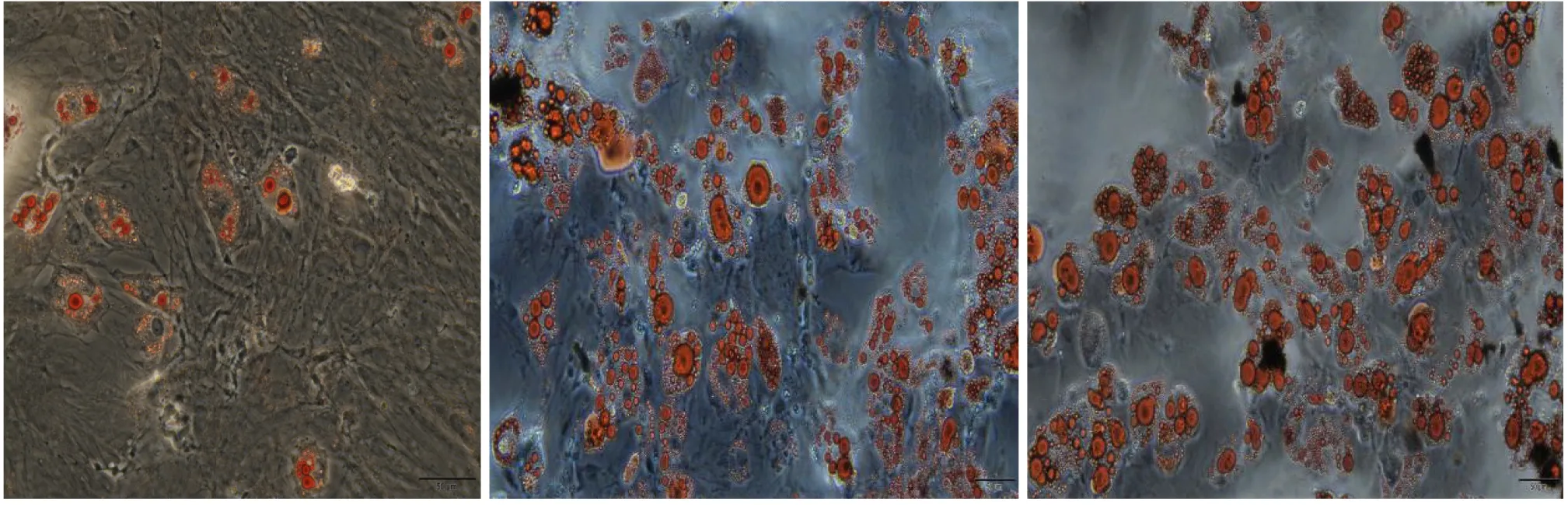
图4 BMSCs成脂分化及油红O染色(×400)
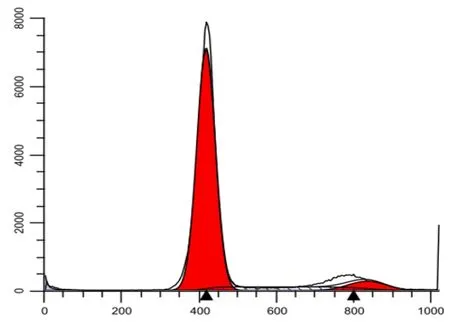
图5 BMSCs细胞周期
3.6 BMSCs表面标记物的表达结果 流式细胞仪检测结果显示,培养的第3代大鼠BMSCs均一表达CD29、CD44,阳性率分别为99.952%,99.677%;而CD34、CD45呈阴性,阳性率分别为0.016%,0.113%(图6)。
3.7 各组BMSCs细胞生长OD值测定 见表1。结果显示,与空白对照组比较,不同浓度的含药血清及空白血清均能促进BMSCs细胞的生长(P<0.05);与同浓度的空白血清作用比较,20%含药血清组明显优于20%空白血清组,1~7 d的吸光度数值差异均有统计学意义(P<0.05);自第3 d起,10%含药血清组干预效果也明显优于10%空白血清组,两组3~7 d的吸光度数值差异均有明显差异(P<0.05);5%含药血清组与5%空白血清组比较,差异不明显(P>0.05)。表明使用不同浓度血清干预后,20%含药血清组细胞增殖数量最多,效果最佳。

图6 BMSCs表面标志物的表达
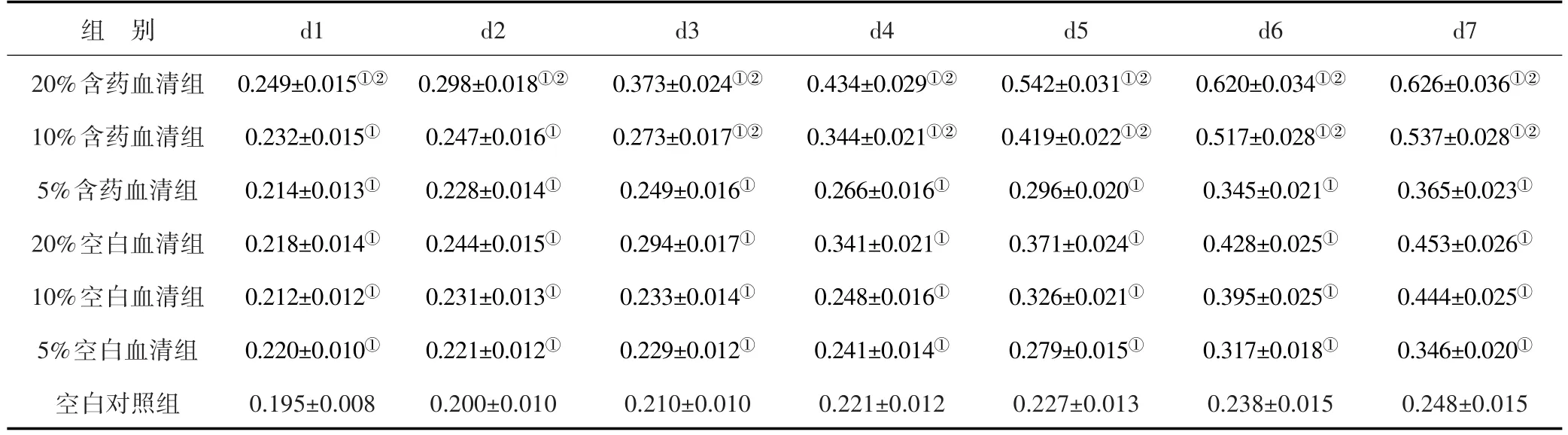
表1 各组BMSCs细胞生长OD值测定 (x±s)
4 讨 论
骨髓间充质干细胞是一种理想的组织工程种子细胞,在特定条件下可以分化为不同胚层的组织细胞[16]。用于分离培养BMSCs的常用方法有流式细胞仪分离法、免疫磁珠分离法、密度梯度离心法和全骨髓贴壁法。与前三种方法比较,全骨髓贴壁法具有操作简便、费用低等优点,很好地保护了BMSCs生长的微环境。本实验采用全骨髓贴壁法,分离、纯化和扩增了BMSCs,使用10%L-DMEM培养,经换液传代等方法除去杂细胞。镜下观察发现细胞生长良好,细胞形态均一呈梭形,生长曲线呈S形,细胞周期检测证明了其具有较强的分裂增殖能力,符合干细胞的一般特征。虽然目前对于大鼠BMSCs缺乏特异性表面标记[17-18],但可参考国际细胞治疗学会间充质及组织干细胞委员会提出的标准:对塑料底物的贴附特性;CD29、CD44等阳性表达率≥95%,CD34、CD45等阳性表达率≤2%;具有多向分化潜能。本实验使用流式细胞仪对获得的P3代大鼠BMSCs的CD29、CD34、CD44、CD45共4个表面抗原标志进行了鉴定,并进行成骨诱导分化及成脂诱导分化试验,结果证明采用全骨髓贴壁培养法获得的BMSCs显示出间充质干细胞的特性,CD29、CD44间充质干细胞表面标志抗原表达阳性,CD34、CD45造血干细胞表面标志抗原表达阴性,成骨成脂诱导结果均为阳性。通过各项试验验证了全骨髓贴壁培养法获得的大鼠BMSCs具有BMSCs生物特征,其活性好、增殖速度快、细胞纯度高等优点,可以为后续的BMSCs研究提供实验保障。
研究证实复方扶芳藤合剂具有抗氧化、延缓衰老的作用[19-21],本实验采用不同浓度(20%、10%和5%)的复方扶芳藤合剂含药血清对大鼠BMSCs进行体外干预,实验证明三种浓度均能提升BMSCs的细胞活性和增殖速率,其中20%浓度的含药血清作用最为明显。
