基于低温等离子处理对花生分离蛋白溶解行为的研究
2020-05-29季慧
季 慧
(临沂大学生命科学学院,临沂 276000)
花生分离蛋白(peanut protein isolate, PPI),因其蛋白质含量较高,其功能性质与花生蛋白相比有一定的提高,但是和大豆分离蛋白[1]相比,溶解性、乳化性和凝胶性等仍然较差,在一定程度上限制了花生分离蛋白在食品工业中的应用。花生分离蛋白组分中,75%的为花生球蛋白,由于花生球蛋白的碱性亚基具有很强的疏水结构[2],导致花生分离蛋白的溶解性较差,同时是花生分离蛋白功能性较差的主要原因之一。如何破坏花生分离蛋白分子的表面疏水结构,提高花生分离蛋白的溶解性,是当前提高花生产业资源附加值和延长花生产业链的关键技术问题。
介质阻挡放电(Dielectric Barrier Discharge,DBD)是当前低温非平衡等离子体研究的一个热点[3]。低温等离子由于在放电过程中产生臭氧,已广泛用于废水的处理。介质阻挡放电等离子体用于废水处理时其作用机理一般认为是:低温等离子产生的高能粒子轰击水溶液,水分子发生电离反应生成高活性游离态氧、羟基自由基及臭氧等,这些活性基团能够攻击废水中有机物使其分解为小分子物质,此外,臭氧的氧化及紫外线的吸收作用也会照成污染物的降解[4, 5]。
近年来,CP对蛋白质改性一直是研究的热点。Takai以溶菌酶为模型,研究了低温常压等离子体蛋白在水溶液中的化学效应。等离子体处理降低了酶活性,改变了溶菌酶的分子量和化学修饰的分子量[6]。Misra采用低温等离子对面粉进行研究,利用FTIR光谱学对蛋白质二级结构的变化进行了评价,结果表明了在强和弱的小麦面粉中,β-折叠的减少和α-螺旋和β-转角含量的增加[7]。Segat对低温等离子处理乳清蛋白溶液进行研究,研究了低温等离子体与乳清蛋白分离模型溶液的相互作用。结果表明,在等离子体处理15 min后,乳清蛋白质中发生轻度氧化。羰基含量和表面的疏水性增加,蛋白质结构在一定程度上展开[8]。Dong 采用等离子体处理降低了玉米醇溶蛋白胶束的平均直径并增加了玉米醇溶蛋白在中性和酸性水溶液中的溶解度[9]。 然而,有关CP技术改性花生分离蛋白的研究很少。
本研究采用低温等离子技术处理花生分离蛋白溶液,研究低温等离子对花生分离蛋白溶解行为的影响,探求等离子作用花生分离蛋白分子机理,以期为低温等离子改性蛋白提供参考。
1 材料与方法
1.1 材料
低温花生粕;血清白蛋白;其他试剂都是分析纯级。
1.2 仪器与设备
DBD-50低温等离子体;F-4600荧光分光光度计;PQ001核磁共振分析仪;傅里叶变换红外光谱NicoletiS50。
1.3 方法
1.3.1 花生分离蛋白的制备
低温脱脂花生粉与蒸馏水 1∶10 (g∶m L)混合,以1 mol/L Na OH 调节体系pH 值至 8. 0,在室温下搅拌提取 2 h,4 000 r/min 离心15 min,取上清液,以 1 mol/L HCL调节体系 pH 值至4.5产生沉淀,将沉淀溶解在蒸馏水中。以 1mol/L NaOH 调节体系 pH 值至 7.0,用透析袋在 4 ℃条件下透析24 h。真空冷冻干燥,得到花生分离蛋白,于4 ℃ 条件下保存备用[13]。PPI的蛋白质质量分数为 83.0% (凯氏常数5.46)。
1.3.2 低温等离子(CP)处理样品处理
用0.1 mol/L 磷酸盐缓冲液(PBS)(7.0)配成1%的花生分离蛋白溶液,取10 mL 花生分离蛋白溶液放入介质阻挡DBD-50 反应器中处理,在预试验结果的基础上,选取等离子放电功率为70 W, 处理时间为0、1、2、3、4 min 对花生分离蛋白溶液进行放电处理。处理后的样品一部分直接用于测定,另一部分真空冷冻干燥后备用。低温等离子体示意图如图1所示。
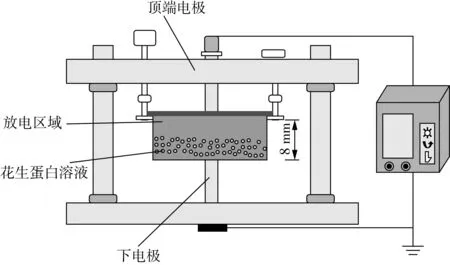
图1 低温等离子系统简易示意图
1.3.3 溶解度测定
根据Kong等[10]的方法,将低温等离子处理后花生蛋白溶液在3 000 r /min下离心15 min。取1 mL上清液加入4 mL双缩脲试剂,旋涡充分混合。反应30 min后,在540 nm下测定溶液的吸光度,不添加花生分离蛋白的样品为空白。
1.3.4 凝胶的制备
将CP处理后的花生分离蛋白用含有 0.06 mol/L CaCl2,0.1 mol/L PBS(pH值 7.0)中充分溶解,将其浓度调至 150 mg/mL 后,分别称取 50 g的蛋白液于100 mL烧杯中,用保鲜膜密封,放入90 ℃水浴锅中保温 60 min 后,立即取出冷水浴后,于4 ℃冰箱中放置24 h后,进行后续指标测定。
凝胶持水性测定:称取蛋白凝胶样品 5 g 左右,于 15 mL 干燥并已称重的离心管(记离心管的质量为W0)中,凝胶样品和离心管的总质量为W1。8 000 r/min 离心15 min,将析出的水倒掉,并使用滤纸吸取残留的水分后,称重并记录此时凝胶样品和离心管的总质量(W2)。凝胶持水能力(WHC)采用公式计算:
(1)
核磁共振分析:采用低场核磁共振技术(LF- NMR)测定凝胶样品的横向弛豫时间T2,测定条件:质子共振频率为22.6 MHz,测量温度为32 ℃。取花生蛋白凝胶直接放入直径25 mm 核磁管中,随后立即放入PQ-001 核磁共振仪中进行分析。采用Carr-Purcell-Meiboom-Gill(CPMG)脉冲序列进行自旋-自旋弛豫时间 T2、T2峰面积比的测定。参数设定:Tw=2 000 ms; NS=8; NECH=10 000。
1.3.5 蛋白光谱分析
蛋白紫外吸收光谱分析: 2 mg/ml 样品在 200~400 nm 波长范围内扫描,截取蛋白样品的紫外吸收光谱值(250~300 nm)进行分析。
表面疏水性:将2 mg/mL样品溶液用0.1 mol/L,pH 7.0的磷酸盐缓冲液分别稀释至0.05、0.1、0.2、0.5、1 mg/mL浓度,每种浓度下分别取 4 mL 样品溶液加入 20 μL ANS。在 390 nm 激发波长和 470 nm 发射波长下记录各样品溶液的荧光强度,狭缝宽度均为 5 nm。以荧光强度对样品浓度作图,曲线的初始斜率即为蛋白质的表面疏水性(H0)[11]。
1.3.6 巯基基团含量的测定
参照Beveridge 等[12]的Ellman 试剂分析方法。加4 mg DTNB 试剂于1 mL的 Tris-甘氨酸缓冲液(0.086 mol/L Tris,0.09 mol/L 甘氨酸,4mmol/L EDTA,pH8.0)中,配成Ellman 试剂。分别称取15 mg样品溶于5 mL的Tris-甘氨酸-8 mol/L尿素缓冲液(测游离SH)和Tris-甘氨酸缓冲液(测暴露SH)中,漩涡震荡,加入50 μL Ellman试剂,将悬浮液置于室温下保温1 h,以未加蛋白混合液为空白,测定412 nm 处吸光值(A412)。
(2)
式中:A412为421 nm处的吸光值;C为样品质量浓度/mg/mL;D为样品稀释倍数。
1.3.7 热稳定性测定
花生分离蛋白的热力学特性主要采用DSC来测定,将经过等离子处理的花生分离蛋白冻干,过 100 目筛后备用。称取花生分离蛋白粉 3~ 5 mg 放置在坩埚中,置于固体压样机压制密封,以空坩埚作为空白对照,设置扫描范围为 30~200 ℃,升温速度为10 ℃/min。并采用 TA-60WS 软件读取DSC谱图中样品的变性温度(Td)、焓变(ΔH)。
1.3.8 能谱测定
采用能谱仪(Energy Dispersive Spectrometer, EDS)分别对CP处理前后的花生分离蛋白表面元素的种类及含量进行测定,将样品置于与SEM连接的能谱仪中,每个样品随机选择5个区域进行能谱扫描,元素含量取平均值。
1.3.9 傅里叶红外光谱分析
准确称量 0.001 g 花生分离蛋白样品,加入一定量的KBr至0.15 g,用研钵研磨成均匀粉末,压制成薄片,用傅里叶红外光谱仪做全波段扫描 (4 000~400 cm-1) ,扫描次数为32[13]。每个样品做3次平行实验。
2 结果与讨论
2.1 CP处理对花生分离蛋白溶解性影响
从图2可以看出,随着CP处理时间的延长,PPI溶液的pH值即使在0.1 mol/L PBS在(pH值7.0)中逐渐降低(P<0.05), pH从6.92(0 min)下降到6.80(4 min),这一结果与Segat等[8]报道的结果类似。pH下降的原因可以解释为低温等离子在放电过程中会产生大量的高能粒子使氧分子电离单分子氧,使NO 氧化成 NO2,生成亚硝酸(HNO2)和硝酸(HNO3),以及水分子与过氧化氢(H2O2)在空气或液体中反应生成酸性H3O+离子,产生的酸性H3O+离子超出了缓冲液的缓冲范围。
随着CP处理时间的延长,花生分离蛋白的溶解度显著增加(P<0.05),在处理3 min时,花生分离蛋白的溶解度达到最大,与未处理相比,PPI溶液的溶解度提高了13.4%。随后略有下降(图2),等离子处理前3 min内,花生分离蛋白溶液pH值从6.92降至6.80 (花生蛋白的等电点约为5,pH>5后,花生蛋白溶液的溶解度随着pH值的降低而降低)[14]。花生蛋白溶液的溶解度逐渐增加,可能是由于CP处理促使花生蛋白表面结构被破坏,亲水基团暴露,亲水性增加,从而加速了蛋白质与水分子的亲和力,提高蛋白溶解度。处理3 min后花生分离蛋白溶液溶解度下降,可能是由于随着处理时间的增加,高能粒子的持续放电处理使蛋白分子之间交联,活性位点减少,导致溶解度降低。
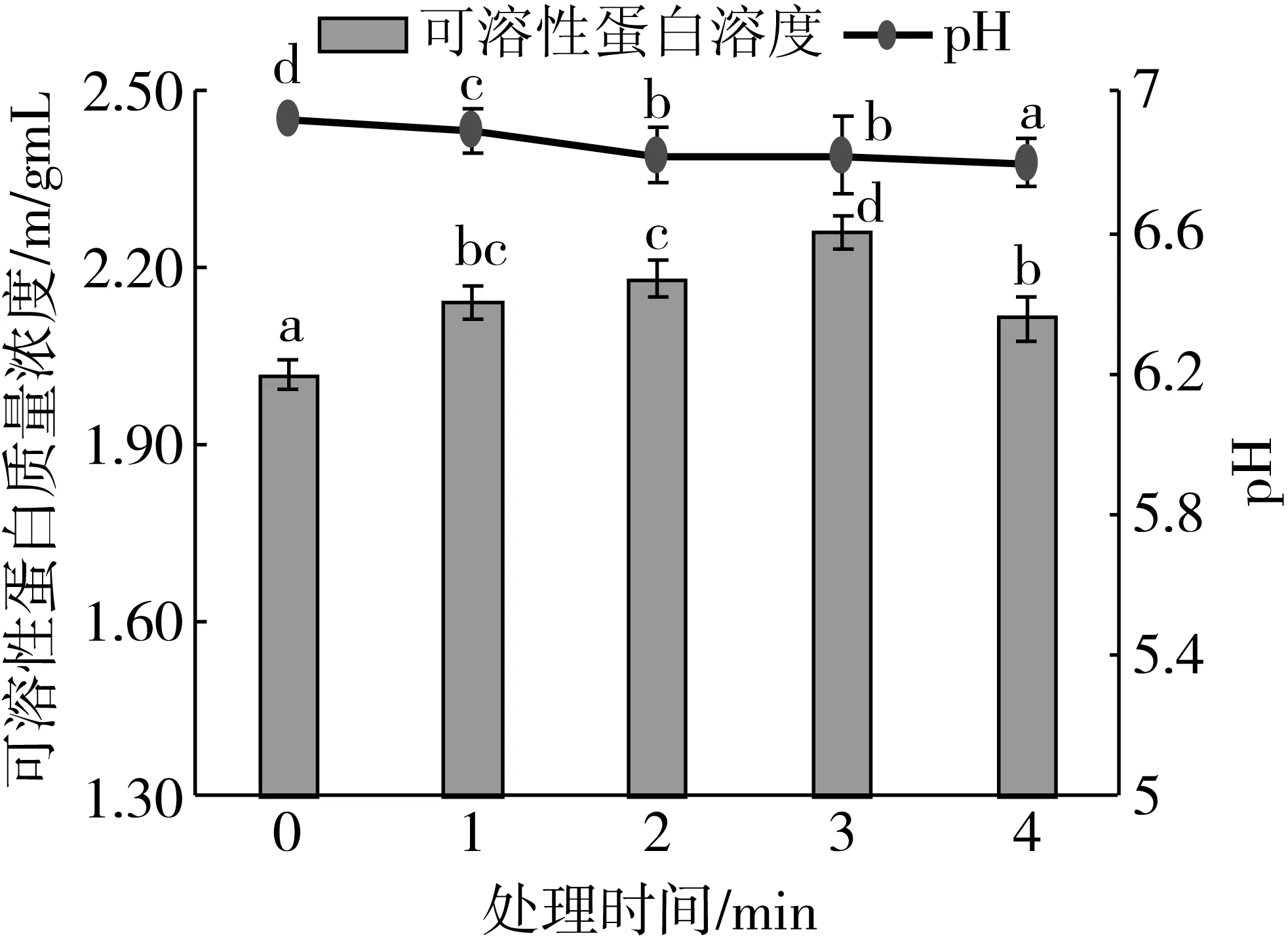
图2 不同低温等离子处理时间对花生蛋白溶解度及pH影响
2.2 PPI凝胶化性能
2.2.1 PPI凝胶持水能力(WHC)
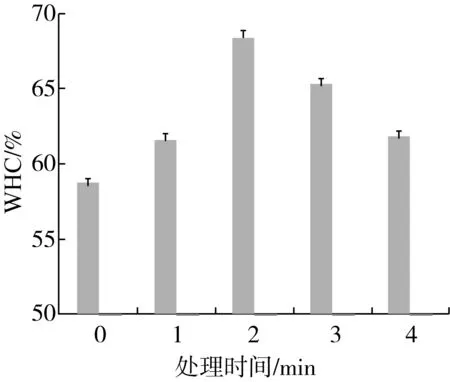
图3 不同低温等离子处理时间对花生分离蛋 白热诱导凝胶的持水力(WHC)的影响
持水能力是热致蛋白凝胶最重要的功能特性之一。大量的水、脂肪和其他食物成分可能会进入凝胶结构[15]。CP处理后氯化钙(CaCl2)诱导的PPI凝胶体系的WHC如图3所示。在2 min内,在随着低温等离子处理时间的延长,蛋白凝胶持水性显著增加,这可能是由于低温等离子处理花生分离蛋白,导致其表面结构发生变化,亲水基团的增加,结合水的能力增强。随后随CP处理时间的增加而减少。处理后的样品WHC在2 min时达到最大值,比未处理时增加6.96%。2 min后CaCl2诱导的PPI凝胶的WHC逐渐下降。WHC趋势与PPI溶液溶解度趋势一致。总体而言,所有处理过的样品的WHC都高于未处理样品。
2.2.2 核磁共振分析
从图4可以看出,花生蛋白凝胶的T2在0.1~2 000 ms的弛豫时间分布上均出现了3 种峰,分别用T2b、T21和T22表示,其水分分布与豆腐相似[16],分别对应于样品中水分的3种状态结合水T2b、不易流动水T21和自由水T22。T21对应凝胶中的不易流动水。不易流动水均占绝大部分,这可能是因为在加热的作用下,花生分离蛋白分子发生变性,经分子间和分子内相互作用交联凝聚,反应过程中与体系中的水通过化学键合而形成凝胶三维空间网络结构,而且体系中的自由水吸附填充在凝胶网络结构中,转变为不易流动水。随着CP处理时间的延长,T21比例显著提高,从76.28%(0 min)增加到80.98%(2 min),说明CP处理可以明显增加蛋白质凝胶网络表面的水基团数量,该结果与WHC结果相一致。
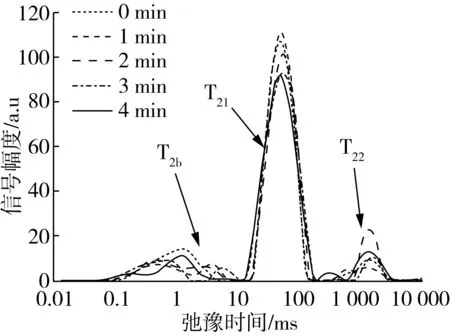
图4 低温等离子处理后花生蛋白凝胶水分子的T2弛豫特性
2.3 光谱变化分析
2.3.1 花生分离蛋白紫外光谱变化
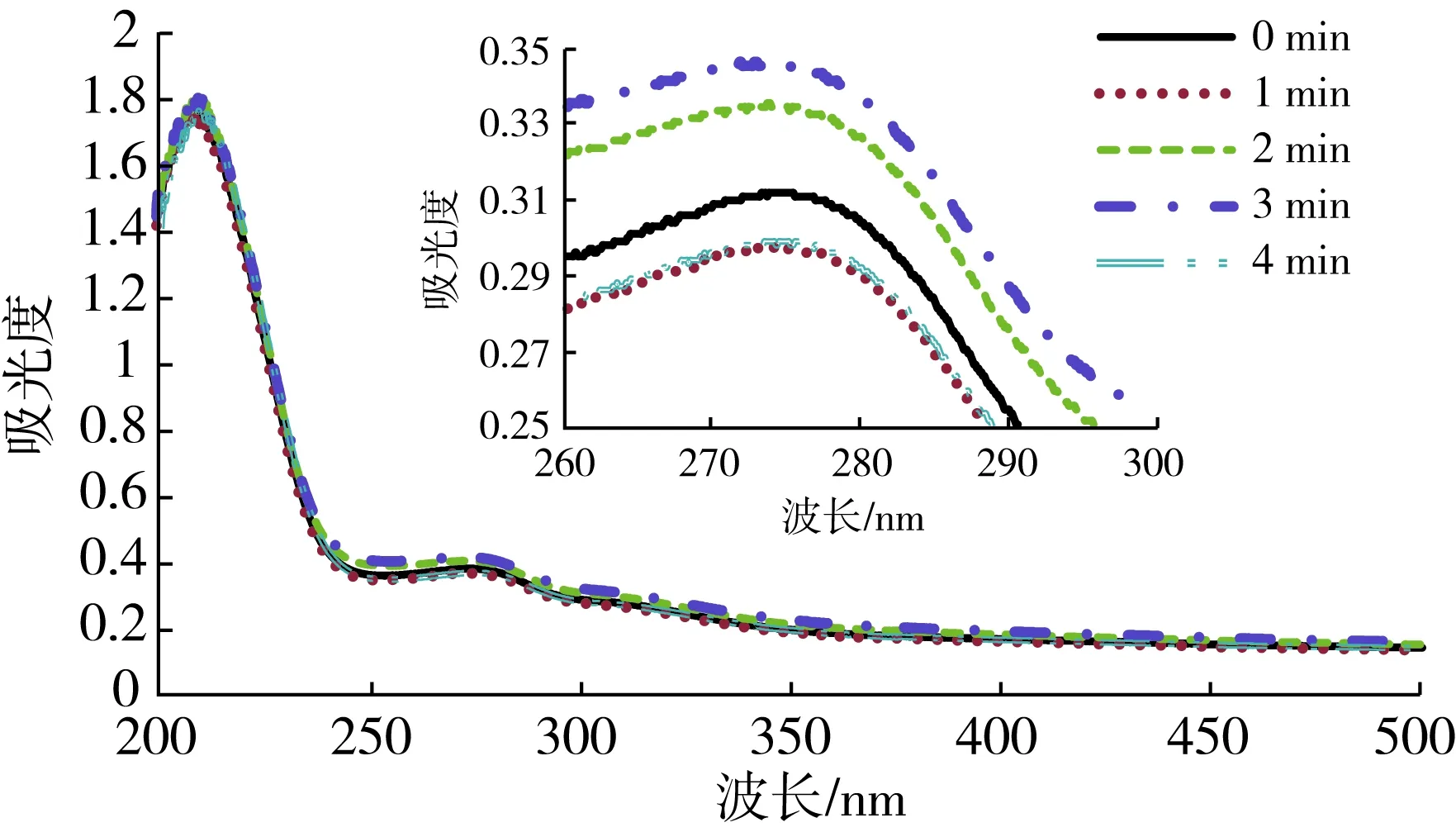
图5 低温等离子处理对花生分离蛋白紫外吸收光谱影响
CP处理对PPI紫外吸收光谱影响如图5所示,从图5中可以看出,PPI的紫外吸收曲线在波长209~212 nm和275~280 nm处有两个吸收峰。波长209~212 nm的峰通常被看作是肽链。275~280 nm处的峰则是典型的芳香族氨基酸的吸收峰,特别是色氨酸和酪氨酸。CP处理后,275~280 nm处的吸收峰没有明显的偏移(蓝移或红移),说明CP处理没有引起PPI的主体结构的改变。花生蛋白紫外吸收光谱的吸光度随着CP处理时间的延长呈现出先增加后降低的趋势,CP 处理3 min时,光谱吸光度最大。可能的原因是CP产生的高能粒子轰击花生蛋白使蛋白的表面结构打开,紧密结构变疏松,表面生色基团暴露从而引起蛋白紫外吸光度增加。随着处理时间进一步延长,高能粒子的持续放电使部分蛋白交联,生色基团重新被包埋,紫外吸收光谱的吸光度降低。
2.3.2 表面疏水性
CP处理前后PPI表面疏水性结果如表1所示,H0代表蛋白质表面与极性水环境接触的疏水基团数量的指数。由表2可以看出,随着CP处理时间的延长,PPI表面疏水性逐渐降低,H0从6 607.8 (0 min) 降低到4 568.8(4 min), 降低了30.86%。PPI表面疏水性的逐渐降低揭示了花生蛋白分子间疏水性相互作用的减少,亲水性相互作用的增加,使得花生蛋白溶液亲水性增加。PPI表面疏水性下降的原因可是由于等离子处理后,高能粒子的轰击,表面结构被氧化刻蚀,表面活性位点被激发,引起大量水分子或水胶束与活性位点相结合,阻碍了内部疏水基团与荧光探针的结合,故表面疏水性降低。
2.4 总游离巯基及暴露巯基的变化
CP处理可能引发不同的氨基酸侧链的变化, 如—SH基团。由于半胱氨酸残基具有极高的敏感性[17-19],芳香型和含硫氨基酸侧链尤其容易氧化。CP处理后游离巯基变化如表1所示。CP处理后,总巯基含量逐渐减少,暴露巯基逐渐增加,处理3min时,总巯基含量与未经处理的花生分离蛋白相比,降低了50%左右,随后总巯基含量有小幅增加。总巯基的减少可能使由于低温等离子产生一些氧化剂(O3·,H2O2等),使—SH被氧化成—S—S[20]。总巯基的小幅增加是由于高能粒子持续轰击使生成的—S—S断裂重新生成—SH。暴露巯基含量随CP处理时间的延长先增加后降低,是由于CP处理使蛋白分子表面结构打开,包埋在分子内部的巯基暴露,故暴露巯基含量增加。随着处理时间的延长,溶液总的蛋白胶束发生聚集,巯基重新被包埋。该结果与PPI紫外吸收光谱结果相一致。
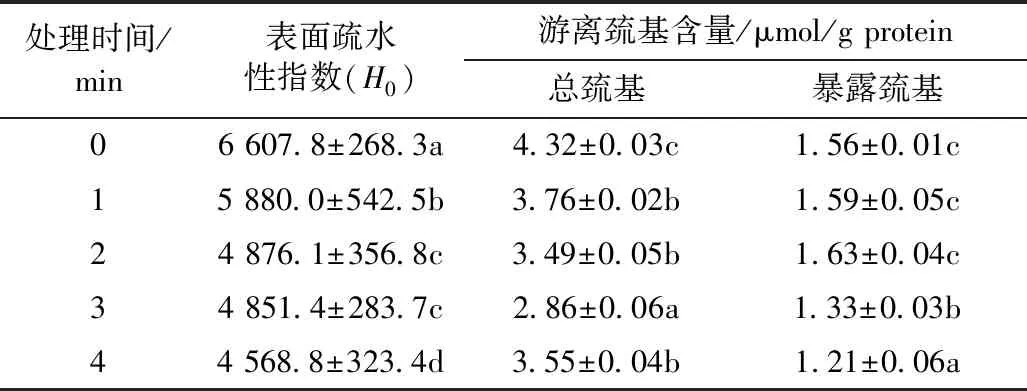
表1 表面疏水性指数、游离巯基(总巯基、暴露巯基)变化
注:采用 Duncan’s multiple range test 方法分析,同列小写字母不同表示差异显著(P<0.05),余同。
2.5 PPI热力学分析
差示扫描量热法(DSC)是研究蛋白质稳定性热力学的一项强有力的技术。它提供了蛋白质变性的基本参数[21, 22],并被应用于各种其他的食物系统[23, 24]。
CP处理后,PPI的热稳定性参数变化如表2所示。变性温度(Td)反映了蛋白的热稳定性和聚集程度。从表3可以看出,CP处理2 min后,Td的值从85.07下降到82.53 ℃,表明CP处理后PPI的热稳定性降低。分子间作用力减弱,花生蛋白聚集程度降低。PPI的焓值(ΔH)与蛋白的疏水相互作用有关[25]。CP处理后,ΔH呈现降低趋势,CP处理2 min后ΔH降到87.80 J/g,说明CP处理后花生蛋白间的PPI疏水相互作用减少,亲水性相互作用增加,这一结果进一步证实了PPI表面疏水性的结果。
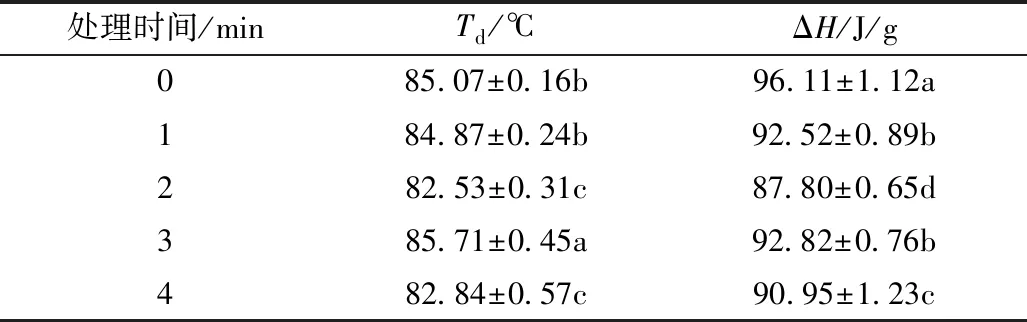
表2 PPI热力学参数变化
2.6 能谱分析
采用能谱仪对CP处理前后的花生分离蛋白表面的元素进行了测定,并对其主要元素(C、N、O、S)进行了归一化。表3表示了PPI的表面元素图谱和元素相对百分含量。表3可以看出,随着CP处理时间的延长,氧元素含量显著增加,碳、氮元素含量有所降低。CP处理2 min时蛋白表面氧元素达最高,为39.55%,与未处理相比,氧元素质量分数增加了42.27%。 氧元素含量增加可能是由于高能粒子通过能量传递给蛋白表面引发化学反应,引入一些含氧基团至蛋白表面,如—COOH、—CO、—OH等亲水基团增加了蛋白表面的亲水性,这与CP处理后花生蛋白的溶解性增加结果相一致;同时高能粒子中的臭氧的氧化作用使蛋白表面的C、N等元素被氧化后生成气体[8, 26],引起溶液pH值下降,与等离子处理后花生蛋白溶液pH值下降的结果相一致。
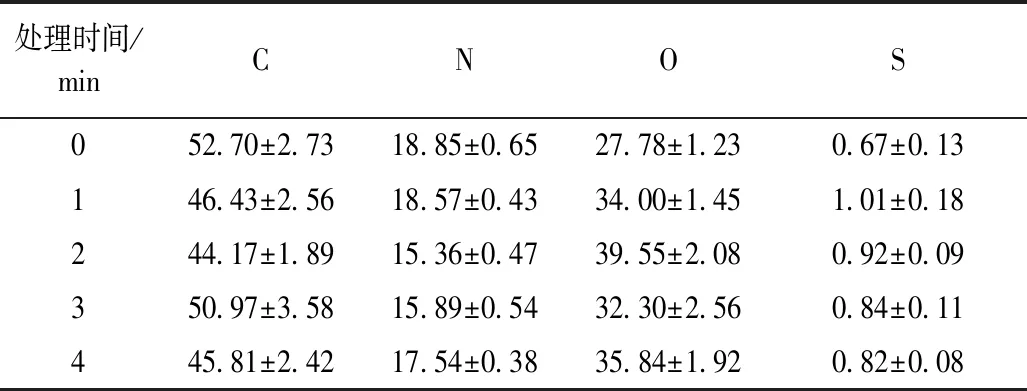
表3 CP体处理PPI表面元素相对质量分数/%
2.7 花生分离蛋白的二级结构
选取红外光谱中的酰胺Ⅰ带(1 600~1 700 cm-1)进行详细研究,参照辛佩贤[27]的方法,用Omnic软件对蛋白质各二级结构进行定量分析。结果如表4所示。
在CP处理的前3 min内,β-折叠(除1 min 外)与无规则卷曲含量显著增加,在处理3 min时,β-折叠质量分数比未处理时增加了7.29%;α-螺旋+β-转角含量显著降低。说明适当的CP处理使花生分离蛋白表面结构被打开,结构由紧密变疏松,更多的活性位点被暴露,亲水性增强,蛋白溶解度增加。3 min后,随着处理时间进一步延长,α-螺旋+β-转角含量增加,这说明低温等离子产生的高能粒子的持续放电作用使蛋白分子间交联聚集,活性位点减少,亲水性下降。该结果与蛋白紫外吸收光谱结果相一致。
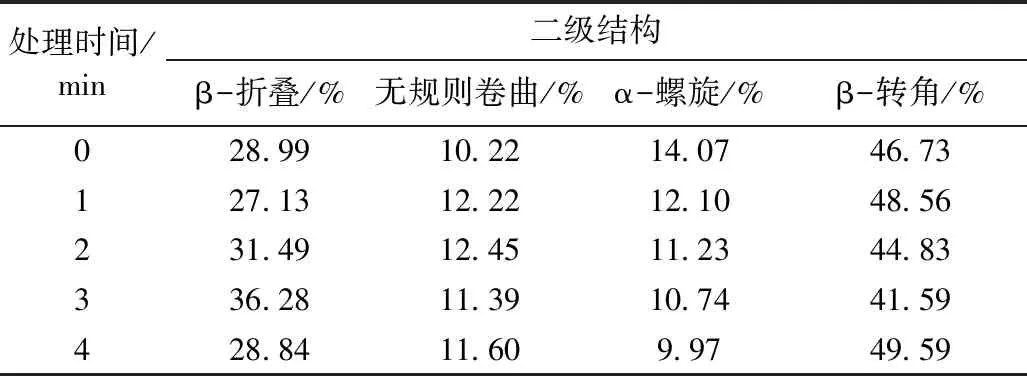
表4 低温等离子处理对花生分离蛋白二级结构的影响
3 结论
低温等离子技术处理有助于提高花生分离蛋白的溶解性, 与未处理相比,花生分离蛋白的溶解度和凝胶持水性分别提高了13.4%和6.96%。CP处理后,PPI由于高能粒子的轰击,蛋白表面粗糙度增加,表面生色基团暴露,内源色氨酸荧光强度降低,表面疏水性显著降低;蛋白表面氧元素含量显著增加, CP处理2 min时蛋白表面氧元素达最高,与未处理相比,氧元素质量分数增加了42.27%。PPI分子中α-螺旋含量减少,无规卷曲含量增加,蛋白有序结构被破坏,PPI的表面结构被打开,蛋白结构由紧密变疏松。
CP处理提高PPI溶解性的原因可能是CP体产生的高能粒子对PPI表面进行轰击,蛋白表面结构被打开,蛋白由紧密结构变成疏松的表面亲水结构,活性位点被激发,大量水胶束与PPI相水合,同时,—COOH、—CO、—OH等亲水基团被引入到花生分离蛋白分子表面,蛋白表面亲水性增强,蛋白溶解度增加。本研究结果为CP处理提高花生蛋白功能性质提供参考。
