板栗座果及果实早期发育与内源激素质量分数的关系1)
2020-05-29李玲苏淑钗寇艳茹
李玲 苏淑钗 寇艳茹
(省部共建森林培育与保护教育部重点实验室(北京林业大学),北京,100083)
板栗(CastaneamollissimaBl.)为壳斗科(Fagaceae)栗属(Castanea)乔木,花单性,雌雄同株,是非单性结实植物[1],花后1个月的生理落果和坐果率低,制约其产业的发展。正常授粉受精是保证其产量的前提,而果实发育进程在一定程度上受多种内源激素的影响。内源激素作为影响果实发育的重要信号分子,在植物细胞分裂与组织分化、开花结果和成熟衰老过程中发挥重要作用[2]。授粉受精后子房内源激素质量分数随自身的发育特征而变化。De Jong et al.[3]使用功能缺失突变体证实IAA在高等植物座果和生长发育过程中起关键作用。GA3在调控植物细胞伸长生长方面起关键作用[4-5]。ABA对受精[6]和胚胎发育过程[7]有促进作用。CTKs(ZR、IP和IPA之和)可促进座果与果实早期发育[8],且较高水平的IPA与ZR有利于调运同化物至幼果[9]。GA3、IAA和ZR质量分数增加及ABA质量分数下降可促进‘砀山酥梨’(PyrusbretshneideriCV. Dangshansu pear)的受精子房发育[10]。内源激素在板栗座果或胚胎发育过程中发挥的作用已有部分研究,郭素娟等[11]认为,GA3、IPA和ABA质量分数较高促进授粉受精,曾柏全等[12]研究得出,花后GA1+3、IPA质量分数增加与ABA质量分数降低有利于胚发育,不授粉子房由于未经花粉刺激,生长促进类激素增加而ABA质量分数上升导致其胚珠退化[13]。但内源激素在受精及果实发育早期的变化与发育阶段的结合还缺乏系统的研究。
本研究通过人工充分授粉、自然授粉和套袋不授粉,了解受精期及胚发育进程,并分析不同授粉方式对板栗结实情况、胚珠大小和子房内源激素水平的影响,初步阐明内源激素调节板栗座果与果实早期发育进程的生理机制。
1 研究地概况
试验于河北省遵化市魏进河国家板栗良种繁育基地(117°45′11″E、40°21′22″N)进行,年均温10.4 ℃,年均降水量804 mm。试验地立地条件基本一致,阳光和水源充足,可排除环境因素对试验结果的影响。
2 材料与方法
2.1 试验材料
试验主栽品种为‘遵玉’,授粉品种为‘燕红’‘紫珀’‘东陵明珠’和‘短刺’,树龄10 a,盛花期前选取长势基本一致且无病虫害的植株做试验树并挂牌标记。
2.2 授粉方式的设置
授粉方式分为套袋不授粉(简称不授粉)、自然授粉和人工充分授粉(简称充分授粉),每种方式处理10株树,每株树选取30个总苞(自然授粉除外)。套袋不授粉:6月11-12日用硫酸纸袋套住雌花簇以隔离花粉,当栗园雄花序散粉结束后取下纸袋;人工充分授粉:6月20日柱头分叉30°~45°(最佳授粉期)进行人工辅助授粉,11:00将刚采集的混合花粉用毛笔对套袋雌花簇点授,并于次日11:00重复上述操作以确保授粉充分[14],自然授粉为对照。将授粉当天记为授粉后0 d。
2.3 受精和胚发育过程观察
采集充分授粉后2、4、6、8、10、12、24、36、48 h,3 d的雌花簇,至授粉后15 d为2 d一次,随后至授粉后33 d(第一次生理落果基本结束)为3 d一次,每次采集10个总苞,将子房剥取后经FAA固定液(V(体积分数70%乙醇)∶V(甲醛)∶V(冰醋酸)=18∶1∶1)固定,抽气,并置于室温保存24 h以上。采用石蜡切片[15],将样品依次置于不同浓度梯度的乙醇中脱水后二甲苯中透明,包埋后使用Leica RM2265切片机切片,厚度为8~10 μm,使用体积分数0.5%番红和体积分数0.1%固绿溶液对染,中性树胶封片,最后用Leica DM2500显微镜观察并显微拍照。
2.4 胚珠大小与着蓬率、实蓬率的统计
通过体视显微镜M205FA测量授粉后11~33 d(3 d一次)胚珠的长与宽,着蓬率[(着蓬数/授粉雌花簇数)×100%]和实蓬率{[(着蓬数-空蓬数)/着蓬数]×100%}分别于7月中下旬(生理落果结束)和9月上旬(果实成熟)进行调查统计。
2.5 内源激素提取与测定
从授粉当日(6月20日)开始取样,6月份每天1次,之后3 d 1次至授粉后33 d。每个处理每次采集30个总苞,将子房从总苞中剥取后放入液氮罐,之后放入冰箱中-80 ℃保存。具体提取和测定激素的方法参照张立民[16]的方法,测定的内源激素包括GA3(赤霉素)、IAA(生长素)、ABA(脱落酸)、ZR(玉米素核苷)、IPA(异戊稀基腺苷)、IP(异戊烯基腺嘿呤)和CTKs(细胞分裂素),并进行3次重复试验。
2.6 数据分析
数据统计分析与作图使用Excel 2016,采用单因素方差分析(One-way ANOVA)和邓肯(Duncan)新复极差法比较不同授粉处理数据的差异显著性。
3 结果与分析
3.1 板栗受精作用和胚发育过程
从充分授粉子房的细胞学观察到子房9室、授粉后4 d仍处于胚珠原基状态(图1a),授粉后5 d的子房体积较小(横径×侧径×纵径为0.093 mm×0.074 mm×0.082 mm),但授粉后7 d子房(横径×侧径×纵径为0.442 mm×0.351 mm×0.392 mm)明显膨大(图1b),每个子房室有两个通过隔膜着生在中轴胎座上的倒生胚珠(图1c),直至授粉后11 d,双珠被、厚珠心逐渐发育成熟(图1d),授粉后15 d胚囊在珠心顶端发育成熟,但未受精(图1e),授粉后18 d珠心组织逐渐解体而胚乳核开始分裂(图1f),可见受精作用完成,推测受精发生在授粉后16~17 d。授粉后21 d可明显观察到未受精胚珠大小(长×宽为0.77 mm×0.38 mm),较小且瘪平,珠心组织退化解体(图1g),而受精胚珠增大(长×宽为1.28 mm×0.56 mm),且饱满,胚乳核大量分裂,而胚处于休眠状态(图1h)。授粉后24 d(图1i),胚乳核数目显著增加,至授粉后27 d(图1j),观察到胚乳细胞形成并向珠孔端的球形胚靠近,授粉后30 d(图1k)仍处于球形胚,授粉后33 d发育为心形胚(图1l),胚乳细胞大部分降解并逐渐向两侧移动。
3.2 板栗结实情况
充分授粉、自然授粉和不授粉对板栗着蓬率和实蓬率的影响差异极显著(表1)。未授粉板栗的着蓬率可达64.38%±2.82%,但其实蓬率为0,且充分授粉的着蓬率和实蓬率均极显著高于自然授粉的。
a.授粉后4 d,子房横切面,子房9室;b.授粉后5 d和授粉后7 d,雌蕊外部形态的差异;c.授粉后7 d,两枚倒生胚珠着生在一个子房室;d.授粉后11 d,双珠被、厚珠心;e.授粉后15 d,成熟胚囊;f.授粉后18 d,珠心解体与胚乳核分裂;g.授粉后21 d,败育胚珠;h.授粉后21 d,胚乳核发育;i.授粉后24 d,胚乳核数目增加;j、k.授粉后27 d,授粉后30 d,球形胚及胚乳细胞;l.授粉后33 d,心形胚及胚乳细胞;OW.子房璧;Lo.子房室;Ova.子房;St.柱头;Co.花柱;Se.隔膜;Ovu.胚珠;OI.外珠被;II.内珠被;Nu.珠心;ES.胚囊;EC.卵细胞;Sy.助细胞;AC.反足细胞;PN.极核;EN.胚乳核;AO.败育胚珠;Em.胚;GE.球形胚;EC.胚乳细胞;HE.心形胚;d-l.胚珠纵切面。
图1不同发育阶段板栗子房(或胚珠)的结构

表1 不同授粉方式下板栗的结实情况
注:表中数据为平均值±标准差;同列不同大写字母表示差异极显著(P<0.01)。
3.3 板栗胚珠大小的变化
虽然授粉后7~11 d充分授粉的胚珠相对较大,但各处理间胚珠的大小差异并不显著(11 d前未列入表2);授粉后15 d起,授粉处理的胚珠宽与不授粉差异显著;授粉后18 d三者间的胚珠长差异显著,且各处理间胚珠长宽的差异显著性不一致;而授粉后21 d起各处理间的胚珠长、宽差异均达到极显著水平。
3.4 不同时期板栗子房内源激素质量分数的变化
GA3质量分数:3种处理的GA3质量分数在授粉后差异显著,且自然授粉的GA3质量分数介于其他处理之间(表3)。充分授粉和自然授粉子房的GA3质量分数均于授粉后5 d首次达到最大值(分别为10.53、9.53 μg·g-1),随后质量分数显著降低并于授粉后10 d降至最小值,但授粉处理的GA3质量分数至授粉后16 d迅速增加,而不授粉的质量分数仅为充分授粉和自然授粉的46.92%和55.92%(授粉后24 d),随后降至授粉后33 d。
IAA质量分数:3种处理的IAA质量分数在生长发育过程中均呈先降低后增加再降低的趋势(表3)。充分授粉子房的IAA质量分数从授粉当日起持续减少,但授粉后10 d开始增加,并于授粉后30 d达到最大值(12.78 μg·g-1),此时充分授粉的质量分数分别为不授粉和自然授粉的3倍和1.5倍。
ABA质量分数:不授粉的ABA质量分数从授粉后21 d起均显著高于授粉处理(表3)。授粉后21 d前,3种授粉方式的ABA质量分数均减少。随后至授粉后33 d,不授粉和自然授粉的质量分数均先增加后减少,而充分授粉的质量分数一直增加。
ZR质量分数:充分授粉和自然授粉后的ZR质量分数先下降至授粉后4 d,随后至授粉后10 d先增加后减少,但此后又显著增加(表3),并于授粉后21 d达到最大值(分别为3.85、2.73 μg·g-1),而未授粉的质量分数无显著变化,其质量分数仅为充分授粉和自然授粉的31.95%和44.89%(授粉后21 d)。此后,3种处理的ZR质量分数下降至较低水平且无显著变化,但总体而言,充分授粉的ZR质量分数高于自然授粉,自然授粉高于不授粉。

表2 不同授粉方式对板栗胚珠大小的影响
注:表中数据为平均值±标准差;同列不同小写字母表示同一时间不同处理间差异显著(P<0.05),同列不同大写字母表示同一时间不同处理间差异极显著(P<0.01)。
IPA质量分数:在整个发育过程中,3种处理的IPA质量分数差异显著(表3)。授粉后各处理的IPA质量分数均迅速增加至授粉后5 d(其中充分授粉的质量分数最高为1.56 μg·g-1)后下降,而且不授粉的IPA质量分数始终减少,并低于授粉处理;但从授粉后10 d起自然授粉的质量分数整体上先增加(授粉后24 d)后减少;而充分授粉的IPA质量分数逐渐增加,于授粉后27 d达到最大值(1.43 μg·g-1)后降低。
IP质量分数:授粉后不授粉的子房IP质量分数先快速下降,后缓慢下降至较低水平后基本不变(表3),授粉后7 d起,充分授粉和自然授粉后的IP质量分数逐渐增加,并于授粉后16 d达到最大值(分别为1.15、0.76 μg·g-1)后降低,且充分授粉的质量分数显著高于自然授粉。
(GA3+IAA+CTKs)质量分数/ABA质量分数:3个处理的(GA3+IAA+CTKs)质量分数/ABA质量分数差异显著,自然授粉介于其他处理之间,且充分授粉的质量分数比极显著高于不授粉(表3)。在整个过程中不授粉的质量分数比波动于2.5~4.0,而授粉处理的质量分数比总体大于4.0。授粉后10 d起充分授粉和自然授粉的质量分数比显著增加,且授粉后21 d两者质量分数比分别为不授粉的3.4倍和2.4倍,之后均减少直至授粉后33 d。
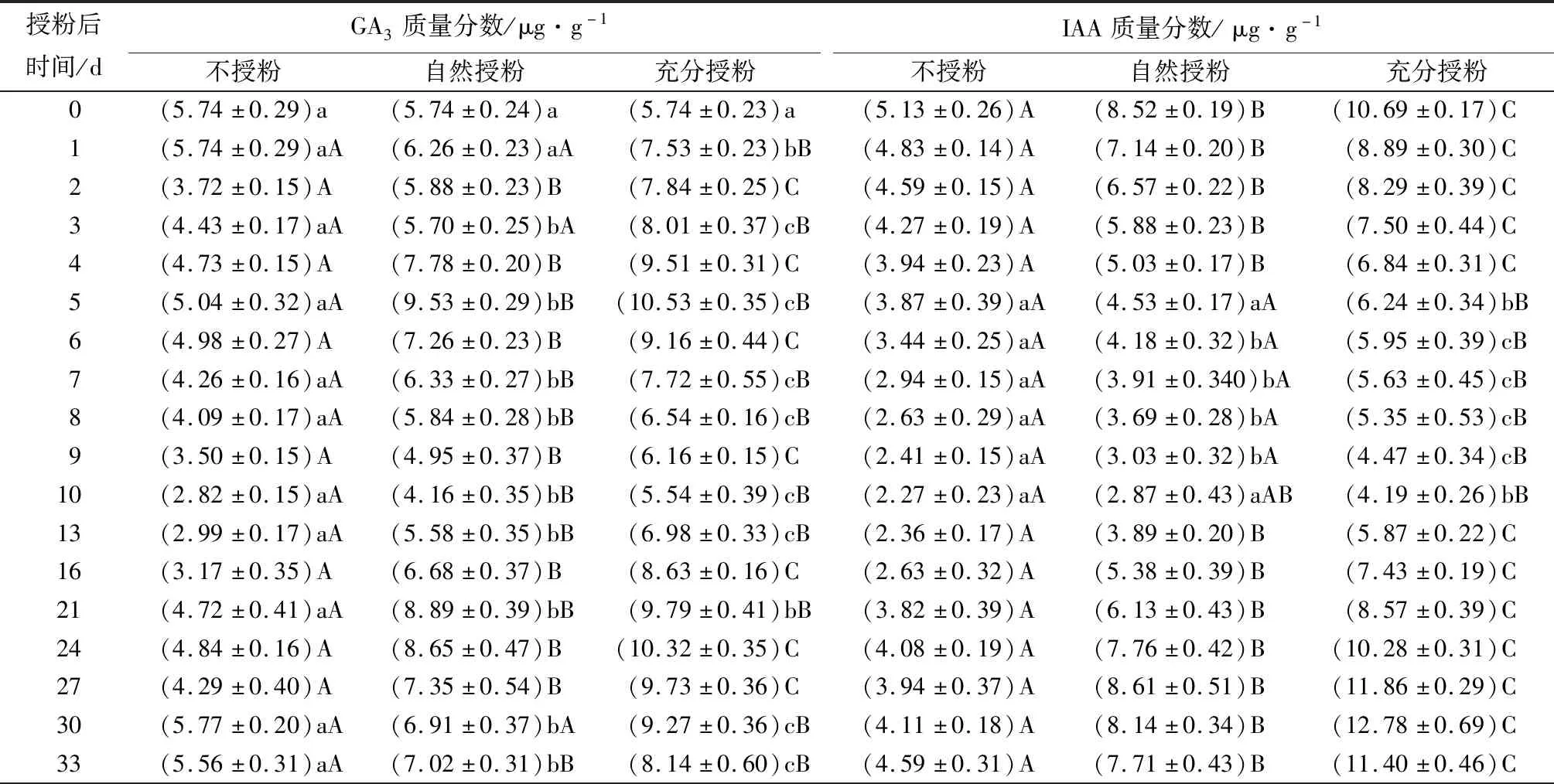
表3 不同授粉方式下板栗子房内源激素质量分数

授粉后时间/dABA质量分数/μg·g-1不授粉自然授粉充分授粉ZR质量分数/μg·g-1不授粉自然授粉 充分授粉0(5.04±0.06)a (5.21±0.12)a (5.20±0.09)a (0.88±0.09)aA (3.76±0.07)bB (4.95±0.07)bB 1(5.04±0.12)aA(4.18±0.21)bB(4.17±0.11)bB(1.69±0.05)A(2.27±0.06)B(2.71±0.08)C2(4.61±0.13)a(4.18±0.16)a(4.15±0.13)a(1.62±0.06)A(1.99±0.09)B(2.40±0.06)C

续(表3)

授粉后时间/dIPA质量分数/μg·g-1不授粉自然授粉充分授粉IP质量分数/μg·g-1不授粉自然授粉 充分授粉0(0.53±0.01)a (0.53±0.01)a (0.55±0.01)a (2.02±0.04)aA (2.29±0.05)bB (2.43±0.03)cB 1(0.56±0.01)a(0.73±0.03)a(0.59±0.03)a(1.79±0.04)aA(1.13±0.05)bB(1.21±0.08)bB2(0.58±0.01)a(0.96±0.04)a(0.76±0.02)a(1.79±0.04)aA(0.98±0.05)bB(0.93±0.07)bB3(0.61±0.02)aA(1.12±0.05)bA(0.87±0.03)cB(1.64±0.03)aA(0.58±0.04)bB(0.59±0.07)bB4(0.68±0.06)aA(1.32±0.03)bB(1.28±0.01)bB(1.55±0.03)aA(0.27±0.06)bB(0.27±0.03)bB5(0.67±0.03)a(0.71±0.01)a(1.56±0.05)b(1.42±0.05)aA(0.24±0.07)bB(0.25±0.04)bB6(0.76±0.03)aA(0.81±0.05)aA(1.07±0.04)bB(1.44±0.06)aA(0.18±0.07)bB(0.36±0.04)bB7(0.68±0.02)aA(0.78±0.03)bB(0.91±0.04)cB(1.45±0.07)aA(0.30±0.09)bB(0.41±0.04)bB8(0.62±0.03)a(0.71±0.04)a(0.77±0.03)a(1.29±0.03)aA(0.38±0.08)bB(0.48±0.04)bB9(0.57±0.04)aA(0.62±0.04)aA(0.77±0.02)bB(1.08±0.06)A(0.30±0.08)B(0.63±0.06)C10(0.56±0.06)aA(0.60±0.03)aA(0.74±0.04)bB(0.68±0.07)aA(0.47±0.10)bA(1.03±0.08)cB13(0.56±0.02)aA(0.97±0.03)bB(0.96±0.03)bB(0.57±0.03)aA(0.65±0.04)aA(1.09±0.03)bB16(0.55±0.05)A(1.01±0.04)B(1.25±0.02)C(0.47±0.04)A(0.76±0.06)B(1.15±0.07)C21(0.48±0.06)A(0.86±0.08)B(1.31±0.05)C(0.29±0.04)aA(0.55±0.09)bAB(0.79±0.0)cB24(0.51±0.08)aA(1.11±0.03)bAB(1.40±0.04)bB(0.26±0.05)aA(0.55±0.11)bAB(0.81±0.11)cB27(0.48±0.05)A(0.77±0.02)B(1.43±0.04)C(0.25±0.02)aA(0.32±0.11)aAB(0.58±0.07)bB30(0.47±0.02)A(0.69±0.04)B(1.18±0.08)C(0.18±0.02)aA(0.31±0.07)bA(0.78±0.07)cB33(0.37±0.04)A(0.68±0.05)B(0.93±0.02)C(0.17±0.04)aA(0.31±0.09)aA(0.80±0.05)bB

授粉后时间/d(GA3+IAA+CTKs)质量分数/ABA质量分数不授粉自然授粉充分授粉0(2.83±0.31)a (4.08±0.52)b (4.82±0.38)b 1(2.62±0.34)aA(4.32±0.38)bB(4.54±0.29)bB2(2.57±0.03)aA(3.63±0.41)bAB(4.44±0.26)cB3(2.80±0.38)aA(3.05±0.43)aA(4.64±0.25)bB4(2.75±0.32)aA(4.07±0.25)bB(5.03±0.31)cB5(2.97±0.34)aA(5.11±0.99)bB(6.22±0.27)bB6(3.40±0.40)a(4.58±1.11)a(6.38±0.22)a7(3.21±0.43)aA(4.58±1.08)bB(6.41±0.92)cB8(3.69±0.25)aA(4.51±0.45)aAB(5.96±0.65)bB9(3.31±0.38)aA(4.19±0.38)bA(5.82±0.49)cB10(2.71±0.49)aA(3.94±0.40)aA(5.75±0.31)bB13(2.99±0.36)A(5.10±0.25)B(7.95±0.38)C16(3.10±0.39)A(6.70±0.35)B(10.00±0.47)C21(3.79±0.43)A(9.12±0.29)B(13.23±0.61)C24(3.73±0.58)A(9.57±0.46)B(11.59±0.47)C27(3.21±0.40)A(7.26±0.45)B(10.58±0.61)C30(3.65±0.38)A(6.60±0.52)B(10.13±0.34)C33(3.84±1.48)aA(6.98±0.57)bB(8.52±0.60)cB
注:表中数据为平均值±标准差;同行不同小写字母表示同一时间不同处理间差异显著(P<0.05),同行不同大写字母表示同一时间不同处理间差异极显著(P<0.01)。
4 结论与讨论
被子植物的受精作用是世代交替的转折点,板栗受精作用发生在授粉后16~17 d,这与邹锋等[17]的结果(20 d)基本一致。板栗第一次生理落果发生在花后1个月[1],授粉后33 d子房内GA3、IAA质量分数与(GA3+IAA+CTKs)质量分数/ABA质量分数显著减少,而ABA质量分数增加至最大值,这在扁桃(AmygdaluscommunisL.)生理落果的研究中也有类似结果[18],即果实ABA质量分数最大值出现时间与落果高峰期相对应。因此,落果与生长促进类激素质量分数降低和激素间的比值失衡密切相关[19]。
自然生长条件下,非单性结实植物的子房经过授粉受精才能座果并使果实正常生长发育,否则脱落衰老。且不同授粉方式下板栗胚珠大小和子房内源激素的质量分数存在差异,说明花粉能刺激胚珠生长及GA3、IAA、CTKs与ABA水平发生变化,人工异花授粉对核桃(Juglansregia)果实生长发育的促进作用优于自然授粉[20]。授粉5d后板栗充分授粉子房的GA3、ZR和IPA质量分数首次达到最大值,且其质量分数均显著高于未授粉子房,推测GA3和CTKs刺激子房早期膨大,这些激素水平增加可能与授粉程度有关[21]。之后充分授粉子房的GA3、IAA、ZR和IPA质量分数减少可能与花粉管到达胚珠而停止生长有关,于授粉后10 d减少至相对较小值。此后,胚囊开始迅速发育,激素的合成场所由幼嫩的子房组织转向胚珠,整个子房出现了较高水平的生长促进物质,直至受精完成一直增加[22]。
充分授粉后板栗子房GA3质量分数在授粉后24 d第二次达到最大值,此时蔗糖质量分数也达到最大值[23],表明GA3可诱导淀粉酶合成以促进淀粉向蔗糖转化,进而增加同化物向种仁运输。幼果发育初期的IAA质量分数变化与GA3基本一致,这种变化对果实早期发育过程中(GA3+IAA)质量分数维持在较高水平有促进作用,两者共同作用促进果肉细胞伸长生长[24]。果实迅速膨大前,IAA可加速细胞体积增大和缩短细胞分裂周期[25]。GA3、IAA、ZR和IPA均参与胚乳的发育进程[26-27],这4种激素在授粉后16~21 d均增加,且细胞分裂素质量分数在授粉后21 d达到最大值,可见受精后主要由ZR和IPA促进胚乳分裂增殖。秦智伟等[6]研究发现,精卵融合和合子胚发育有利于ZR合成,从而增加黄瓜(CucumissativusL.)种子产量。周志翔等[13]和曾柏全等[12]表明,IPA质量分数较高有利于板栗胚胎的正常发育,而郭素娟等[11]发现,授粉受精过程中子房内IP质量分数基本处于下降状态,认为该过程对IP质量分数要求较低,这与本试验结果相反,推测可能与板栗品种不同有关,IP对受精过程的影响需进一步研究。果实发育初期较高水平的细胞分裂素可能对授粉受精、细胞快速分裂和加速种仁发育有调控作用[28]。授粉后合成ABA关键基因的mRNA水平下降,而ABA降解基因的表达量增加[29],可能是ABA质量分数在授粉受精过程中持续降低的原因,且较高水平的ABA可能诱导胚乳等营养器官解体[30],进而导致胚珠败育与落果。
不同激素间的信号传导网络相互交叉,通过相互协同或拮抗的方式调控植物的生长发育过程[31],因此,不同激素及激素间的平衡可能均参与座果和果实早期发育进程[32]。本研究发现,(GA3+IAA+CTKs)质量分数/ABA质量分数在细胞分裂期迅速增加至最大值后减少,表明该比值较大有利于胚乳及幼胚发育进而影响种仁发育,在杧果(MangiferaindicaL.)上有类似结果[33]。
总之,授粉受精不良将导致板栗结实率降低,且受精作用有利于GA3、IAA、ZR、IPA、IP的大量合成及(GA3+IAA+CTKs)质量分数/ABA质量分数的增加并抑制ABA质量分数增加,进而调控板栗座果与果实早期正常生长发育。本研究将果实发育阶段与内源激素结合分析板栗座果及果实发育进程,但对某种激素在某个时期发挥主要作用的分子机理有待研究。
