拟南芥不同组织细胞对DAPI染色的差异分析
2020-05-28于静芳尹润竹
于静芳,尹润竹,周 俊
(华南师范大学生物光子学研究院激光生命科学研究所暨激光生命科学教育部重点实验室, 广州 510631)
4’6-二脒基-2-苯基吲哚(4’6-diamidino-2-phenylindole,DAPI)最早是由德国化学家Dann[1]在寻找新的抗锥虫药物时发现的一种二脒类化合物。研究人员发现当DAPI结合在DNA上时荧光显著增强,尤其对富含A-T序列的DNA具有很高的吸附能力[2]。进一步的研究揭示,DNA酶能严重削弱DAPI的荧光,而RNA酶则对其无明显影响[3]。这些试验结果引起了该领域其他科学家的注意,DAPI作为一种DNA特异性荧光染料的应用得到了进一步探索。随后,DAPI在荧光显微观察细菌[4]、植物[5,6]和哺乳动物细胞[7,8]DNA中的实用性被证明。DAPI作为DNA染料具有优良的性能,它以二氯化物或二乙酸盐的固态形式,在黑暗中可以保存数年而不分解[9]。此外,DAPI易溶于水,在水溶液中能稳定保存数月。DAPI溶液的吸收光谱中有3个吸收峰,分别在222、259、340 nm。自由染料形式的DAPI荧光量子产率很低,最大荧光发射峰为453 nm。当DAPI与DNA结合时,最大激发峰发生红移,发射峰发生蓝移,荧光量子产率增加近20倍[9]。
随着DAPI广泛用于生物染色和DNA分析,其与核酸相互作用的机制也逐渐被阐明。早期研究认为DAPI形成荧光复合物需特异性要求双链DNA并富含A-T碱基序列[1,3],后来发现单链和双链RNA都能够与DAPI形成复合物,但是这些复合物的荧光比DAPI结合双链DNA的荧光要弱很多[10]。进一步的研究发现DAPI并不是直接插入到DNA中,而是结合到B型DNA小沟(minor groove)中[11]。该荧光复合物与天然DNA分子几乎具有相同构象,每个DNA双螺旋结构有1个DAPI和25个水分子[11]。DAPI沿边缘结合到狭窄的DNA小沟中,展现出有序的水合脊柱(hydration spine)。DAPI和单个水分子一起跨越了DNA双链中心的4个A-T碱基对。其中,DAPI的吲哚氮与2个中心碱基对的胸腺嘧啶氧原子形成1个交叉的氢键[11]。DAPI优先结合A-T碱基区域的原因在于:1)相比于G-C碱基区域,A-T碱基区域形成的小沟较窄,导致小沟壁之间扁平芳香环的紧密契合;2)由于缺乏阳性的鸟嘌呤,A-T碱基区域的小沟具有更多的负向静电势[9]。碱基对之间的沟槽宽度和静电因素是导致DAPI偏爱结合A-T碱基区域的重要原因。
目前,DAPI作为一种细胞核荧光染料,在植物不同组织染色中的应用仍缺乏比较系统的表征。本文,我们构建了核定位的BAG5-eYFP转基因植物,探究了植物不同组织响应DAPI染色的差异情况。研究结果显示,非化学固定的植物叶片表皮细胞和叶肉细胞能被DAPI染色,二者对于活体细胞核的功能研究将会是很好的模型。
1 材料与方法
1.1 植物材料与培养
植物的培养同之前方法[12,13],野生型(Columbia-0)、线粒体marker CoxIV-RFP及转基因UBQ10∶BAG5-eYFP拟南芥种子经75%乙醇(含0.05% Triton X-100)震荡消毒10 min,随后于超净台中用100%乙醇置换,并转移到灭菌滤纸上,干燥15~20 min后,撒种于1/2 MS固体培养基上。4 ℃冰箱中黑暗处理2 d,然后放置于人工培养箱,光周期为16 h(光)/8 h(暗),昼夜温度为23 ℃(昼)/21 ℃(夜),生长5 d的拟南芥幼苗转移至营养土中继续培养。
1.2 转基因植物构建
双元载体121-UBQ10∶BAG5-eYFP-NOS采用片段同源重组方法,过程简述如下:121-UBQ10∶MCS-eYFP-NOS(由本实验室改造保存)经BamH I(NEB)和KpnI(NEB)酶切,胶回收后获得线性化载体,-20 ℃保存备用。PCR扩增得到拟南芥BAG5 cDNA片段,引物为:BAG5-F:tttctgattaacagggatccATGAAACG TTCAAGAAAATTCT;BAG5-R:tcaccatcccgggggtaccTTCT CTGAGAAATCTCTGGAAAC(小写为载体同源序列)。利用试剂盒[ClonExpress Ultra One Step Cloning Kit(Vazyme, Nanjing)]完成线性化载体和BAG5cDNA片段的重组。挑取阳性克隆,提取质粒后,经测序确认BAG5序列是否正确。
UBQ10∶BAG5-eYFP转基因植物通过蘸花法获得,过程简述如下:利用电击法将质粒121-UBQ10∶BAG5-eYFP-NOS转入根癌农杆菌GV1301中;菌落PCR验证,选取阳性克隆,LB液体培养基(含有50 μg/mL卡那霉素和50 μg/mL利福平)扩大培养24 h,5 000 r/min离心3 min;菌体用5%蔗糖(0.01% Silwet L-77)重悬,蘸花于5周龄的拟南芥,重复4次,每周1次。收获的种子在MS培养基(含有50 μg/mL卡那霉素)上筛选,挑取抗性植物并经荧光显微镜确认荧光,第三代(F3)用于后续试验。
1.3 DAPI处理
DAPI(CAT #D9542)购置于Sigma公司。用0.1 mol/L磷酸盐(pH 7.4)配置成质量浓度为0.5 mg/mL的工作液,储存于4 ℃。取培养箱中生长5 d的拟南芥幼苗置于上述DAPI染色液中,20 min后用去离子水冲洗3次。多聚甲醛固定处理步骤如下:用0.1 mol/L磷酸盐配置4%多聚甲醛,先加入NaOH使其充分溶解,后用HCl将pH调回到7.4。取苗龄为5 d的拟南芥幼苗置于上述固定液中2 h,去离子水冲洗3次,再置于DAPI染色液中浸染20 min。
1.4 激光共聚焦成像
激光共聚焦参考之前方法[14-16]。挑取DAPI染色20 min的植物幼苗,ddH2O冲洗3次,置于载玻片上;倒置于LSM880型激光共聚焦扫描显微镜(laser scanning confocal microscope,LSM880,ZEISS)载物台上,选取63倍油镜,检测观察幼苗根部、下胚轴、叶片等组织部位。DAPI激发光为405 nm,荧光的采集波段为435~500 nm;eYFP激发光为514 nm,荧光的采集波段为518~550 nm;CoxIV-RFP的激发光波长为561 nm,荧光的采集波段为580~620 nm;叶绿素激发光为488 nm,荧光的采集波段为650~720 nm。采用Zen 2.5软件系统分析试验图像和数据。
2 结果与分析
2.1 活体植物的叶片表皮细胞核能被DAPI染色
为了探究DAPI染色在植物中的应用,我们首先构建了UBQ10∶BAG5-eYFP转基因植物。从图1中可看出eYFP的荧光主要出现在各组织的细胞核中。为了进一步证实该结果,我们对各组织活体细胞进行了DAPI染色。结果显示不同组织响应DAPI染色表现出很大的差异(图1)。保卫细胞(guard cell)、根部分生区细胞(root meristem)和根毛(root hair)的细胞核较难染色,而叶片下表皮细胞(epidermal cell)和下胚轴细胞(hypocotyl cell)的细胞核能够较易被DAPI染色(图1)。相比于下表皮细胞,根部的荧光信号主要集中在细胞壁区域(图1),说明DAPI很难跨过根部细胞膜进入活体细胞。值得注意的是,在叶片下表皮和下胚轴细胞中有一些点状的荧光信号,推测其可能为线粒体DNA。
2.2 活体植物的线粒体能被DAPI染色
为了验证图1中点状荧光是否为线粒体,我们对内源表达的线粒体分子标记植物35S∶CoxIV-RFP进行了DAPI染色。图2显示CoxIV-RFP和DAPI的荧光具有很好的共定位,说明这些小的点状结构应为线粒体。接下来我们探究了同样具有DNA的植物细胞器叶绿体是否能被DAPI染色。从图2中可以看出,叶肉细胞的线粒体和细胞核都能被DAPI染色,说明DAPI能够进入该活体组织细胞。然而,DAPI的荧光并不能和叶绿体自发荧光共定位。因此,不同亚细胞器线粒体和叶绿体对DAPI染色同样表现出很大差异。

图1 拟南芥不同组织响应DAPI染色的差异Fig.1 Differential responses of DAPI staining in different tissues of Arabidopsis5 d苗龄的UBQ10∶BAG5-eYFP稳转基因植物在DAPI染色液中浸染20 min,去离子水冲洗3遍后,激光共聚焦检测各组织区域。比例尺为20 μm5-day old UBQ10∶BAG5-eYFP stable transgenic plants were stained with DAPI for 20 min. After washed with ddH2O three times, the different tissues were detected by confocal microscopy.Bar=20 μm
2.3 多聚甲醛固定促进DAPI在根部和气孔保卫细胞的染色
DAPI穿透活细胞膜是浓度依赖性的,它通常被认为是半通透性染料。我们随后探究了多聚甲醛固定之后对植物组织DAPI染色的影响。5 d苗龄的转基因植物UBQ10∶BAG5-eYFP在4%多聚甲醛溶液中固定2 h。共聚焦检测发现,保卫细胞、根部分生区及过渡区的细胞核在固定之后能够被DAPI染色(图3)。但值得注意的是,化学固定使得BAG5-eYFP的荧光出现不同程度的弥散情况。因此,在探究细胞核的功能研究时应充分考虑化学固定因素对蛋白定位的影响。
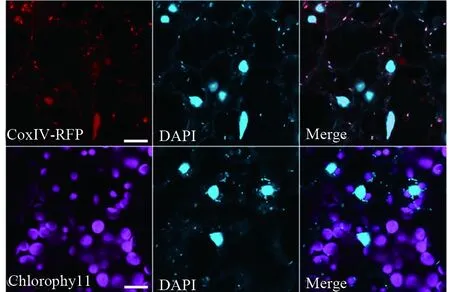
图2 线粒体和叶绿体响应DAPI染色的差异Fig.2 Different responses of DAPI staining between mitochondria and chloroplast5 d苗龄的线粒体marker 35S∶CoxIV-RFP稳转基因植物叶片在DAPI染色液中浸染20 min,去离子水冲洗3遍后,激光共聚焦检测叶片下表皮和叶肉细胞。比例尺为20 μmThe leaf of 5-day old 35S∶CoxIV-RFP transgenic plants were stained with DAPI for 20 min. After washed with ddH2O three times, the leaf abaxial epidermis and mesophyll cells were examined by confocal microscopy. Bar=20 μm
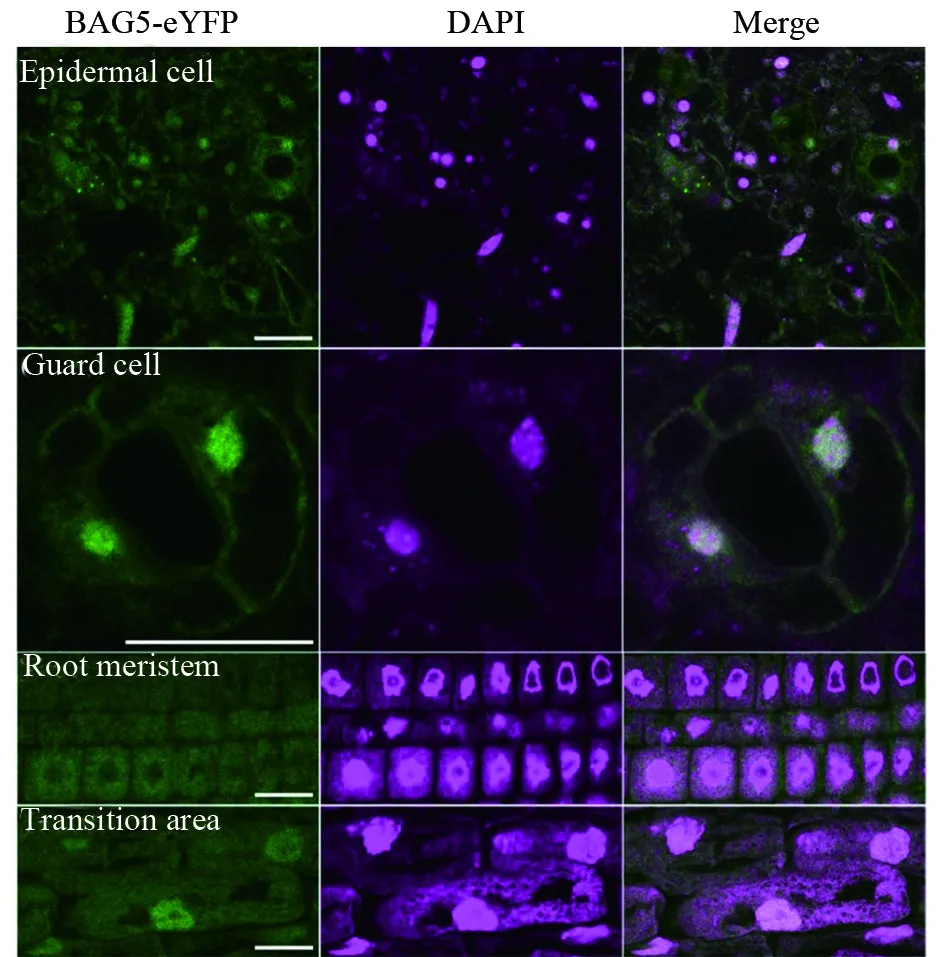
图3 多聚甲醛固定后不同组织的DAPI染色Fig.3 DAPI staining of different tissues after fixed with paraformaldehydeUBQ10∶BAG5-eYFP转基因植物在4%多聚甲醛中固定2 h,去离子水冲洗3遍后,在DAPI染色液中浸染20 min,激光共聚焦检测各组织区域。比例尺为20 μmThe UBQ10∶BAG5-eYFP transgenic plants were fixed in 4% paraformaldehyde for 2 hours. After washed with ddH2O three times, the plants were immersed in DAPI solution for 20 min. Different tissues were examined by confocal microscopy. Bar=20 μm
3 讨论
DAPI是一种常用的细胞核标记荧光染料,它可与双链DNA相结合,用于指示化学固定细胞的细胞核。DAPI通常被认为是半膜通透性染料,因为它穿透活的细胞膜具有浓度依赖性[17]。在比较低的浓度时,它基本上被排除在活细胞之外;而在较高浓度时,它对活细胞和死细胞的染色程度大致相同[17]。本文构建了一个细胞核定位的BAG5-eYFP转基因植物,首次比较系统地探究了模式植物拟南芥各组织细胞对DAPI染色的响应情况。结果显示,在相同浓度的DAPI下,活细胞中的染色差异主要取决于不同组织细胞类型。生物细胞膜主要由蛋白质和脂质组成,一定的膜流动性及通透性与物质和能量交换、信息分子传递等多种生物功能具有密切联系[18,19],这对维持细胞正常生理代谢功能具有重要的意义。不同组织细胞在植物正常生长发育中扮演不同的角色和功能,细胞膜通透性的不同可能是导致其对DAPI染色表现出较大差异的重要原因。
作为半自主性细胞器,线粒体和叶绿体都具有独立的遗传物质DNA。我们发现线粒体DNA较易被DAPI染色,而同一细胞中的叶绿体则不能被DAPI染色。A-T碱基对之间较小的沟槽宽度和负向静电势,使得DAPI偏爱结合DNA的A-T碱基区域[9]。而线粒体DNA序列富含A-T碱基[20],这可能是其相对于叶绿体较易被染色的主要原因之一。线粒体和叶绿体都是具有双层膜结构的细胞器。但不同于叶绿体,线粒体内膜两侧存在质子及其他离子浓度不对称分布而形成的膜电位[21]。后者是很多染料分子如罗丹明及其衍生物标记识别线粒体的重要基础。目前,对于膜电位是否能够促进DAPI的跨膜运动还有待进一步证明。
相比于活体组织,多聚甲醛固定之后,根部分生区、过渡区和气孔保卫细胞均能被DAPI染色。这些结果进一步说明细胞膜通透性是DAPI染色的关键。但是,我们发现多聚甲醛的固定导致BAG5-eYFP细胞核的荧光出现很大程度的弥散。由于化学固定往往杀死细胞,不利于实时监测胞质和核的蛋白转运等动态信息,因此,叶片表皮细胞和叶肉细胞对于DAPI染色将会是很好的模型,这对于探究植物活体细胞核的功能研究具有重要意义。
