SWE-Emax与乳腺癌分子分型及远期预后的关系研究
2020-05-28李博杜燕王静刘静任雨诗姜珏
李博 杜燕 王静 刘静 任雨诗 姜珏
乳腺癌是一类具有高度异质性恶性肿瘤, 以往对于此类患者多通过肿物直径、组织学分级进行预后评估[1]。近年来分子生物学检查和分子分型已被逐渐用于乳腺癌预后预测及治疗指导,但以上指标均依赖于术前或术后组织病理检查,存在有创、难以完整评价乳腺癌肿物或信息滞后等问题,难以满足临床需要[2]。已有研究显示,乳腺癌分子生物学特性是影响生物学行为关键因素,引起组织形态及病理变化,导致肿物硬度改变[3];剪切波弹性成像(SWE)属于超声影像学检查技术,其可通过检测最大弹性(Emax)值评价肿物硬度,从而用于乳腺癌诊断及鉴别诊断,但Emax值是否与分子生物学特性间存在相关性仍存在一定争议[4]。本文旨在探讨SWE-Emax对乳腺癌分子分型及远期预后的关系,为后续预后评估及治疗方案制定提供更多的依据。
1 资料与方法
1.1 一般资料 选取西安市北方医院2014年7月至2018年7月收治的乳腺癌患者共80例86个病灶,均经病理活检证实乳腺癌,其中浸润性导管癌72个,浸润性小叶癌5个,导管内癌4个,导管内乳头状癌2个,髓样癌1个,黏液癌2个。术前采用SWE检查并获得肿物SWE-Emax 值,且临床资料完整;同时排除术前接受放化疗或内分泌治疗、术后未行组织分级、免疫组化或分子分型评价者。
1.2 方法 检测仪器采用法国声科影像AixPlorer 彩超诊断仪,探头频率设置为4~16 MHz;仰卧位下保证乳房充分暴露,测量肿物最大直径;切换至SWE模式并根据肿物直径调整取样框大小和位置,对于肿物直径过大者可通过多次取样获得完整硬度信息。选取肿物内部及周边颜色最亮处测量获得Emax值, 重复测量3次取平均值。
1.3 观察指标 (1)组织学分级依据《乳腺癌2012版WHO组织学分类》[5],即依据腺管、细胞异型及核分裂像分为Ⅰ~Ⅲ级;(2)免疫组化检测指标包括ER、PR、HER-2及Ki-67,检测仪器采用罗氏Ventana全自动免疫组化仪;其中结果判读:ER和PR阳性指肿瘤细胞核染色比例≥10%,Ki-67阳性至细胞染色细胞≥ 14%;依据《乳腺癌HER2检测指南(2014版)》[6]评价HER-2表达状态,即免疫组化3+和免疫组化2+且FISH检测阳性;(3)乳腺癌分子亚型依据2013年St Gallen共识[5],包括Luminal A型、Luminal B型、Her-2阳性型及三阴型。
2 结果
2.1 乳腺癌患者SWE-Emax与肿物直径和组织学分级相关性分析 乳腺癌患者肿物直径与SWE-Emax值呈正相关(P<0.05);但肿物组织分级与SWE-Emax 值间并无相关性(P>0.05)。见表1。
2.2 乳腺癌患者免疫组化指标阴性和阳性间SWE-Emax比较 ER和PR阴阳性乳腺癌患者肿块SWE-Emax值组间比较差异无统计学意义(P>0.05);HER-2阳性和Ki-67阳性乳腺癌患者肿块SWE-Emax值均显著大于阴性者(P<0.05)。见表2。
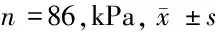
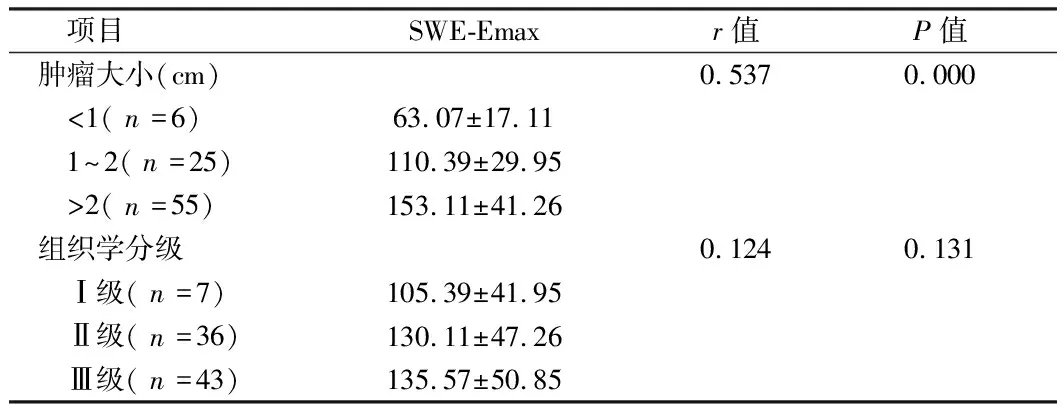
项目SWE-Emaxr值P值肿瘤大小(cm)0.5370.000 <1(n=6)63.07±17.11 1~2(n=25)110.39±29.95 >2(n=55)153.11±41.26组织学分级0.1240.131 Ⅰ级(n=7)105.39±41.95 Ⅱ级(n=36)130.11±47.26 Ⅲ级(n=43)135.57±50.85
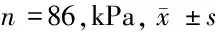
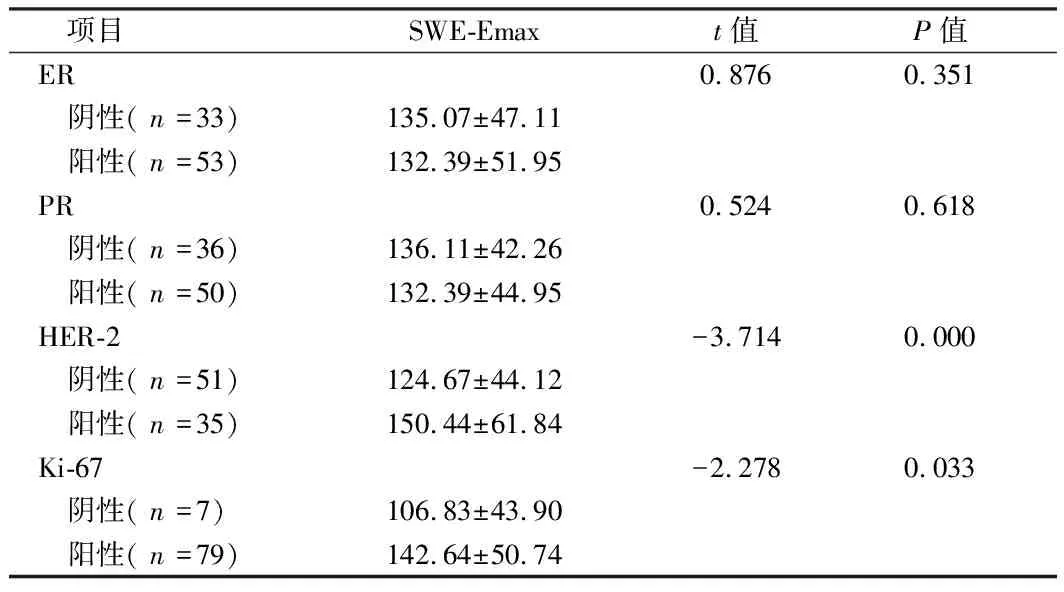
项目SWE-Emaxt值P值ER0.8760.351 阴性(n=33)135.07±47.11 阳性(n=53)132.39±51.95PR0.5240.618 阴性(n=36)136.11±42.26 阳性(n=50)132.39±44.95HER-2-3.7140.000 阴性(n=51)124.67±44.12 阳性(n=35)150.44±61.84Ki-67-2.2780.033 阴性(n=7)106.83±43.90 阳性(n=79)142.64±50.74
2.3 乳腺癌患者不同分子亚型间SWE-Emax比较 HER-2阳性型乳腺癌患者肿物SWE-Emax值最大, 后面依次为Luminal B型、 三阴型及Luminal A 型;单因素方差分析显示不同分子亚型乳腺癌患者间肿物SWE-Emax值比较差异有显著性(P<0.05)。见表3。
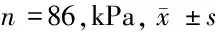

分子分型SWE-EmaxF值P值Luminal A(n=34)107.94±36.4413.2840.000Luminal B(n=22)144.44±43.84Her-2阳性(n=14)179.05±57.68三阴(n=16)135.61±52.81
2.4 乳腺癌患者肿物SWE-Emax可能影响因素多元分析 多元线性回归方程代入肿物直径、HER-2阳性、Ki-67阳性及分子亚型,提示肿物直径和HER-2阳性表达是影响乳腺癌患者肿块SWE-Emax值重要因素,且肿物直径影响最大(P<0.05)。见表4。

表4 乳腺癌患者肿物SWE-Emax可能影响因素多元分析
3 讨论
乳腺癌分子生物学因素决定着分子生物学行为及病理组织学改变,其中异常分子表达可导致组织形态和硬度改变[7]。而SWE技术作为一种新型弹性成像技术,所获得肿物组织弹性数值能够用于评价组织硬度,其中Emax值用于乳腺良恶性病灶鉴别诊断效能更佳[8]。本研究通过分析乳腺癌肿物SWE-Emax与肿物直径、组织学分级、免疫组化指标及分子分型间相关性, 旨在为SWE-Emax用于乳腺癌治疗方案选择及预后评价提供更多依据。
本研究结果中,乳腺癌患者肿物直径与SWE-Emax值呈正相关(P<0.05),即随肿物直径增大, Emax随之增大,同时多元线性回归分析提示肿物直径对乳腺癌患者肿物SWE-Emax影响最大(P<0.05),与以往学者报道结果[9]相符,笔者认为造成这一现象可能原因为结缔组织增生、细胞构成及血管形成是影响肿物硬度重要因素,较大肿物结缔组织增生较小肿物更为严重,且较大肿物存在更多细胞构成、血管形成及间质改变,以上均可导致肿物硬度增加。
本研究结果中,肿物组织分级与SWE-Emax值间无相关性(P>0.05),笔者认为组织学分级Ⅰ级肿物结缔组织增生较Ⅲ级多,但组织学分级较高者伴随微血管密度和细胞结构致密度较高,以上因素均可造成硬度值变化,故共同作用到引起两者间未见显著相关。既往部分学者报道结论[10]与此不符,认为两者间具有相关性,笔者分析认为可能与纳入患者组织学分级比例存在差异有关,本次研究组织学分级Ⅰ级肿物仅7例,故结果亦存在偏倚可能。
本研究结果中,ER和PR阴阳性乳腺癌患者肿块SWE-Emax值组间比较差异无显著性(P>0.05);已有研究证实,ER和PR阴性乳腺癌肿物多具有体积大、组织学级别高、微血管生成及间质水肿多等特点,故硬度随之增加[11,12];而ER 和PR阳性则与肿物内微钙化灶密切相关,微钙化可导致肿物硬度增加,以上因素综合作用导致ER 和PR阳性与硬度值间相关性并不明显。同时HER-2阳性和Ki-67阳性乳腺癌患者肿块SWE-Emax值均显著大于阴性者(P<0.05), 且多元线性回归分析提示HER-2阳性表达是影响乳腺癌患者肿块SWE-Emax值重要因素,笔者分析认为 HER-2阳性乳腺癌患者肿物微血管密度更高、间质水肿更多组织硬度更大,故肿物SWE-Emax值可反映HER-2表达情况。Ki67是反映乳腺癌患者肿物增殖活性重要指标之一, 本研究结果中,Ki-67阳性组SWE-Emax 值较阴性组更高,提示随Ki-67 表达增加,乳腺癌患者肿物恶性程度更高,肿瘤细胞处于高增殖和高表达状态, 向周围组织持续侵袭,引起粘连出现,最终导致肿物弹性减小而硬度增加[13]。
通过分析乳腺癌患者不同分子亚型间SWE-Emax,笔者发现HER-2阳性型乳腺癌患者肿物SWE-Emax值最大,后面依次为Luminal B型、 三阴型及Luminal A 型;同时单因素方差分析显示不同分子亚型乳腺癌患者间肿物SWE-Emax值比较差异有显著性(P<0.05);笔者认为HER-2阳性型乳腺癌患者表达ER和PR 阴性,HER-2阳性,其中HER-2处于过度增殖状态,肿物微血管密度高,同时间质水肿较多,而ER和PR表达阴性则伴随着肿物体积较大及组织学级别较高特点,故组织学硬度增大[11];Luminal B型乳腺癌患者肿物SWE-Emax增高可能原因为部分患者肿物HER-2阳性有关[14]。同时笔者观察到研究中三阴型乳腺癌患者肿物SWE-Emax值亦较大,但低于HER-2阳性型肿物, 这一现象与其肿物生物学侵袭性强、进展快及预后差有关,患者在临床确诊时往往已进展至晚期,存在液化坏死较多[15]。以上数据均提示SWE-Emax值可用于乳腺癌肿物分子亚型预测;此外多项体外研究亦表明,乳腺癌患者肿物硬度与进展程度、临床预后存在一定相关性[16],故术前采用SWE检查有助于帮助临床医师获得更多乳腺癌患者病情进展及临床预后信息。
综上所述,乳腺癌患者肿物SWE-Emax值与HER-2、Ki-67表达具有相关性,临床预后差分子亚型乳腺癌患者肿物SWE-Emax值较高;SWE可在一定程度上为乳腺癌患者临床预后评价及治疗方案制定提供依据。
