超声辅助制备淀粉微晶及其对姜黄素的吸附
2020-05-26谢嵬旭张华丽齐若男苏玉春汪树生
谢嵬旭 张华丽 齐若男 苏玉春 汪树生
(吉林农业大学,长春 130118)
玉米淀粉是由结晶区和非结晶区共同组成的大分子聚合物,其分子式为(C6H10O5)n。由于其产能过剩,并且原淀粉的结构导致其应用领域受限,所以开发淀粉的新用途在当今社会尤为重要。对原淀粉进行处理,使其具有适合某种特殊用途的性质、增加其利用途径的这一过程被称为淀粉变性,其产品称为变性淀粉,淀粉微晶是变性淀粉的一种。用酸对淀粉进行长时间温和水解,或者用酶对淀粉颗粒温和水解50%以上得到的固体与原淀粉相比,结晶度均有所增加,这种剩余产物称为淀粉微晶[1]。一般而言利用酸或者酶将淀粉颗粒中的非结晶区减少甚至除去,或者将淀粉链变短提高结晶度会得到淀粉微晶[2]。早在20世纪, Robin等[3]和Stephen等[4]开始研究水解法制备淀粉微晶,利用强酸破坏淀粉松散的无定型区,剩下的产物为淀粉中难以被酸破坏的结晶区,这种淀粉被称作Lintners淀粉[5]。
淀粉微晶包括淀粉微晶束、片晶或其他晶形的聚集体[6~9]。其比表面积和孔洞相对于原淀粉来讲均有所增加,使其具有良好的吸附性能等。利用不同方法制备的淀粉微晶可以改良淀粉的某一特性供人们更好地利用。淀粉微晶中含有的葡萄糖以及葡萄糖聚合物使其具有一定的甜度,可以用做食物的甜味剂;淀粉微晶做的食物可以用作膳食,由于淀粉微晶能够很好地模仿脂肪的口感,并且在人体中分解吸收较为缓慢,可以用作脂肪的取代品,作为减肥食品。用它来做药物的赋形剂拥有良好的崩解能力,使药物药效快分散快[10,11]。目前生产淀粉微晶的主流方法是通过回生法、水解法、结晶法、冷冻结晶法等途径,水解淀粉的非结晶区,或者是将非结晶区转变为结晶区,使其结晶度增大。但是目前制备淀粉微晶工序烦琐,前期投入高,不利于工业生产。超声波是一种机械波,作用机制体现在高温分解和自由基撞击以及机械化学作用,在盐酸溶液中,可以有效破坏淀粉颗粒中的C-C键,降低淀粉颗粒的分子质量,促使淀粉水解的正向进行[12]。因此,本研究采用超声波辅助酸醇水解制备淀粉微晶,为淀粉的工业利用找到一种成本低廉、操作简单、反应可控的制备途径。
1 材料与方法
1.1 实验材料
玉米淀粉(食品级);盐酸(分析纯36%~38%);姜黄素(分析纯);碳酸氢钠(分析纯99.5%);乙醇(分析纯99.7%);3,5-二硝基水杨酸(分析纯);氢氧化钠(分析纯);酒石酸钾钠(分析纯)。
1.2 实验仪器
101-2AB电热鼓风干燥箱;SHB-B95 型循环水式多用真空泵;722S分光光度计;X1R高速冷冻离心机;KQ-250B超声波清洗器;HZQ-F160振荡培养箱;SSX-550扫描电子显微镜。
1.3 方法
1.3.1 淀粉微晶的制备
称取30.00 g玉米淀粉,分散到100 mL盐酸和乙醇混合溶液中,25 ℃恒温水浴超声处理30 min后迅速置于恒温摇床中,在设定的转速和温度下水解。反应结束后,加入碳酸氢钠终止反应,4 000 r/min离心5 min,摒除上清液,加入100 mL蒸馏水洗涤至中性后,抽滤,40 ℃烘干12 h,经粉碎、研磨、过100目筛后,得到淀粉微晶。装入密封袋保存、备用。实验重复3次。
1.3.2 DNS法测定淀粉水解率
首先进行葡萄糖标准曲线的制作[13]。取1 g 葡萄糖放置80 ℃烘箱中烘干至恒重,取出后精确称量0.050 0 g葡萄糖溶解于蒸馏水中,定容至50 mL,制得1 mg/mL的葡萄糖标准液,用蒸馏水分别稀释成0.2、0.4、0.6、0.8 mg/mL的葡萄糖溶液。取1 mL不同浓度的葡萄糖溶液放入装有3 mL DNS溶液的试管中,沸水浴反应5 min后,迅速冷却至室温。用分光光度计在540 nm波长下的测定吸光度,得到葡萄糖浓度(x)与吸光度(y)关系为y=5.285 8x(R2=0.993 2)。
然后测定淀粉水解率,量取适当稀释的淀粉水解液1 mL,测量吸光度,利用公式计算淀粉水解率。
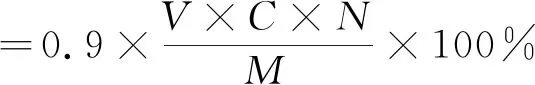
式中:C为稀释后由DNS法测得的吸光度由回归直线方程求的浓度;N为稀释倍数;V为上清液的体积;M为淀粉的质量。
1.3.3 姜黄素吸附量的测定
精确称量干燥的姜黄素标准品0.500 0 g 溶于乙醇溶液中,定容至500 mL,制得1 mg/mL的姜黄素标准液,用乙醇分别稀释成2、4、6、8、10 mg/L的溶液。用分光光度计在438 nm波长下测量吸光度,绘制标准曲线。姜黄素浓度(x)与吸光度值(y)的对应关系为y=0.109 3x(R2=0.999 8)。随后称取淀粉5.00 g,加入25 mL的姜黄素溶液,并置于30 ℃、160r/min恒温摇床中,避光吸附2 h后,离心,取上清液稀释,使其吸光度落在姜黄素标准曲线上,在438 nm波长下测量其吸光度。利用公式计算姜黄素吸附量。
式中:C为上清液的吸光度;N为稀释倍数。
1.3.4 单因素实验
以姜黄素吸附量为指标,分别考察盐酸浓度、乙醇浓度、水解温度、水解时间对吸附量的影响,并确定单因素的最佳值。因素变化范围为:水解时间(48、60、72、84、96 h)、乙醇体积分数(0%、20%、40%、60%、80%)、盐酸浓度(1、1.5、2、2.5、3 mol/L)、水解温度(20、30、40、45、50、55 ℃)。
1.3.5 响应面实验
以单因素的实验结果为依据,以姜黄素的吸附量为指标,遴选每个条件的最显著的3个水平,利用Design-Expert.8.05b软件中的Box-Behnken Design设计响应面实验,并且进行数据分析。
1.3.6 电镜观察
采用SSX-550型电子显微镜进行扫描电镜分析,观察淀粉微晶的表面形貌。将样品用碳胶带固定于载物台上,用金粉镀覆,于真空环境下用5.00 kV的加速电压观察并采集图像。
1.3.7 X射线衍射观测
采用D8 ADVANCE广角X射线衍射仪,在条件为Cu靶、1.54埃进行3°~60°的X射线衍射,利用Jade6.0绘制并分析样品的衍射图谱。
2 结果分析
2.1 单因素分析
2.1.1 水解时间对淀粉水解率及姜黄素吸附量的影响
如图1所示,随着水解时间的增加,淀粉水解率不断提高,然而淀粉微晶对姜黄素的吸附能力是先增加后降低,在72 h达到最大值。原因是支链淀粉构成淀粉颗粒的骨架,直链淀粉构成的非结晶区随机点缀在淀粉颗粒上[2,14]。随着淀粉水解率增加,直链淀粉水解增多,淀粉骨架逐渐裸露,淀粉的比表面积和吸附位点增加[15]。随着水解率继续增大,淀粉颗粒渐渐瓦解,使其吸附性能降低。
2.1.2 乙醇浓度对淀粉水解率及姜黄素吸附量的影响
从图1可以看出随着乙醇浓度的增加,淀粉水解率不断降低,淀粉微晶对姜黄素的吸附能力是先增加后降低,这一水解趋势与卢未琴[2]的研究一致。在乙醇体积分数60%时达到最大值,此时淀粉微晶的吸附性能最佳。在本反应体系中,乙醇的作用不仅是减少与水接触来限制淀粉微晶的水解,同时也作为络合稳定剂稳固了即将水解的淀粉链,乙醇浓度越大这种稳固效果越明显。在降低淀粉颗粒水解率的同时,淀粉颗粒完整性逐渐变大,导致淀粉微晶吸附能力的下降[16]。
2.1.3 盐酸浓度对淀粉水解率及姜黄素吸附量的影响
从图1中可以看到随着盐酸浓度的增加,淀粉水解率先显著增加后缓慢增加,淀粉微晶对姜黄素的吸附能力是先增加后降低,在盐酸浓度达到2 mol/L时达到最大值。原因是淀粉颗粒结晶区和非结晶区的淀粉链的排列方式不同,结晶区的糖苷键不易被接近,很难被水解[5],所以淀粉颗粒水解分为两个阶段,第一阶段主要是非结晶区的水解,此时淀粉比表面积增加,吸附位点变多;第二阶段是结晶区参与水解比例增加。淀粉结晶区参与水解比例大大增加,吸附位点逐渐减少,限制了淀粉微晶吸附性能。

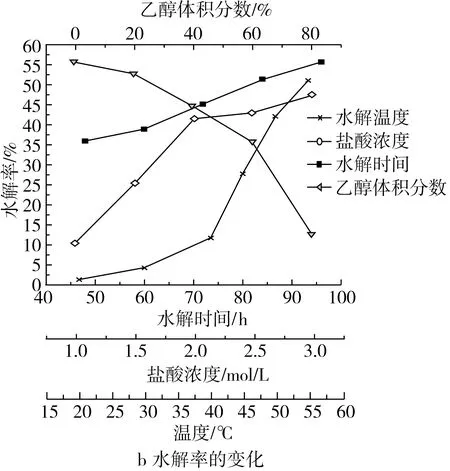
图1 不同水解条件下淀粉微晶吸附量和水解率的变化
2.1.4 水解温度对淀粉水解率及姜黄素吸附量的影响
如图1所示,随着水解温度的增加,淀粉水解率逐渐增加,淀粉微晶对姜黄素的吸附能力是先增加后降低,在水解温度达到50 ℃时达到最大值。原因是随着水解温度逐步增加,分子活跃性增大,氢离子与淀粉分子接触频率增多,反应更加剧烈,导致淀粉水解率逐步增强;在50 ℃后,淀粉结晶区参与水解,淀粉分子孔洞变大,淀粉微晶的吸附位点减少,吸附姜黄素的能力随之下降。
2.2 响应面分析
2.2.1 响应面条件的确定及结果
选取单因素实验中对姜黄素吸附较为显著的3个水平,进行包括水解时间(A)、乙醇浓度(B)、盐酸浓度(C)及水解温度(D)在内的四因素三水平响应面实验,如表1所示。以姜黄素吸附量为考察指标,预测淀粉微晶的最佳反应条件。响应面条件组合及响应值如表2所示。

表1 响应面因素水平

表2 响应面条件组合及响应值
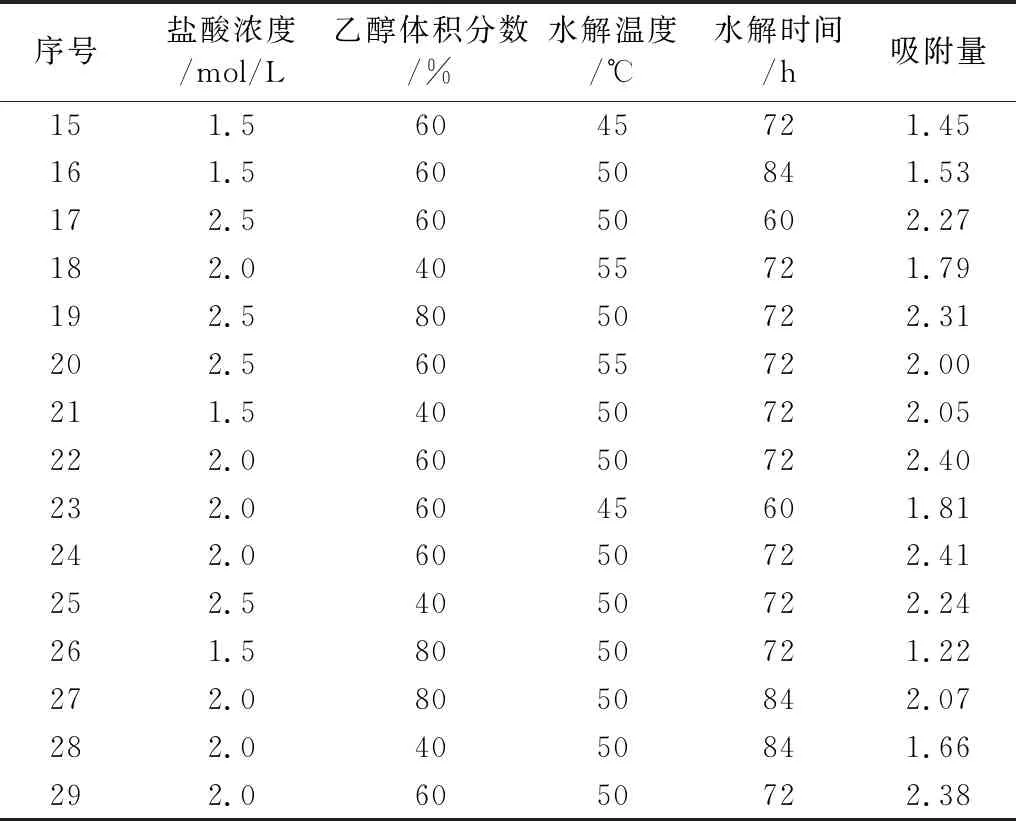
表2(续)
利用Design-Expert.8.05b软件对结果进行拟合,得到盐酸浓度(A)、乙醇浓度(B)、水解温度(C)、水解时间(D)4种因素交互作用制得的淀粉微晶对姜黄素吸附量(R)影响的二次多项回归方程为:R=2.36+0.22A-0.084B+0.15C-0.043D+0.22AB-0.13AC-0.093AD+0.077BC+0.24BD-0.007 5CD-0.22A2-0.25B2-0.31C2-0.23D2
2.2.2 回归模型的方差分析
利用Design-Expert.8.05b软件对结果进行方差分析,回归方程模型的方差分析见表3。

表3 回归方程模型的方差分析
注:***为差异性极显著(P<0.001);**为差异性高度显著(P<0.01);*为差异显著(P<0.05)。

盐酸浓度与乙醇浓度交互和盐酸浓度与水解温度的交互作用最明显,淀粉酸水解的原理是反应体系中的H+作用到糖苷键上,致使淀粉链断裂,氢离子的浓度增加,与糖苷键作用的概率增加,导致水解加速。因此盐酸的浓度直接决定了反应进行的强度和速率,乙醇与水解温度的增加或减小,都决定了盐酸撞击淀粉分子的强度及频率,故它们之间交互作用最明显;乙醇浓度与水解温度交互作用比较明显,原因是乙醇可以阻碍盐酸与水分子的接触,使其不易糊化,可以适当提高水解温度进行反应,而水解温度决定了反应进行的速度,水解温度太低,反应不够强烈,导致水解率不高,淀粉分子比表面积小,吸附性不高,水解温度太高,虽然可以间接增加水解率,但是会使淀粉糊化,使其失去吸附性能;盐酸浓度与水解时间交互、乙醇浓度与水解时间交互、水解温度与水解时间交互的交互作用不明显,原因是水解时间虽然梯度增加,但是相对于总体水解时间基数来说,梯度不是很大,因此时间并不是主要因素。
2.2.3 响应面优化与验证
由回归方程得到的优化实验最优水解条件是:盐酸浓度2.24 mol/L、乙醇体积分数59.58%、水解温度50.70 ℃、水解时间为69.63 h,预测得到的淀粉微晶吸附姜黄素的量为2.425 mg/g。验证实验为方便操作,将条件简化为:盐酸浓度 2.2 mol/L、乙醇体积分数60%、水解温度 51 ℃、水解时间 69.5 h。此条件制备得到的淀粉微晶吸附姜黄素的量为2.422 mg/g,实测值与方程预测值较为吻合,能充分表明模型的正确性,可以用来优化超声辅助制备淀粉微晶的工艺。
2.3 淀粉形态观察
淀粉微晶在SEM下观测的形态如图2所示。通过电镜观察,发现原淀粉表面光滑没有孔洞,完整的表面结构使姜黄素进入淀粉内部困难,只能附着于淀粉分子表面,所以吸附性不好;随着水解时间延长,淀粉轻度水解,淀粉分子表面变得粗糙,淀粉分子开始出现孔洞,增加吸附位点和比表面积,从而增加了吸附姜黄素的能力;随着淀粉继续水解得更加彻底,淀粉分子呈现碎片化的状态,比表面积相对于原淀粉增加了;但是随着淀粉的碎片数量增加,其表面孔洞消失不见,淀粉比表面积反而降低,所以随着水解时间延长,淀粉吸附能力反而下降。
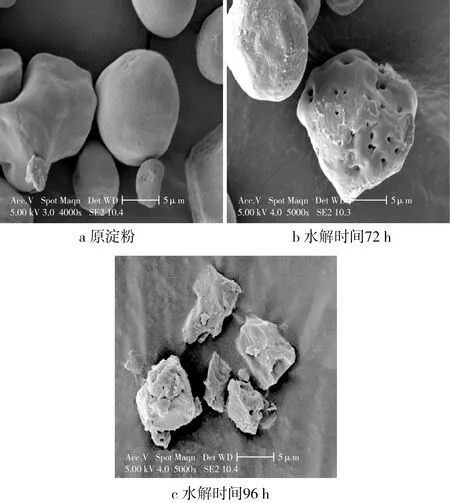
图2 淀粉微晶的形貌
2.4 X射线衍射图谱分析
不同水解时间的淀粉微晶及原淀粉的X-ray衍射图谱如图3所示,随着水解时间的增加,淀粉微晶和原淀粉的衍射角2θ均在15°、17°、18°和23°左右,峰值所在衍射角并没有随着水解时间的增加而发生偏移,这也说明超声波辅助酸醇水解制备得到的淀粉微晶的晶型并没有发生改变,且晶型与原淀粉一样均为A型[17]。随着水解时间的增加,结晶峰高度开始呈增长趋势,淀粉微晶的结晶度也随之增加,在水解72 h之后,淀粉中的结晶区的水解比例增加,结晶区吸水膨胀糖苷键断裂,淀粉链进行重排,从而导致淀粉微晶的结晶峰高度下降,结晶率降低。
以姜黄素吸附率为指标测定淀粉微晶的吸附性质,通过表4发现,水解时间为72 h为分界点,在72 h之前,随着水解时间增加淀粉结晶度和姜黄素吸附量不断增加。这是因为淀粉直链随着水解时间增加不断溶解,坚实的结晶区暴露,导致淀粉比表面积和吸附位点增加,粗糙的微晶颗粒表面非结晶区水解留下的孔洞可以良好的吸附姜黄素;在水解72 h之后,随着时间增加,吸附性能也随之降到原淀粉之下。这是由于淀粉颗粒长时间水解,颗粒中的淀粉链重排,淀粉链之间互相黏连,形成一种胶装的颗粒,无法良好地储藏姜黄素。
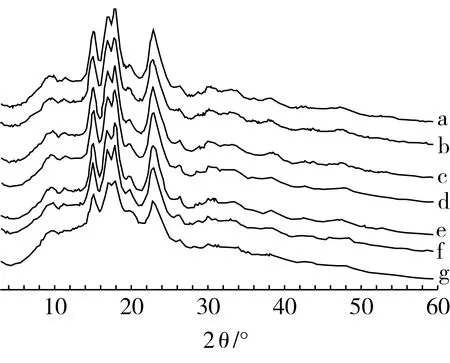
注:a 吸附姜黄素的量最大的淀粉微晶;b 水解96 h;c 水解84 h;d 水解72 h;e 水解60 h;f 水解48 h;g 原淀粉。表4同。图3 X射线衍射图
表4吸附量与结晶度
3 结论
超声波辅助酸醇水解制备得到的淀粉微晶晶型不改变,吸附位点和比表面积增加,对吸附姜黄素的能力有明显提高作用。通过响应面实验设计并优化制备得到的淀粉微晶吸附姜黄素的量为2.422 mg/g,比原淀粉吸附量0.709 mg/g提高241.61%。本实验影响因素少,反应条件简易可控,适合工业化生产,对淀粉的市场化应用具有一定的指导意义。
