重组人血清白蛋白-硫氧还蛋白融合蛋白对流感病毒所致急性肺损伤小鼠的保护作用*
2020-05-26付南燕韩晓群
付南燕,徐 娟,韩晓群
(宜春学院医学院 1病原生物学教研室,2生理学教研室,江西宜春336000)
感染流感病毒可导致多种疾病,如急性肺损伤(acute lung injury,ALI),其具有较高的发病率和死亡率[1]。研究表明,氧化应激在流感引起的ALI的发生和发展中起着重要的作用[2-3]。硫氧还蛋白(thioredoxin,Trx)是一种小型氧化还原蛋白(12 kD),广泛存在于人体中,是多种氧化应激条件下诱导的防御蛋白之一[4]。然而,Trx血浆半衰期在小鼠中仅为1 h左右,在大鼠中仅为2 h[5-6],为了获得满意的治疗结果,需要保持一定的Trx治疗浓度。为了增加Trx在血液中的保留时间,本实验利用毕赤酵母表达系统生产了一种由人血清白蛋白(human serum albumin,HSA)和Trx组成的基因重组融合蛋白HSATrx[7]。研究表明,在正常小鼠中 HSA-Trx融合蛋白的血浆半衰期与HSA相似,是Trx自身血浆半衰期的10 倍,此外,HSA-Trx在肺中的分布高于 Trx[7]。因此,本研究旨在探讨HSA-Trx对流感所致ALI小鼠的影响。
材料和方法
1 实验动物
60只SPF级5周龄健康雄性ICR小鼠,体重(31±1)g,购自上海斯莱克实验动物有限公司,实验动物许可证号为SYXK(沪)2016-0002;小鼠于12 h/12 h明暗循环、25℃和湿度(50±5)%的环境中,接受标准摄食和饮水,自适应饲养1周。
2 主要试剂
蓝色琼脂糖凝胶6FF、HiTrap Phenyl HP柱和PD-10脱盐柱(GE Healthcare);Diff-Quick试剂(Solarbio);考马斯亮蓝染色液、4′,6-二氨基-2-苯基吲哚(4,6-diamino-2-phenylindole,DAPI)和干扰素γ(interferon-γ,IFN-γ)ELISA试剂盒(BioLegend);水合氯醛、4%甲醛、Mayer苏木精溶液和1%伊红醇溶液(Sigma);诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)、8-羟基脱氧鸟苷(8-hydroxy-2′-deoxyguanosine,8-OHdG)抗体(Santa Cruz);3-硝基酪氨酸(3-nitrotyrosine,NO2-Tyr)抗体(Millipore)。
3 方法
3.1 HSA-Trx融合蛋白的产生 利用毕赤酵母表达系统生产了基因重组融合蛋白HSA-Trx[7]。将转化后的巴斯德毕赤酵母细胞在1.25 L BMGY液体培养基[1%酵母提取物,2%蛋白胨,100 mmol/L磷酸钾(pH 6.0),1.34%硫酸铵作为酵母氮源(无氨基酸),0.000 04%生物素,1%甘油](增长阶段)中培养2 d(A600=2),然后在30°C含有蛋白表达诱导剂和甲醇碳源的800 mL BMMY培养基[1%酵母提取物,2%蛋白胨,100 mmol/L磷酸钾(pH 6.0),1.34%硫酸铵作为酵母氮源(无氨基酸),0.000 04%生物素,1%甲醇](蛋白质诱导阶段)中培养3 d。每隔12 h加入甲醇,使甲醇浓度保持在1%,以维持蛋白表达诱导效应。融合蛋白在蓝色琼脂糖凝胶6FF柱上用200 mmol/L醋酸钠缓冲液(pH 5.5)进行色谱纯化,透析后在相同缓冲液上平衡。采用蛋白纯化仪,5 mL Hi-Trap Phenyl HP柱上进行疏水层析,采用以下条件:缓冲液A:50 mmol/L Tris-HCl/1.5 mol/L硫酸铵(pH 7.0);缓冲液B:50 mmol/L Tris-HCl(pH 7.0);梯度:0~100%缓冲液B 100 mL;流速:3 mL/min。融合蛋白在10%聚丙烯酰胺凝胶上进行SDS-PAGE分析,考马斯亮蓝R250染色。该融合蛋白的纯度可达97%以上。
3.2 ALI小鼠模型的建立及实验分组 本实验使用的小鼠H1N1流感病毒PR8株(A/Puerto Rico/8/1934)由中国医学科学院医学生物研究所提供,-80℃保存。将小鼠随机分为4组:健康对照(control)组、ALI组、ALI+Trx组和ALI+HSA-Trx组,每组10只。除健康对照组外,其余处理组小鼠在第0天使用水合氯醛(500 mg/kg)麻醉,流感病毒悬液鼻内接种,剂量为1.5×LD50(用LB培养液稀释流感病毒悬液),建立流感诱导的ALI小鼠模型。Trx或HSA-Trx组在病毒感染后第4天和第6天经小鼠尾静脉注射Trx或HSATrx(每只小鼠3.5 nmol蛋白,溶于200 μL生理盐水中),健康对照组和ALI组小鼠注射200 μL生理盐水。分别于相应时点处死小鼠,其中第0天于感染后2 h处死小鼠取材,进行疗效评价。生存率分析另外取小鼠进行ALI组和ALI+HSA-Trx组实验,从病毒感染第0~14天,每组10只,这些小鼠未测量其它参数。
3.3 肺灌洗样本分析 乙醚麻醉小鼠,打开胸腔,取血测定过氧化物(见下文)。气管插管,用1 mL含5×104U/L肝素的无菌PBS灌肺(2次),收集支气管肺泡灌洗液(bronchoalveolar larage fluid,BALF)。每只小鼠体内提取约1.8 mL BALF,混匀后取0.5 mL用血细胞计数器计算细胞总数。剩余BALF离心(250×g、10 min、4°C),弃上清液,在 0.9%NaCl中重悬细胞,用Diff-Quick试剂染色细胞,测定肺泡中性粒细胞数量。以BSA为标准品,采用考马斯亮蓝溶液法测定BALF中的蛋白浓度。采用ELISA法测定BALF中IFN-γ的含量。
3.4 肺组织的病理学检查 将肺组织固定于4%甲醛,石蜡包埋,4 μm切片,HE染色,观察病理学变化,采用免疫荧光法检测iNOS、8-OhdG和NO2-Tyr。采用HistoVT One进行抗原检索,用含有50 mmol/L Tris-HCl(pH 7.4)和0.1%吐温 20(T-TB)的溶液对肺切片进行溶解,在25℃用下BlockAce封闭15 min,加入I抗,4℃下过夜。此外,使用前用0.5%BSA在PBS中稀释(1∶50)I抗,并与DAPI溶液(10 g/L)偶联。用T-TB冲洗肺切片,25℃下与II抗反应1.5 h。iNOS和NO2-Tyr免疫染色采用Alexa Fluor 488山羊抗兔IgG(H+L)(Invitrogen),8-OHdG免疫染色采用Alexa Fluor 555山羊抗小鼠IgG(H+L)(Invitrogen),使用前在PBS中用0.5%BSA稀释(1∶2 000)。反应后,在显微镜下观察切片。利用ImageJ软件对iNOS、8-OHdG和NO2-Tyr免疫荧光染色的程度和强度进行图像分析。
3.5 血浆过氧化物水平的测定 于腹主动脉采血3 mL,并立即于 4℃、1 000×g离心 15 min,收集血浆,-80℃保存。使用CR2000RC分析仪测量血浆中过氧化物浓度。测量单位为U.CARR(Carratelli unit;1 U.CARR相当于0.8 mg/L过氧化氢)。
3.6 肺组织病毒载量测定 取流感病毒感染小鼠的左肺,称重,在1 mL RPMI-1640培养基中进行匀浆处理,100×g、4℃离心10 min,取上层清液,通过Madin-Darby犬肾(Madin-Darby canine kidney,MDCK)细胞空斑形成实验测定病毒滴度。将MDCK细胞接种于24孔板上,培养至融合。PBS冲洗,每次稀释0.1 mL接种至培养细胞,34℃孵育1 h。每孔加入DMEM 0.5 mL(含青霉素1×105U/L、链霉素100 mg/L和两性霉素B 0.5 mg/L),在5%CO2、37℃加湿培养箱中培养3 d。计算病毒斑,采用Reed和Muench公式计算50%组织培养感染剂量(median tissue culture infectious dose,TCID50)[8]。
3.7 FITC标记HSA-Trx评价其在流感病毒感染小鼠BALF中的分布 HSA-Trx(4 g/L)和FITC(1 g/L)溶于0.15 mol/L K2HPO4(pH 9.5)中,室温下混合4 h,经PD-10脱盐柱脱盐,洗脱液用Vivapore浓缩。病毒感染后第4天和第6天给模型小鼠静脉注射FITC标记的HSA-Trx(每只3.5 nmol),正常小鼠第0天给药,2 h后,用乙醚麻醉小鼠,打开胸腔,抽肺内干血液。气管插管,用1 mL含5×104U/L肝素的无菌PBS灌肺,收集BALF。每只小鼠体内提取约0.8 mL BALF。BALF在250×g、4℃离心10 min,将BALF中的细胞从液体中分离出来,采用分光光度计检测BALF中FITC标记的HSA-Trx含量。
4 统计学处理
计量数据表示为均数±标准差(mean±SD)。使用GraphPad Prism 7.0进行统计分析。单因素方差分析(one-way ANOVA)和Bonferroni多重比较分析各组间的差异。使用Kaplan-Meier对数秩检验分析生存曲线。以P<0.05表示差异有统计学意义。
结 果
1 HSA-Trx对流感病毒感染小鼠体重及存活率的影响
气管内注射1.5×LD50剂量流感病毒可引起小鼠急性肺损伤,BALF中的总细胞数增加、中性粒细胞的浸润和总蛋白含量升高在病毒感染后的第4~6天发生,见图1A~C。此外,流感病毒感染后病毒载量在第4天达到高峰后下降,见图1D。
ALI组小鼠的体重从病毒感染后第6天开始下降,病毒感染后第14天,仅20%小鼠存活,而HSATrx给药显著抑制了病毒感染小鼠体重的下降(P<0.05),在病毒感染后14天,70%的HSA-Trx治疗小鼠仍然存活,存活率显著高于ALI组小鼠(P<0.05),见图2。
2 HSA-Trx对流感病毒感染小鼠损伤的相对抑制作用
HSA-Trx处理小鼠后其BALF中总细胞数显著低于ALI组和Trx组的小鼠,中性粒细胞数显著低于ALI组小鼠(P<0.05),见图3A、B,HSA-Trx显著降低了ALI小鼠BALF中的蛋白浓度(P<0.05),而Trx对降低BALF蛋白浓度没有显著作用(P>0.05),见图3C。
HE染色的肺切片显示,与ALI组相比,HSA-Trx处理后肺切片的损伤程度有所减轻(P<0.05),Trx处理组肺切片的组织病理学结果与ALI组相似,见图3D。
3 HSA-Trx对BALF中IFN-γ水平及肺中iNOS表达的影响
与健康对照组相比,ALI组小鼠的IFN-γ和iNOS表达水平升高(P<0.05),而HSA-Trx处理后与ALI组之间没有显著性差异(P>0.05),见图4。
4 HSA-Trx对肺组织氧化应激的影响
与健康小鼠相比,流感病毒感染小鼠肺组织中8-OHdG和NO2-Tyr表达及血浆过氧化物水平均升高(P<0.01),而HSA-Trx则显著抑制了这些氧化应激标志物的表达(P<0.05),见图5。
5 在流感病毒感染小鼠BALF中FITC标记的HSA-Trx的分布

Figure 1.Evaluation of influenza virus-induced ALI model mice(0,2,4,6 and 8 days after viral infection).A:total cells in BALF;B:neutrophils in BALF;C:protein concentration in BALF;D:viral titers in lung tissues.Mean±SD.n=6.**P<0.01 vs day 0.图1 流感病毒诱导的ALI模型小鼠的评估
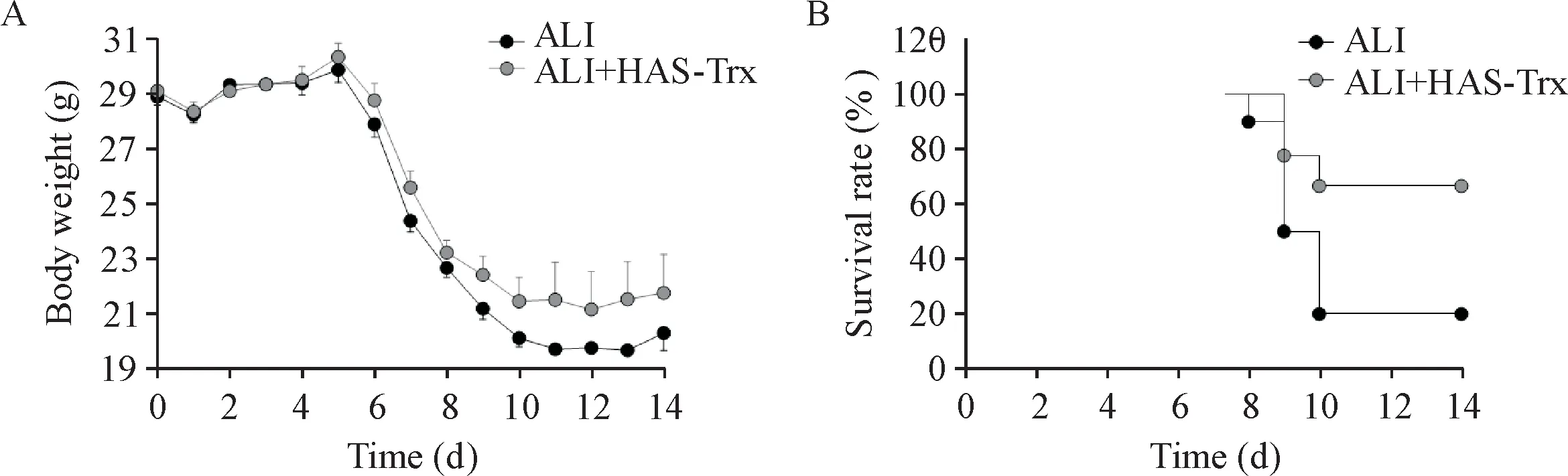
Figure 2.Effect of HSA-Trx on body weight(A)and survival rate(B)of mice infected with influenza virus.Mean±SD.n=10.*P<0.05,**P<0.01 vs ALI group.图2 HSA-Trx对流感病毒感染小鼠体重和生存率的影响
第6天FITC标记的HSA-Trx在BALF的分布大约是正常小鼠第0天的4倍(P<0.01),见图6。
讨 论
Trx对氧化应激相关或炎症相关的肺部疾病具有有效作用[9],流感病毒感染是造成肺炎的原因,并伴有ALI等并发症,可能导致死亡[1]。本研究表明HSA-Trx对流感病毒所致的ALI小鼠有一定保护作用。本研究利用甲型流感病毒H1N1诱导ALI,且在流感病毒感染后的病毒载量在第4天达到峰值,然后下降。因此,HSA-Trx在病毒感染后第4和6天用,显著降低了小鼠死亡率。结果与以前的报道一致[9],该研究中重组蛋白Trx-1提高了病毒感染小鼠的存活率。BALF中总蛋白的增加可以评估感染引起的ALI的严重程度[10],本研究中HSA-Trx显著降低了ALI小鼠BALF中流感病毒诱导的总蛋白含量,而Trx则没有显示出疗效。此外,从病理学上证实了HSA-Trx改善了小鼠H1N1诱导的肺损伤。与本研究结果类似,Trx对博来霉素诱导的肺损伤没有显示有效的保护作用[11]。因此,HSA-Trx的保护作用可能是与其在血液中滞留的时间延长有关[5-6]。

Figure 3.Relative inhibition of HSA-Trx in mice infected with influenza virus(8 days after virus infection).A:total cells in BALF;B:neutrophils in BALF;C:protein concentration in BALF;D:lung histopathology(HE staining,scale bar=100 μm).Mean±SD.n=6.*P<0.05,**P<0.01 vs ALI group.图3 HSA-Trx对流感病毒感染小鼠肺损伤的作用
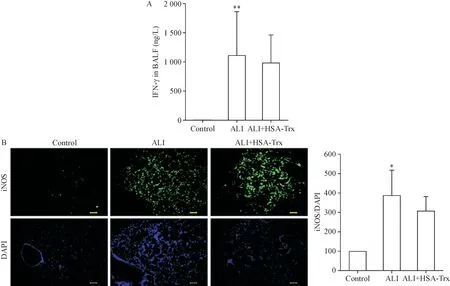
Figure 4.Effect of HSA-Trx on IFN-γ levels in BALF and expression of iNOS in lung tissue of mice infected with influenza virus(8 days after virus infection).A:IFN-γ levels in BALF;B:iNOS/DAPI immunofluorescence in lung tissue sections(scale bar=100 μm).Mean±SD.n=6.*P<0.05,**P<0.01 vs control group.图4 HSA-Trx对流感病毒感染小鼠BALF中IFN-γ水平和肺组织中iNOS表达的影响
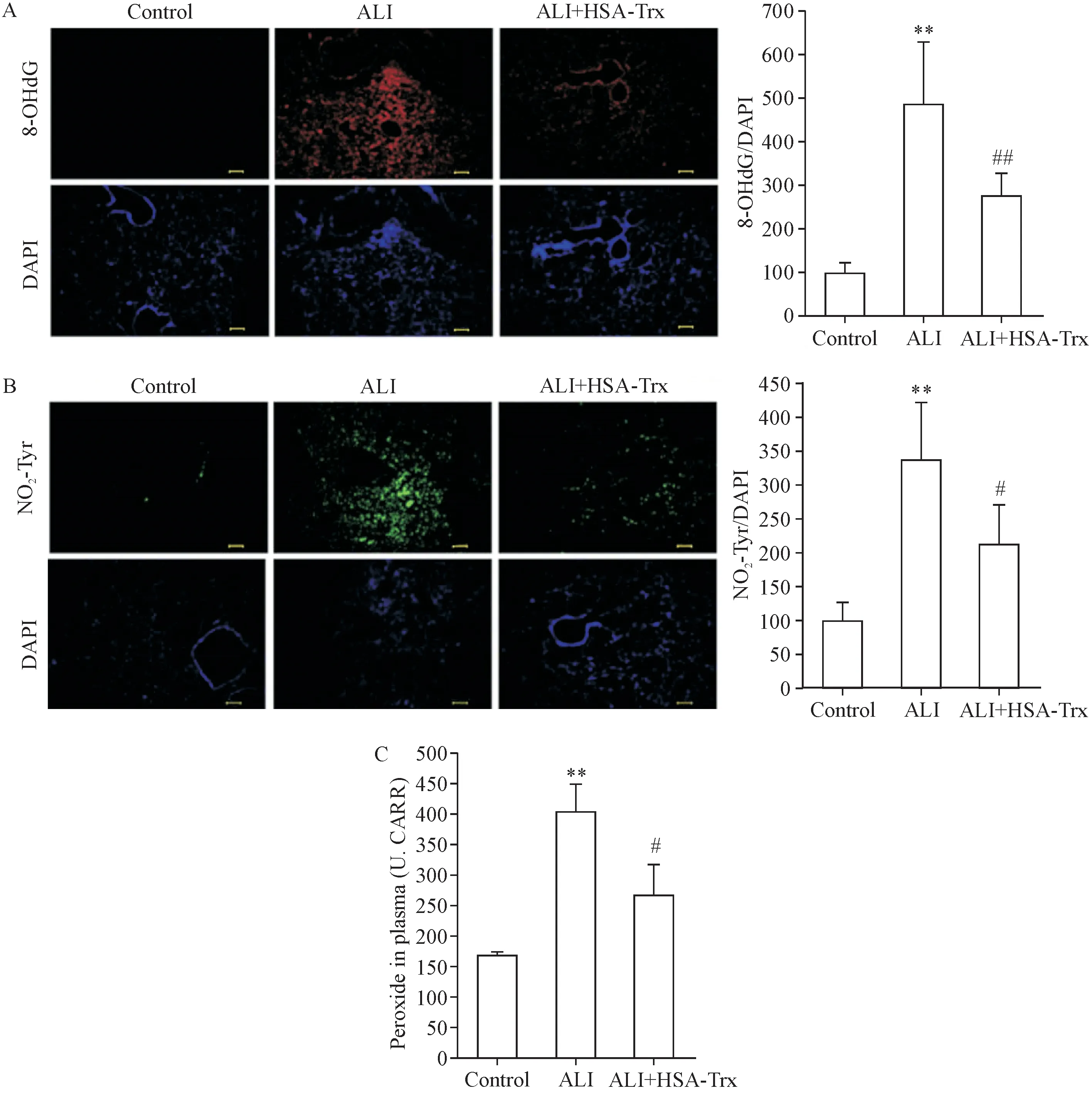
Figure 5.Effect of HSA-Trx on oxidative stress in mice infected with influenza virus.A:8-OHdG/DAPI immunofluorescence in lung tissue sections(scale bar=100 μm);B:NO2-Tyr/DAPI immunofluorescence in lung tissue sections(scale bar=100 μm);C:plasma peroxide levels.Mean±SD.n=6.**P<0.01 vs control group;#P<0.05,##P<0.01 vs ALI group图5 HSA-Trx对流感病毒感染小鼠氧化应激的影响
研究表明,流感病毒感染导致BALF中产生了大量IFN-γ,从而导致肺泡巨噬细胞、支气管和肺泡上皮细胞中iNOS表达上调[12]。但本研究中HSA-Trx并不能降低因病毒感染而产生的IFN-γ和iNOS表达水平。其他研究表明,活化的白细胞,尤其是肺泡巨噬细胞和中性粒细胞释放的ROS与流感诱导的ALI有关[2]。研究还显示BALF中的中性粒细胞浓度与肺部疾病严重程度呈正相关[13]。本研究中HSA-Trx对病毒感染引起的中性粒细胞的浸润有显著的抑制作用。事实上,中性粒细胞在流感病毒感染后到达肺泡,与白细胞(例如肺泡巨噬细胞)结合。此外,iNOS释放的NO与活化的白细胞生成的·O2-反应可以产生具有强损伤活性的ONOO-,ONOO-可以硝化多种生物靶点,如蛋白质和脂肪酸,产生NO2-Tyr加合物[14]。本研究中HSA-Trx显著抑制了肺组织中8-OHdG和NO2-Tyr的表达及血浆过氧化物这些氧化应激标志物的表达。此外,研究报道Trx通过抑制p38丝裂原活化蛋白激酶活化、L-选择素下调和内皮细胞粘附,对中性粒细胞产生抗趋化作用[5]。因此,HSA-Trx对流感诱导ALI的改善作用机制不仅与抗氧化作用有关,可能还涉及到抗趋化作用。
肺泡液体中白蛋白的浓度通常远低于血液中,然而在肺损伤的情况下,由于表面活性剂表面张力显著升高而导致血管高通透性,蛋白浓度可增加到血浆水平的75%~95%[15]。因此,BALF中白蛋白浓度在临床上被用作肺损伤的生物标志物。本研究结果表明HSA-Trx可明显降低流感病毒感染小鼠的BALF中蛋白的浓度。

Figure 6.Distribution of FITC-labeled HSA-Trx in BALF of influenza virus-infected mice.Mean±SD.n=6.**P<0.01 vs day 0.图6 FITC标记的HSA-Trx在流感病毒感染小鼠BALF中的分布
综上所述,HSA-Trx是一种持久的抗氧化剂和抗炎调节剂,其给药后能抑制流感病毒诱导的ALI,其机制可能是其抗氧化和抗趋化的共同作用,另外HSA-Trx在病变部位的分布有所不同,即在流感感染者肺间质的分布可能高于健康人。因此,HSA-Trx治疗流感病毒引起的肺炎可能具有相当大的潜力。
